FDA批准首个用于R/R滤泡性淋巴瘤的双特异性抗体mosunetuzumab(Lunsumio)上市
时间:2023-01-03 15:01:40 热度:37.1℃ 作者:网络
滤泡性淋巴瘤是非霍奇金淋巴瘤的一种形式,其中肿瘤生长缓慢,但随着时间的推移会变得更具侵略性。它是第二常见的淋巴瘤类型,在美国每年有13000例新病例。尽管治疗取得了进展,但仍然无法治愈并且复发很常见,每次连续治疗后结果都会恶化。随着Lunsumio的批准,患者可通过无需化疗的固定疗程治疗获得缓解,这种治疗可以在门诊进行。
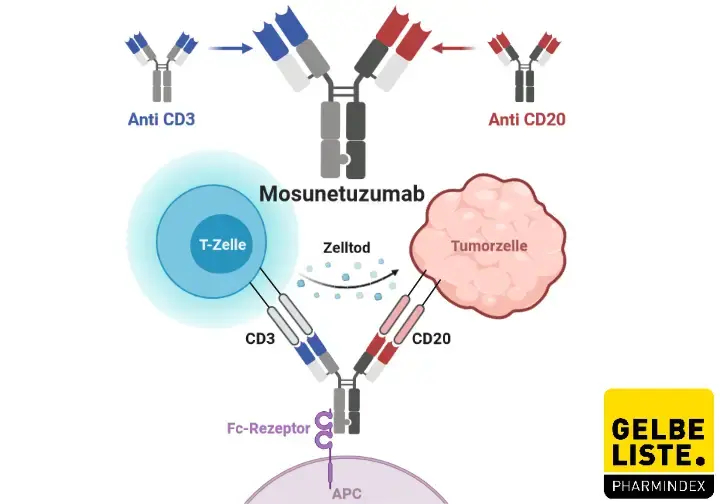
据罗氏集团成员基因泰克12月22日宣布,美国食品和药物管理局(FDA)已加速批准Lunsumio(mosunetuzumab-axgb)用于治疗两线或多线全身治疗后复发或难治性(R/R)滤泡性淋巴瘤(FL)成年患者。加速审批要求进行额外的研究,以提供药物安全性和有效性的确证证据。
首个滤泡性淋巴瘤双特异性抗体
Lunsumio是一种CD20xCD3 T细胞结合双特异性抗体,其靶向B细胞表面的CD20和T细胞表面的CD3。这种双重靶向激活并重定向患者现有的T细胞,通过将细胞毒性蛋白释放到B细胞中来参与和消除目标B细胞。
这是同类药物中第一个被批准用于治疗滤泡性淋巴瘤的药物,为CAR-T疗法提供了现成的替代方案,如Gilead的Yescarta(axicabtagene ciloleucel)和Novartis的Kymriah(tisagenlecleucel),这些疗法的生产和管理程序冗长复杂,需要住院治疗。
在给药方面,Lunsumio以固定持续时间的静脉内输注给药,允许暂停治疗,并且可以在门诊环境中输注。可能需要住院治疗特定的不良事件,在2级细胞因子释放综合征事件后进行后续输注应考虑住院治疗,并在3级细胞因子释放综合征事件后进行后续输注建议住院治疗。
Lunsumio将在未来几周内在美国上市。
Lunsumio的疗效及安全性
该批准基于一项非盲、多中心、多队列2期研究(GO29781;NCT02500407)的数据,该研究评估了接受过至少2种既往治疗(包括抗CD20单克隆抗体和烷化剂)的R/R滤泡性淋巴瘤成年患者使用mosunetuzumab-axgb的疗效、安全性和药代动力学。
结果显示,mosunetuzumab-axgb诱导了高且持久的应答率,客观应答率为80%(n=72/90[95%CI,70-88]),其中60%实现了完全应答,20%实现了部分应答。中位应答持续时间(DOR)为22.8个月(95%CI,10-未完成),大多数患者维持应答至少12个月(62%[95%CI,50-74])和18个月(57%[95%CI,44-70])。首次缓解的中位时间为1.4个月(范围:1.1至8.9)。
至于安全性,mosunetuzumab-axgb带有与细胞因子释放综合征(CRS)风险相关的黑框警告,包括严重或危及生命的反应。mosunetuzumab-axgb最常见的不良反应(发生率至少20%)是CRS、疲劳、皮疹、发热和头痛。最常见的3级或4级实验室异常(发生率至少10%)是淋巴细胞计数减少、磷酸盐减少、葡萄糖增加、中性粒细胞计数减少、尿酸增加、白细胞计数减少、血红蛋白减少和血小板减少。
详细链接:
Lancet Oncol:双抗Mosunetuzumab治疗复发或难治性滤泡性淋巴瘤的疗效


