Cell:庄小威团队描绘大脑衰老过程中分子特征和空间组织变化
时间:2023-01-05 12:02:33 热度:37.1℃ 作者:网络
哺乳动物的大脑在几年到几十年的时间内表现出显著的稳定性。由于大脑的再生能力有限,神经元必须在动物的整个一生中忠实地执行功能。然而,随着年龄的增长,神经元的长寿使得大脑对随时间推移而积累的损伤很敏感。这种神经元损伤,结合支持神经回路功能的非神经元细胞的年龄依赖性变化,被认为会导致大脑功能下降和与衰老相关的神经退行性疾病风险的增加。
对于大脑衰老来说,一个重要假设是与年龄和神经退行性变相关的神经元和突触功能的变化是大脑稳态环境被破坏的结果。在大脑中,神经元由大量非神经元细胞支持,各自细胞维持组织内稳态的不同方面。例如,少突胶质细胞使轴突髓鞘化,并为神经元提供代谢支持;星形胶质细胞为神经元提供营养和离子支持,并调节突触功能;小胶质细胞则提供免疫监测、突触修剪和吞噬清除碎片。大脑损伤、感染和神经退行性变已被证明会引发这些非神经元细胞类型的炎症激活,并招募外周免疫细胞,对邻近的神经元产生保护作用或有害作用。
最近对正常大脑衰老和神经退行性疾病的转录组学研究,以及对特定非神经元细胞类型(例如星形胶质细胞、小胶质细胞和内皮细胞)的研究,进一步强调了炎症激活在衰老相关衰退中的作用。特别是,在大脑感染或损伤期间通常在小胶质细胞和星形胶质细胞中触发的反应状态也会在正常衰老过程中出现。
虽然这些研究表明,与年龄有关的大脑内稳态的广泛破坏体现在各种细胞类型中,但这也带来了许多问题:
-
不同细胞类型和细胞状态的分子特征和空间组织如何随着年龄的增长而变化,这些变化与年龄诱导的炎症激活有什么关系?
-
被激活的细胞是如何在空间上分布的?
-
这种激活取决于环境因素和细胞间的通讯吗?
-
年龄相关性炎症与全身炎症反应有何关系?
目前,回答这些问题还具有相当的挑战性,因为大脑巨大的细胞数量和其中的分子复杂性阻碍了我们对动物一生中大脑结构变化的全面理解。
近日,哈佛大学庄小威团队在 Cell 发表了题为:Molecular and spatial signatures of mouse brain aging at single-cell resolution 的研究论文。
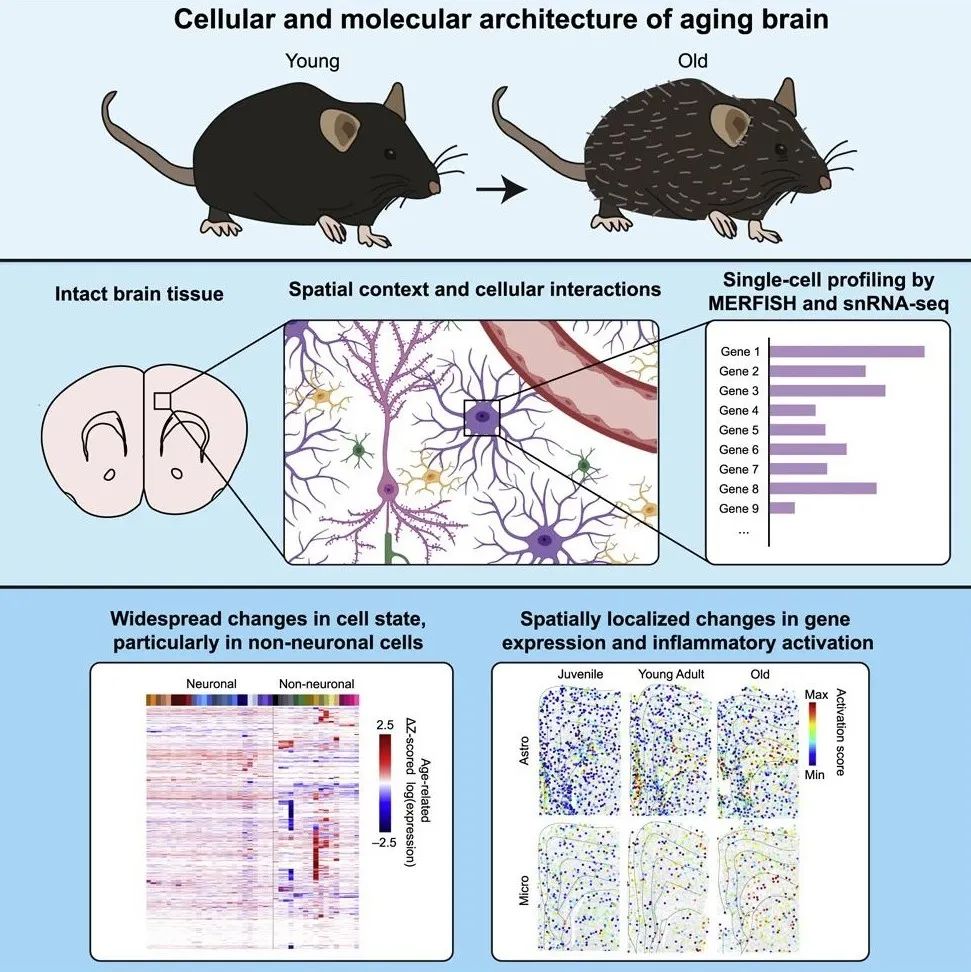
该研究开发了一种结合单细胞转录组成像、多重容错荧光原位杂交(MERFISH)和单细胞核转录组测序(snRNA-seq)的实验方法,对大脑衰老过程中细胞分子特征和空间组织的变化进行了系统描述。
使用这种方法,能够分析基因表达,并识别小鼠额叶皮层和层中细胞类型和状态,从而生成不同年龄的这些区域的空间分辨率细胞图谱。这一高分辨率细胞图谱揭示了神经元和非神经元细胞中与年龄相关的变化,并揭示了衰老过程中胶质细胞和免疫细胞激活的分子和空间特征。与脂多糖(LPS)诱导的变化进行比较,进一步揭示了由衰老和全身炎症刺激诱导的非神经元细胞激活的未知差异。

大脑中细胞的多样性和复杂组织阻碍了其细胞和分子结构中与年龄相关的变化的系统描述,限制了我们理解衰老过程中大脑功能下降机制的能力。
研究团队使用空间分辨单细胞转录组学在额叶皮层和纹状体内生成了高分辨率的大脑衰老细胞图谱,并量化了在小鼠寿命期间这些区域主要细胞类型的基因表达和空间组织的变化。研究团队观察到在细胞状态、基因表达和非神经元细胞的空间组织上有明显的变化。
这些研究数据揭示了衰老过程中胶质细胞和免疫细胞激活的分子和空间特征,特别是在皮层下白质中富集,并确定了衰老和全身炎症刺激诱导的细胞激活模式的相似性和显著差异。这些结果为大脑中与年龄相关的衰退和炎症提供了重要见解。
论文链接:
https://doi.org/10.1016/j.cell.2022.12.010


