Nat Neurosci最新研究:Tau通过激活小胶质细胞介导阿尔茨海默病患者的认知弹性
时间:2023-05-06 10:26:05 热度:37.1℃ 作者:网络
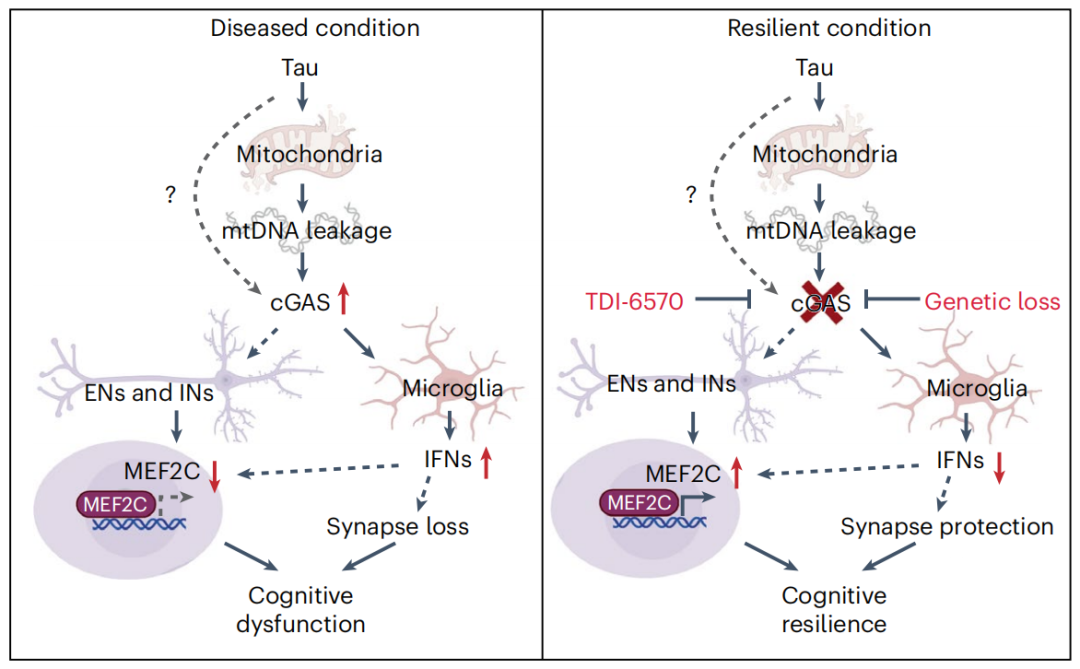
阿尔茨海默病(AD)是最常见的晚发性痴呆症,具有长期的无症状期,在这个期间,β淀粉样斑块和tau聚集物逐渐沉积,最终进入症状期,出现认知下降等症状。尽管这种转化的机制尚不清楚,但它与先天免疫反应、血管和代谢的改变相一致。先天免疫基因的单核苷酸多态性与散发性晚发性AD的易感性有关,表明不良的先天免疫反应是认知下降的原因之一。 在AD中,抗病毒反应通路被上调,并调节着小胶质细胞的疾病反应,包括免疫活化/抑制,衰老性和神经退行性疾病中的突触修剪。环状GMP-AMP合成酶(cGAS)是主要的抗病毒DNA传感器,结合双链DNA(dsDNA)并催化环状GMP-AMP(cGAMP)的形成,从而激活干扰素基因刺激器(STING)。STING招募TANK结合激酶1(TBK1)并促进TBK1自体磷酸化,以激活一型干扰素 (IFN-I) 的表达。研究表明,cGAS-STING通路在多类神经退行性疾病中推动有害的IFN-I活化,包括帕金森病(PD)、肌萎缩性侧索硬化(ALS)和亨廷顿病(HD)。cGAS-STING激活加剧5xFAD小鼠的淀粉样β病理学。虽然tau激活cGAS-STING通路并增加体外小胶质细胞中的NF-κB信号,但cGAS激活如何使大脑容易受到tau相关的认知下降的影响仍然未知。 2023年4月24日,Weill Cornell Medicine的Li Gan团队(共同一作为Joe C. Udeochu1、Sadaf Amin和Yige Huang)在Nature Neuroscience上发表了文章Tau activation of microglial cGAS-IFN reduces MEF2C-mediated cognitive resilience。在这项研究中,作者们探讨了P301S tau病理模型小鼠和人类AD患者的小胶质细胞(microglia)中cGAS-STING-IFN信号通路的激活情况。 通过行为学、电生理和单细胞核(sn)RNA测序等方法,研究人员证明了Cgas基因敲除对防止与MEF2C转录网络诱导的突触和认知缺陷相关的效应具有强效的保护作用,MEF2C是一个与认知弹性有关的基因。对AD患者的单细胞核(sn)RNA测序分析同样显示,小胶质细胞中的IFN-I基因和神经元中MEF2C转录网络发生了失调。 cGAS-STING 通路是如何在小胶质细胞被激活的?作为胞质DNA的传感器,cGAS可能被线粒体或细胞核DNA泄漏激活。研究人员发现,tau被吞噬后存在于线粒体和溶酶体中, tau纤维可以触发mtDNA释放到胞质中。通过耗竭mtDNA,tau诱导的干扰素反应会削弱,削弱程度与mtDNA浓度呈剂量依赖性。 通过Morris水迷宫测试,研究人员发现Cgas敲除显著的改进了P301S 小鼠的空间学习和记忆能力。tau诱导的海马突触可塑性缺陷与tau病理相关的记忆损失相关。在海马中测量Theta burst stimulation(TBS)导致的长期增强作用(LTP),发现P301S 小鼠中出现了晚期LTP缺陷,这一缺陷被Cgas基因的敲除所拯救。进一步测量海马CA1区域兴奋性突触后终端的标记物PSD-95,研究人员发现Cgas基因的敲除改善了CA1锥体神经元中tau病理诱导的PSD-95减少。 通过snRNA-seq,研究人员发现cGAS失活所提供的保护与认知弹性基因MEF2C的转录网络增强有关。MEF2C是AD风险基因,MEF2C基因座内的变异与人类智力差异相关。在snRNA-seq分析中,MEF2C是Cgas敲除后差别基因表达 (DEG) 上调最多的基因之一。Cgas基因敲除和cGAS药理抑制剂TDI-6570在tau小鼠神经元中都诱导了MEF2C靶基因表达,表明上调的MEF2C是认知保护机制的基础。在MEF2C靶基因中,Cgas敲除显著改变了兴奋性和抑制性海马神经元中涉及轴突指导、树突生长、突触维护、钙信号/稳态和神经元兴奋性的基因网络。使用STING激动剂DMXAA,证实了STING-IFN轴的激活通过干扰素α/β受体1 (IFNAR1) 下调神经元中Mef2c及其靶标基因的表达。 总之,这一研究将过度活跃的cGAS-IFN抗病毒反应与降低的MEF2C相关认知弹性联系起来,证实了恶性的先天性免疫反应会导致认知下降易感性的增加。在疾病中,cGAS过度激活促进了小胶质细胞的IFN-I反应,减少了神经元的MEF2C转录活性,并导致认知弹性的丧失。cGAS敲除减弱了小胶质细胞的IFN-I反应,增强了神经元的MEF2C转录网络和与tau病理相关的认知弹性。使用TDI-6570抑制cGAS可增强MEF2C靶基因,恢复突触完整性和记忆,支持靶向cGAS-MEF2C轴对增强抗AD相关痴呆的认知弹性的治疗潜力。 原文链接: https://doi.org/10.1038/s41593-023-01315-6