2022年肿瘤领域十大失败临床研究汇总
时间:2023-01-07 15:00:22 热度:37.1℃ 作者:网络
虽然受疫情的影响,但2022年无疑是肿瘤治疗领域飞速发展的一年,多款新药、新适应症获批上市,为肿瘤治疗注入新的力量。但2022年也有一些失败的临床研究,让研究者们吸取失败的教训,总结经验,勇敢向前(排名不分先后)。
1. LEAP002:可乐CP一线肝癌失败
LEAP-002是一项全球3期研究,旨在确认仑伐替尼和帕博利珠单抗联合治疗一线晚期肝癌的效果优于单独使用仑伐替尼。这是一项全球性,双盲,安慰剂对照研究。每组约400名患者被随机分配接受仑伐替尼和帕博利珠单抗或仑伐替尼和安慰剂。双重主要终点是总生存期和无进展生存期。
结果显示:总生存期(OS)的中位随访时间为32.1个月(范围25.8-41.1),仑伐替尼+帕博利珠单抗组与仑伐替尼单药组24个月的OS率分别为43.7% vs 40.0%(HR,0.840;95% CI,0.708-0.997;P=0.0227)。没有达到0.0185的安全阈值。
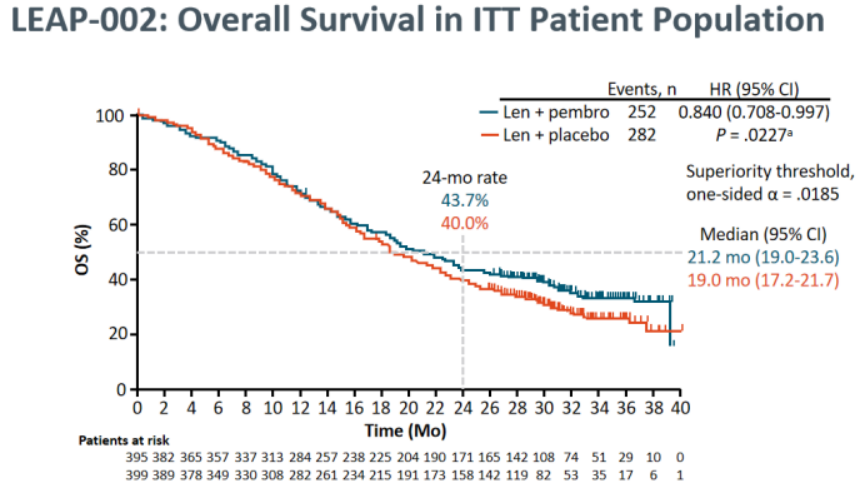
无进展生存期(PFS)的中位随访时间为17.6个月(11.3-26.6)。12个月PFS率分别为34.1%和29.3%,24个月PFS率分别为16.7%和9.3%(HR,0.834;95% CI,0.712--0.978)。结果不具备统计学显著性。
2.O+Y一线尿路上皮癌、肾癌辅助两大III期研究失败
2022年5月16日,百时美施贵宝公司(BMS)公布了纳武利尤单抗(nivolumab)联合伊匹木单抗(ipilimumab)一线治疗不可切除或转移性尿路上皮癌(UC)的III期临床试验CheckMate-901研究的最新结果。
结果表明,对比化疗,纳武利尤单抗联合伊匹木单抗未能改善肿瘤细胞PD-L1表达≥1%患者的总生存期(OS),同时未观察到新的安全性信号。数据尚未揭盲,独立数据监查委员会(IDMC)建议试验继续进行以评估其他主要和次要终点。
此外,BMS于7月29日宣布,CheckMate -914研究A部分,即评估Opdivo(nivolumab,纳武利尤单抗)联合Yervoy(ipilimumab,伊匹单抗)作为中高危局部肾细胞癌(RCC)患者的辅助治疗的3期研究,未达到盲法独立中央审查(BICR)评估的无病生存(DFS)这一主要终点,其安全性与既往联合治疗研究报道一致。
3.T药新辅助治疗乳腺癌并未改善pCR
2022年6月28日JCO在线发表了随机III期IMpassion050试验数据,结果令人大跌眼镜。临床前数据为癌症免疫治疗联合HER2靶向治疗HER2+乳腺癌提供了强有力的理论基础,且考虑到与晚期乳腺癌相比,早期乳腺癌(EBC)癌症免疫治疗预期会带来更大的好处。然而免疫检查点抑制剂(ICI)阿替利珠单抗并未带来pCR改善的结果,这可以说是大爆冷门了。

IMpassion050是一项双盲、随机、安慰剂对照研究,评价了新辅助阿替利珠单抗/安慰剂联合PH+化疗治疗高危HER2阳性EBC的疗效和安全性。主要终点是意向治疗人群(ITT)和PD-L1阳性人群的pCR率。次要终点包括PD-L1阴性肿瘤患者的pCR、无事件生存期(EFS)和安全性。
中位随访时间分别为15.7个月(阿替利珠单抗组)和15.9个月(安慰剂组)。阿替利珠单抗组的pCR率为62.4%,安慰剂组为62.7%(差异,-0.33%;95%CI,-9.23-8.57;P = .9551)。同样,对于PD-L1阳性肿瘤患者,阿替利珠单抗组的pCR率较低(64.2% vs 72.5%;差异,-8.26%;95%CI,-20.56-4.04;P = .1846)。
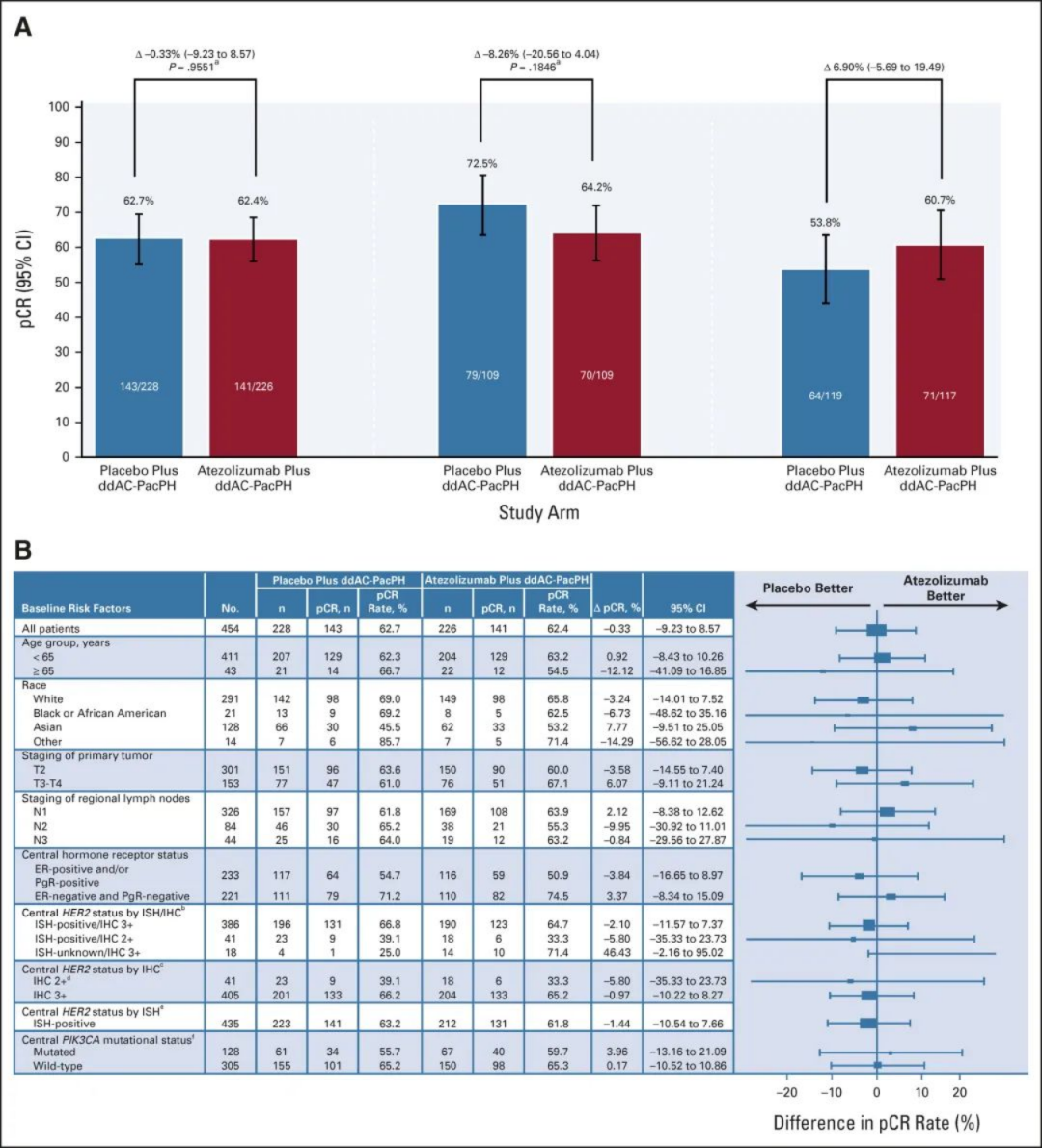
且与安慰剂组相比,阿替利珠单抗组中严重AE、3-4级AE和特别关注AE(AESI)的总发生率增加。
4.度伐利尤单抗治疗一线治疗NSCLC失败
PEARL是一项随机、开放、全球多中心的III期试验,旨在评估单药度伐利尤单抗与研究者选择的铂类化疗作为转移性NSCLC 患者的一线治疗效果。研究者选择的治疗可以是紫杉醇和卡铂、吉西他滨和顺铂、吉西他滨和卡铂、培美曲塞和顺铂或培美曲塞和卡铂等五种标准化疗方案中的一种。两个主要终点是肿瘤表达高水平PD-L1(TC≥25%)患者的OS,以及早期死亡风险低的亚组患者的OS。关键次要终点包括客观缓解率、缓解持续时间、无进展生存期(PFS)和健康相关生活质量等。
12月19日,阿斯利康宣布在肿瘤细胞PD-L1阳性(≥25%)的IV期非小细胞肺癌(NSCLC)患者中开展的III期PEARL试验(NCT03003962)研究结果表明,一线度伐利尤单抗(Durvalumab)单药相对于以铂类为基础的化疗,未能在统计学上显著改善总生存期(OS)。不过,在PD-L1肿瘤表达大于50% 的患者亚组中,度伐利尤单抗的OS有临床意义的改善,达到了研究的次要终点。
5.口服SERD两大巨头接连翻船
今年3月,赛诺菲宣布口服雌激素受体降解剂(SERD) amcenestrant用于激素治疗前后进展的局部晚期或转移性ER+/ HER2-乳腺癌患者的AMEERA-3研究失败。与医生选择的内分泌治疗相比,amcenestrant单药治疗未达到改善无进展生存期(PFS)的主要终点,Amcenestrant因此也成为了首个在关键临床中披露阴性数据的口服SERD。

AMEERA-3是一项随机、开放标签、II期临床试验,旨在评估amcenestrant单药治疗vs医生选择的单药内分泌治疗(包括氟维司群、阿那曲唑、来曲唑、依西美坦以及他莫昔芬)在既往接受过激素治疗的ER+/HER2-局部晚期或转移性乳腺癌患者中疗效和安全性。研究的主要终点是由独立中心审查评估的PFS,研究的次要终点包括总生存期(OS)、客观缓解率(ORR)、疾病控制率(DCR)、临床获益率(CBR)、缓解持续时间(DoR)以及安全性和生活质量评估。
赛诺菲表示将继续评估AMEERA-3试验数据,并与研究人员合作公布完整结果。amcenestran联合palbociclib一线治疗ER+/HER2-MBC的AMEERA-5研究以及早期乳腺癌患者辅助治疗的AMEERA-6研究将继续进行。
无独有偶,4月25日,罗氏公布第一季度财报,同时该公司透露口服SERD giredestrant在acelERA试验中未能达到改善PFS的主要终点。
6.PARP抑制剂卵巢癌后线适应症接连撤回
11月11日,GSK宣布撤回PARP抑制剂尼拉帕利二线治疗卵巢癌的部分适应症。早在今年9月,FDA撤回了尼拉帕利末线治疗卵巢癌、输卵管癌或原发性腹膜癌的适应症,同时撤回的还有奥拉帕利和卢卡帕利末线治疗卵巢癌的适应症。
近日撤回尼拉帕利末线治疗卵巢癌、输卵管癌或原发性腹膜癌的适应症,撤回的决定基于FDA对ENGOT-OV16/NOVA III期试验最终总生存期(OS)分析的审查。在NOVA试验的最终OS结果中,非BRCA突变患者(non-gBRCA)队列的OS次要终点的风险比(HR)为1.06 (95% CI: 0.81-1.37)。
奥拉帕利撤回的适应症为用于治疗有害或疑似有害生殖细胞系BRCA突变(gBRCAm)的晚期卵巢癌成人患者,这些患者接受过三线或三线以上的化疗。
今年9月撤回的适应症为单药治疗有害BRCA突变(生殖细胞系和/或体细胞)相关的晚期卵巢癌患者,这些患者既往接受过二线或二线以上的化疗。此次撤回是基于III期ARIEL4的最新数据。结果显示,卢卡帕利虽然可以延缓患者的疾病进展,但在化疗期间使患者死亡风险增加。
7.卡博替尼联合疗法治疗NSCLC的III期研究失败
12月8日,益普生(Ipsen)宣布,其酪氨酸激酶抑制剂卡博替尼的一项III期研究(CONTACT-01)未达到显著延长总生存期(OS)的主要终点,但未公布具体数据。该研究共纳入366例患者,旨在评估卡博替尼联合阿替利珠单抗和多西紫杉醇治疗未突变的转移性非小细胞肺癌(NSCLC)患者的疗效和安全性,这些患者在接受免疫检查点抑制剂和含铂化疗时或之后出现疾病进展。该研究的主要终点是总生存期,次要终点包括无进展生存期、客观缓解率和缓解持续时间。

8.疗效欠佳 波齐替尼上市遭拒
11月25日,Spectrum Pharmaceuticals宣布,三代EGFR抑制剂poziotinib(波齐替尼)的新药申请(NDA)遭FDA拒绝,用于先前接受过治疗的携带HER2外显子20插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者
此次NDA是基于II期ZENITH20研究中队列2的积极结果。该研究共包含7个队列,患者需接受每日1次16mg的波齐替尼:
队列1:先前接受过治疗的携带EGFR外显子20插入突变的NSCLC患者
队列 2:先前接受过治疗的携带HER2外显子20插入突变的NSCLC患者
队列 3:携带EGFR外显子20插入突变的初治NSCLC患者
队列 4:携带HER2外显子20插入突变的初治NSCLC患者
队列 5:符合队列1-4入组标准的患者
队列 6:在接受奥希替尼一线治疗期间疾病进展的获得性EGFR突变患者
队列 7:携带EGFR或HER2激活突变的患者
截至2021年3月5日,队列2共纳入90例患者,主要终点为客观缓解率 (ORR),次要终点包括疾病缓解率(DCR)和缓解持续时间(DOR),探索性终点为无进展生存期(PFS)。该队列的结果已于2021年11月发表在《临床肿瘤学杂志》上。结果表明,总体人群的ORR为27.8%(25例,95% CI:18.9%-38.2%),且全部为部分缓解,DCR为70.0%(95% CI:59.4%-79.2%),中位PFS为5.5个月。可评估疗效人群(N=74)的ORR为35.1%(95% CI:24.4%-47.1%),DCR为82.4%(95% CI:71.8%-90.3%)。此外,在实现部分缓解的25例患者中,中位DOR为5.1个月(95% CI:4.2-5.5)。
9.PALOMA-2:哌柏西利一线治疗乳腺癌OS数据失利
6月,辉瑞在2022 年美国临床肿瘤学会(ASCO)上公布了CDK4/6抑制剂哌柏西利(palbociclib)联合来曲唑与安慰剂联合曲唑相比,用于绝经后妇女的一线治疗ER+、HER2-转移性乳腺癌 (mBC)的7年半PALOMA-2随访数据。结果显示,哌柏西利并未在临床试验中改善新诊断的HR 阳性、HER2阴性乳腺癌患者OS。
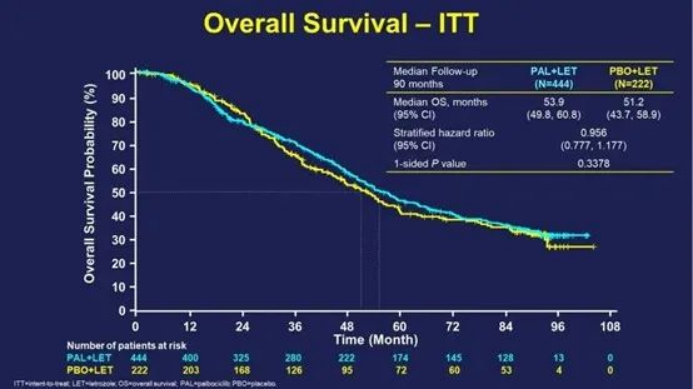
PALOMA-2是一项随机、双盲、III期临床研究,既往证实了相较安慰剂(PBO)+来曲唑,PAL+LET一线治疗ER+/HER2-晚期乳腺癌能显著改善PFS (中位PFS:27.6个月vs 14.5个月;HR=0.56 ,95%CI:0.46-0.69;P<0.0001)。
中位随访时间90个月后,总生存事件数为405(全体的60.8%),有相当比例的患者无法进行随访(撤回同意或失访)导致其数据删失。405例死亡中,PAL组和PBO组的中位OS分别为53.9个月(95%CI:49.8-60.8)和51.2个月 (95%CI:43.7-58.9)(HR=0.956,95%CI:0.777-1.177;分层单侧P=0.3378)。哌柏西利对比安慰剂,数值上显示出一定程度的总生存延长,但并未达到统计学差异。此次挫折也使哌柏西利成为唯一一款在III期临床试验中没有获得成功OS结果的CDK4/6抑制剂。
这并不是哌柏西利第一次在整体生存指标翻车。此前,哌柏西利已在PALOMA-3、PALLAS和PENELOPE-B等 III期试验中屡屡受挫。
10.tiragolumab一线SCLC、NSCLC双失利
tiragolumab是一种靶向TIGIT的新型癌症免疫疗法,TIGIT是一种在免疫细胞上表达的免疫检查点蛋白,由罗氏自己的科学家鉴定,tiragolumab作为一种免疫放大器、通过潜在地增强机体的免疫反应发挥作用。TIGIT和PD-L1在免疫抑制中均起着重要作用,同时阻断这2条途径可能通过增强机体对癌细胞的免疫反应来增强抗肿瘤活性。
5月11日,罗氏公布了III期SKYSCRAPER-01研究的中期结果,该研究评估TIGIT单抗tiragolumab联合PD-L1单抗Tecentriq一线治疗PD-L1高表达局部晚期或转移性非小细胞肺癌(NSCLC)的疗效以及安全性。 结果显示,该研究未达到其无进展生存期(PFS)的共同主要终点,另一个主要终点总生存期(OS)数据尚未成熟。但在两个共同主要终点中,可观察到数值改善,同时Tecentriq+tiragolumab组合表示出良好耐受性以及未发现新的安全信号。
但2022年ASCO年会上展示的随机 III期SKYSCRAPER-02试验(NCT04256421)的结果表明,在治疗新诊断广泛期小细胞肺癌(ES-SCLC)患者时,tiragolumab联合阿替利珠单抗+化疗方案中并没有增加生存数据。


