CMI(IF=22)| 武汉大学舒红兵/胡明明合作揭示肾上腺素对先天抗病毒反应的调节机制
时间:2023-01-09 18:02:21 热度:37.1℃ 作者:网络
在病毒感染时,细胞质模式识别受体检测病毒核酸并激活连接蛋白VISA/MAVS-或MITA/ sting介导的先天性抗病毒反应。然而,先天抗病毒反应是否以及如何受到神经元内分泌功能的调节尚不清楚。
2023年1月5日,武汉大学舒红兵与胡明明共同通讯在Cellular & Molecular Immunology(IF=22)杂志在线发表题为“β-adrenoreceptor-triggered PKA activation negatively regulates the innate antiviral response”的研究论文,该研究发现病毒感染降低了β-肾上腺素能激素肾上腺素和去甲肾上腺素的血清水平以及它们的受体ADRB1和ADRB2的细胞水平。研究进一步表明,肾上腺素/去甲肾上腺素水平的增加以ADRB1-/2依赖的方式抑制先天抗病毒反应。机制上,肾上腺素/去甲肾上腺素刺激激活下游激酶PKA,催化MITA在S241、S243和T263位点的磷酸化,抑制MITA的激活,抑制DNA病毒的先天免疫应答。此外,PKA在T54位点磷酸化VISA可拮抗RNA病毒的先天免疫应答。
总之,这些发现揭示了肾上腺素/去甲肾上腺素对先天性抗病毒反应的调节机制,并为在紧张和焦虑促进情况下增加宿主对病毒感染的易感性提供了可能的解释。

先天免疫反应是宿主抵御病毒感染的第一道防线。微生物中结构保守的病原体相关分子模式(pathogen-associated molecular patterns, PAMPs)被宿主模式识别受体(host pattern-recognition receptor, PRRs)识别,从而诱导I型干扰素(type I interferons, IFNs)、促炎细胞因子和其他下游效应基因。最重要的病毒PAMPs是病毒核酸,包括病毒DNA和/或RNA。在RNA病毒感染过程中,细胞质病毒RNA被细胞质RIG-I样受体(RIG-I-like receptor, RLR)家族成员感知,包括维甲酸诱导I型基因(retinoic acid-induced gene-I, RIG-I)和黑色素瘤分化相关基因5 (melanoma differentiation-associated gene 5, MDA5),它们被招募到线粒体相关适配器蛋白,称为病毒诱导信号适配器(virus-induced signaling adaptor, VISA,也称为MAVS, IPS-1和Cardif),传递信号。VISA是一个中心平台,激活下游的TAK1- IKKβ和TBK1/IKKε激酶,导致转录因子NF-κB和IRF3的激活和I型IFNs的诱导。
在哺乳动物细胞中,最广泛表达和激活的细胞质病毒DNA传感器是cGMP-AMP (cGAMP)合成酶(cGAMP synthase, cGAS)。DNA与cGAS的接合引发活性位点的构像变化,催化ATP和GTP合成第二信使cGAMP,进而结合并激活IRF3激活的内质网(endoplasmic reticulum, ER)膜相关适配蛋白中介(MITA,也称为STING)。激活的MITA通过ER-高尔基中间室(ER-Golgi intermediate compartment, ERGIC)从ER转移到核周点状结构。在这个过程中,MITA招募TBK1和IRF3,导致IRF3的磷酸化和I型IFNs的诱导。I型IFNs进一步通过JAK-STAT途径诱导下游抗病毒基因的表达,导致先天抗病毒反应。
压力和焦虑会增加人类感染病毒的脆弱性,如几种不同的呼吸道病毒株。然而,这种易感性背后的机制仍然知之甚少。在生理条件下,急性压力或焦虑会激活下丘脑-垂体-肾上腺皮质(hypothalamus-pituitary-adrenal cortex, HPA)轴和交感神经系统(sympathetic nervous system, SNS),导致应激激素的产生,包括糖皮质激素、肾上腺素和去甲肾上腺素。
近年来,应激激素对适应性免疫和炎症的调节已被报道。例如,多项研究揭示了糖皮质激素在脂多糖(lipopolysaccharide, LPS)诱导的炎症反应和T辅助细胞1 (T helper 1, Th1)分化中的抑制作用。此外,儿茶酚胺已被证明可以抑制LPS诱导的细胞因子和趋化因子的表达。去甲肾上腺素通过受体ADRB1/2抑制小鼠肠上皮内淋巴细胞和巨噬细胞中IFN-γ和TNFα的产生。最近,有报道称ADRB2信号通路可下调肝脏自然杀伤细胞(natural killer, NK)中IFN-γ的产生,以降低宿主对小鼠巨细胞病毒(murine cytomegalovirus, MCMV)感染的抗性。然而,压力激素是否调节先天抗病毒反应尚不清楚。
在这项研究中,研究人员发现病毒感染后小鼠应激激素肾上腺素和去甲肾上腺素的水平及其受体ADRB1/2的mRNA水平下调。此外,研究发现肾上腺素/去甲肾上腺素- ADRB1/2轴激活蛋白激酶A (protein kinase A, PKA), PKA反过来磷酸化先天免疫信号适配器MITA或VISA,抑制其活性,最终导致先天抗病毒反应的抑制。
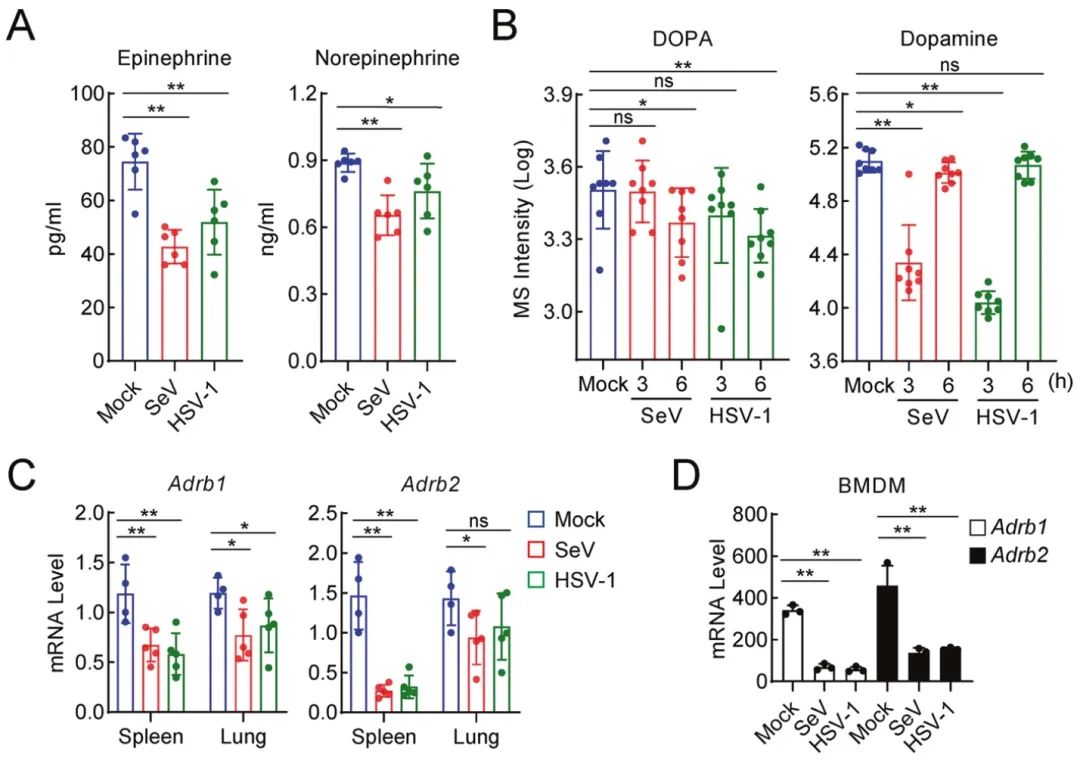
图1. 病毒感染会下调肾上腺素/去甲肾上腺素及其受体(图源自Cellular & Molecular Immunology )
研究表明,肾上腺和神经末梢分泌的肾上腺素和去甲肾上腺素在未感染状态下与受体ADRB1/2结合并激活下游激酶PKA。PKA在RNA病毒感染后在T54位点磷酸化先天免疫信号转导蛋白VISA,在DNA病毒感染后在S241、S243和T263位点磷酸化MITA。这种磷酸化反应抑制了VISA或MITA触发下游TBK1或IRF3激活抗病毒基因表达的能力。
进一步研究表明,病毒感染后,肾上腺素和去甲肾上腺素及其受体水平显著降低,从而抑制了肾上腺素和去甲肾上腺素对VISA-/ MITA介导的抗病毒先天免疫信号通路的抑制作用。病毒感染如何导致肾上腺素和去甲肾上腺素的分泌减少及其受体的下调,需要在未来的研究中进一步研究。
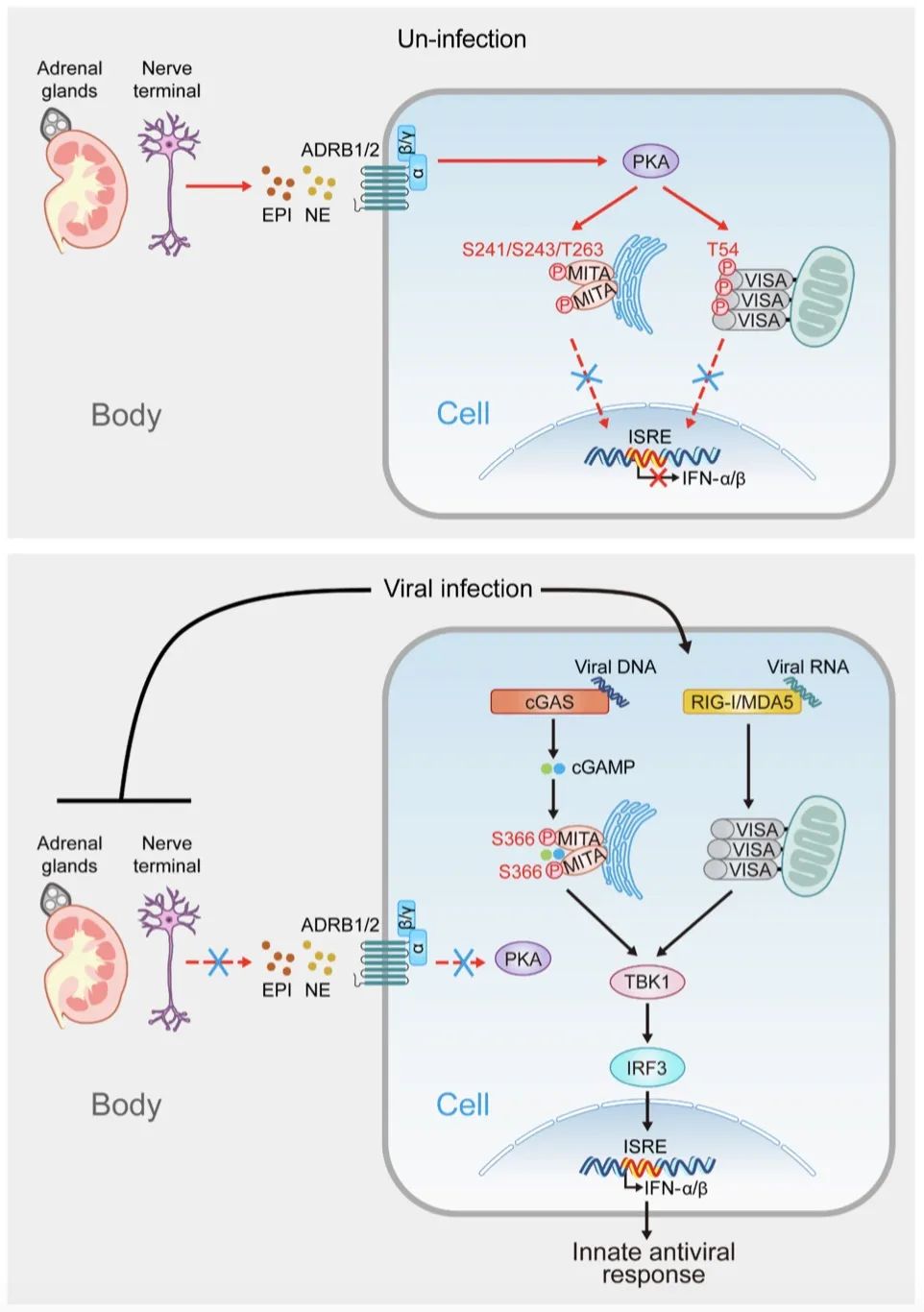
图2. 肾上腺素和去甲肾上腺素调节先天性抗病毒反应的工作模型(图源自Cellular & Molecular Immunology )
总的来说,这项研究揭示了体液肾上腺素和去甲肾上腺素对先天性抗病毒反应的保守和共同的调节机制。这一机制可能解释了I型干扰素在未感染状态下如何维持在基础水平,并为病毒感染后的先天性抗病毒免疫提供了一个检查点。调控这一机制可能有助于开发新的治疗传染病和炎症疾病的方法。
原文链接:
https://www.nature.com/articles/s41423-022-00967-x


