JCI | 浙江大学柯越海/张雪发现拟素化在结肠癌的肿瘤免疫抑制中起重要作用
时间:2023-01-15 12:01:42 热度:37.1℃ 作者:网络
巨噬细胞上的SIPRα与CD47结合以抵抗前吞噬信号,但SIPRα的下游信号如何控制肿瘤浸润性巨噬细胞(TIMs)仍不清楚。
2023年1月10日,浙江大学柯越海及张雪共同通讯在 Journal of Clinical Investigation(IF=19)在线发表题为“SHP2 deneddylation mediates tumor immunosuppression in colon cancer via the CD47/SIRPα axis ”的研究论文,该研究表明SHP2拟素化通过CD47/SIRPα 轴介导结肠癌的肿瘤免疫抑制。该已经报道了CD47 / SIRPα轴需要酪氨酸磷酸酶SHP2的去拟素化(deneddylation)。
在机制上,SHP2在K358和K364位点上被拟素化(neddylation),因此其自身抑制的构象得以维持。响应CD47配体SIRPα,SHP2被SENP8去拟素化,导致吞噬杯处相关底物去磷酸化,随后抑制巨噬细胞吞噬作用。此外,拟素化使骨髓-SHP2失活,大大提高了结直肠癌(CRC)免疫治疗的疗效。重要的是,作者观察到补充SHP2变构抑制剂使免疫治疗耐药的CRC对免疫疗法敏感。总之,该研究结果强调,对免疫治疗无反应的CRC亚型依赖于SIRPαhiSHP2hiNEDD8loTIM,并强调了在结直肠癌治疗中进一步结合SHP2靶向策略的必要性。

随着Fc γ受体的参与,巨噬细胞还通过抗体依赖细胞吞噬作用(ADCP)对治疗性抗体的临床成功做出了贡献。事实上,吞噬作用依赖于目标细胞的促进和反吞噬信号之间的平衡。最初在红细胞上观察到,CD47通过与循环吞噬细胞上的受体信号调节蛋白(SIRP⍺)结合来抑制吞噬。实体性恶性肿瘤和血液病恶性肿瘤都过度表达CD47以劫持内在机制,从而保护癌症免受免疫系统的检测和清除。
迄今为止,越来越多的研究已经证实阻断CD47-SIRP⍺可以重新激活巨噬细胞的吞噬功效。在小鼠肿瘤模型中,给予抑制该吞噬检查点的肿瘤调理抗体促进了治疗效果,SIRP⍺缺陷巨噬细胞通过进行免疫原性抗原呈递显示细胞毒性T细胞的激活。特别是,最近的临床研究表明,CD47/SIRP⍺轴中断显示出显著的协同作用,并改善了治疗性抗体的结果。
从机制上讲,CD47识别的SIRP⍺在细胞质区触发其免疫受体酪氨酸基抑制基序(ITIM)的磷酸化,导致酪氨酸磷酸酶SHP1和SHP2的募集,用于信号转导。最近的研究表明,整合素是SIRP⍺的下游效应子,用于细胞骨架重排,这是吞噬作用所必需的。CD47/SIRP⍺轴的新调控机制也被确定为不同的翻译后修饰范式。谷氨酰胺环化酶介导CD47蛋白的N-末端焦谷氨酸,这被认为对SIRP⍺结合至关重要。巨噬细胞SIRP⍺通过涉及肌球蛋白Y277和Y1805的去磷酸化级联调节吞噬杯的形成。这些发现提出了关于其他翻译后修饰参与调控SIRP下游信号⍺的问题。
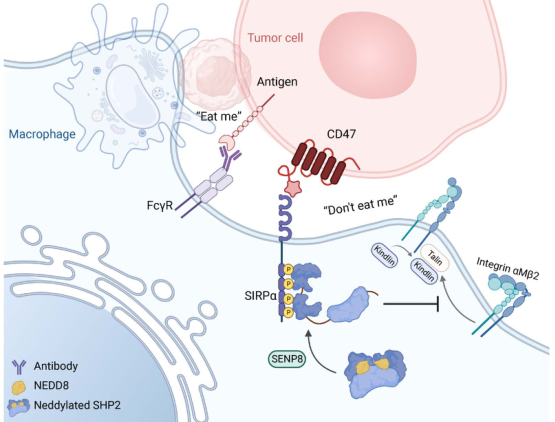
SHP2去拟素化以确保CD47/SIPRα信号的模型(图源自Journal of Clinical Investigation )
NEDD8的C端甘氨酸残基通过异肽键与目标蛋白赖氨酸的ε-氨基共价连接。NEDD8活化酶E1(异源二聚体NAE1和UBA3)、NEDD8偶联酶E2 (UBE2M 91和UBE2F)、E3连接酶和NEDD8特异性蛋白酶(包括SENP8和JAB1/CSN5)组成了NEDD8的类泛素化系统。
尽管Cullin-RING泛素连接酶泛素化活化对肿瘤细胞存活的作用已得到证实,但增加的非Cullin底物已被认为具有广泛的功能。最近,cGAS和Myd88被确定为巨噬细胞中的拟素化作用底物,这是拟素化作用参与肿瘤免疫微环境的有力证据。
在本研究中发现CD47-SIRP⍺信号在结直肠TIMs中触发底物去拟素化。该研究发现NEDD8在SHP2中结合K358和K364位点对于维持SHP2的自抑制构象至关重要。因此,SHP2需要被SENP8去拟素化,以确保其向SIRP⍺的激活和募集,并抑制巨噬细胞的吞噬作用。此外,PDL1治疗与SHP2变构抑制剂联合治疗可使免疫耐药CRC对免疫治疗敏感。总的来说,该研究为SHP2 抑制CD47/SIRP⍺轴阻断在结直肠癌免疫治疗中的潜在临床益处提供了有价值的线索。
原文链接:
https://www.jci.org/articles/view/162870


