PNAS | 南方医科大学黎孟枫/中山大学蔡俊超合作揭示ATOH8结合SMAD3诱导细胞衰老并阻止Ras驱动的恶性转化
时间:2023-01-16 12:01:08 热度:37.1℃ 作者:网络
癌基因诱导衰老(OIS)的发生过程以及OIS与恶性转化之间的关系尚不清楚。
2023年1月10日,南方医科大学黎孟枫及中山大学蔡俊超共同通讯在PNAS 上在线发表题为“ATOH8 binds SMAD3 to induce cellular senescence and prevent Ras-driven malignant transformation”的研究论文,该研究发现在肺上皮细胞中癌基因Ras过度激活后,高水平的转化生长因子β 1 ( transforming growth factorβ1,TGF-β1 )激活的SMAD3,而不是SMAD2或SMAD4,在诱导细胞衰老中起着不依赖于p53/p16/p15衰老通路的决定性作用。重要的是,SMAD3与潜在的肿瘤抑制因子ATOH8结合形成转录复合物,直接抑制一系列细胞周期促进基因,从而导致肺上皮细胞衰老。
有趣的是,衰老的SMAD3转化为致癌物质,本质上促进了致癌Ras驱动的恶性转化。此外,敲除Atoh8会迅速加速致癌Ras驱动的肺癌发生,并且由突变Ras和Atoh8缺失驱动的肺癌对特异性SMAD3抑制剂的治疗敏感,而不是由突变Ras驱动的肺癌。此外,在大约12 %的临床肺癌病例中可以发现ATOH8基因的高甲基化。总之,该发现不仅证明了上皮细胞衰老是由一个潜在的肿瘤抑制因子控制的转录程序指导的,而且证明了TGF-β/SMAD3的促衰老和转化作用之间的重要相互作用,为开发早期检测和抗癌策略奠定了基础。

基因突变导致的癌基因过度激活是正常细胞恶性转化为癌细胞的常见驱动力,如Kirsten大鼠肉瘤(KRas)突变。然而,在培养的正常细胞中异位表达突变型Ras会诱导永久性和不可逆的生长停滞,称为癌基因诱导的衰老(OIS)。OIS被证实为对恶性转化的内在防御,其特征是衰老相关的分泌表型(SASP)和永久性生长停滞,其中p38/p16和p53/p21蛋白已被确定为关键的启动子。然而,单独或共同过表达这些启动子可以明显减缓细胞生长,但通常不足以导致衰老表型。SASP由多种细胞因子、生长因子和蛋白水解酶组成,可同时发挥抑癌和促癌作用。然而,SASP是否以及如何参与OIS向恶性转化,目前尚不清楚。
作为SASP的关键组分,转化生长因子β1 (TGF-β1)单独作用足以诱导各种细胞类型的衰老。TGF - β诱导的细胞衰老过程中的细胞抑制效应主要由细胞周期调节因子介导,如诱导p15、p21和p27或抑制c-myc和hTERT。此外,TGF-β信号参与了紫外线(UV)暴露和氧化应激诱导的细胞衰老。有趣的是,TGF-β家族配体在SASP诱导的邻近正常细胞旁分泌衰老中也发挥着重要作用。肿瘤相关巨噬细胞分泌TGF-β1作为细胞衰老的关键诱导因子,以限制Myc驱动的淋巴瘤发生。相比之下,TGF-β也是众所周知的通过诱导上皮-间质转化(EMT)、增加肿瘤转移和诱导免疫抑制的肿瘤微环境来发挥肿瘤促进因子的作用。然而,在肿瘤发生发展过程中,TGF-β如何调控其促癌功能并转变为促癌作用,仍需进一步研究。
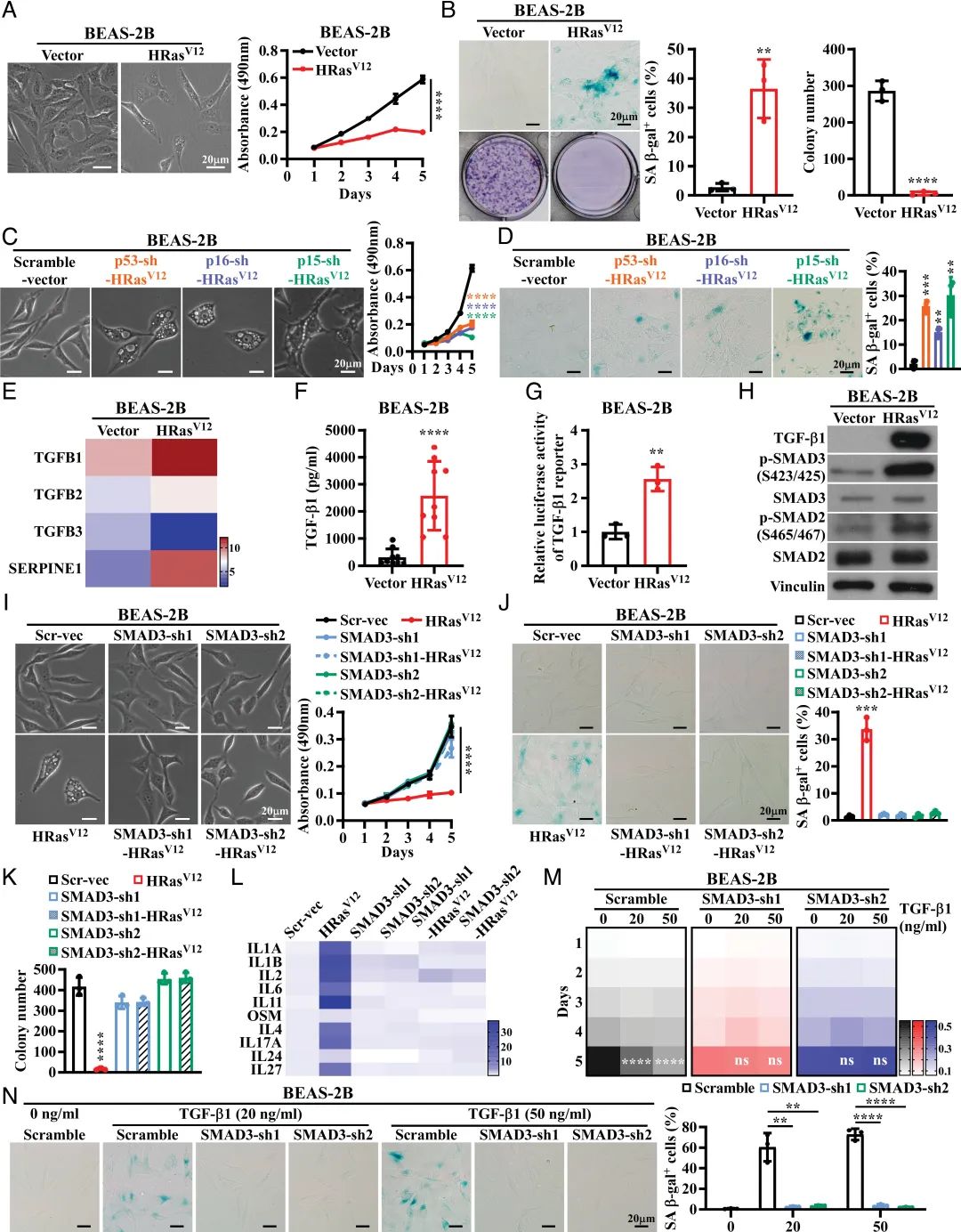
TGF-β1/SMAD3通路对RIS有重要作用(图源自PNAS )
TGF-β信号依赖于包含8个成员的SMAD蛋白家族。在TGF-β刺激下,它们的丝氨酸激酶受体被磷酸化激活SMAD2和SMAD3,后者通常与SMAD4形成同源或异源三聚体来调节下游靶基因的表达。选定的靶基因的转录以及TGF - β信号的生物学后果,强烈地取决于受体类型、SMAD复合物的形式和转录辅助因子等因素。
值得注意的是,SMAD4本质上促进TGF-β处理的癌前或恶性胰腺细胞发生EMT相关的凋亡,SMAD4缺失加速突变型Ras驱动的肿瘤发生,这解释了SMAD4失活发生在近一半胰腺导管腺癌(PDAs)中的事实。尽管SMAD蛋白在TGF-β的促肿瘤和抗肿瘤发生的效应中的作用已得到了很好的阐述,但SMAD蛋白在肿瘤发生早期如何介导TGF-β的促凋亡或转化作用仍不清楚。
在该研究中,研究人员发现在肺上皮细胞中,一个潜在的肿瘤抑制因子ATOH8与SMAD3结合,直接抑制一系列细胞周期促进基因,引起细胞周期阻滞,并在本质上促进了不依赖于p53/p16/p15途径的致癌性Ras或TGF-β1诱导的细胞衰老。ATOH8的缺失将衰老肿瘤抑制因子SMAD3转变为致癌因子,并将致癌Ras诱导的衰老(RIS)转化为恶性转化,为致癌Ras或TGF - β介导的上皮细胞衰老和恶性转化过程提供了新的见解。
参考信息:
https://doi.org/10.1073/pnas.2208927120


