Nature:炎症记忆和组织对疾病的适应性,超越免疫之外
时间:2023-03-11 06:00:12 热度:37.1℃ 作者:网络
我们的身体有一种非凡的能力,可以记住过去与过敏原、病原体、伤口和刺激物的遭遇,并对下一次同样的经历做出更快的反应。这种能力也有助于机体快速应对新的威胁,但这种过度的记忆也可能导致慢性炎症性疾病和癌症。
近一个世纪以来,生物学家、临床医生和流行病学家已经观察到很多适应性反应。免疫系统的“记忆”,指机体再次被感染时产生更有效抗病原体反应的能力。传统观点认为,免疫记忆是适应性免疫的一个标志。近些年,越来越多的研究显示,即使在没有B淋巴细胞和T淋巴细胞的情况下,炎症记忆仍然存在,比如先天免疫细胞的训练免疫,非免疫细胞的炎症记忆等。
-01-天生耐受性和训练有素的免疫力
Netea等研究人员,通常用“训练免疫(trained immunity)”来描述先天免疫细胞中的炎症记忆。不同于适应性免疫,“训练免疫”能够以非病原体特异性的方式启动。如果将这种“记忆”扩展到免疫系统以外的细胞,我们发现皮肤的上皮干/祖细胞会也记住它们的炎症遭遇,并对组织健康和功能产生持久而深远的影响;随后出现的其他组织干/祖细胞中有关“记忆”的类似报道,再次印证了长寿组织细胞拥有炎症记忆的观点。
先天免疫细胞的炎症适应,可以增强二次反应(免疫priming或训练免疫)或抑制耐受性(tolerance)以确保宿主健康。
Medzhitov研究团队通过检查巨噬细胞对细菌脂多糖 (LPS) 的反应来探索训练免疫的分子基础——有趣的是,促炎基因 (如IL-6) 表现出“耐受”行为,即其启动子处失去活性染色质标记,并在第二次LPS刺激后表现出转录抑制。相比之下,抗菌基因表现出“priming”行为,即在LPS再刺激时表达增强。这种增强的转录反应归因于RNA聚合酶Ⅱ可以更快地募集到primed的基因启动子上。Foster等人发现的基因“priming”反应,后来被称为“训练免疫”,现在已经在病原体攻击和/或接种病原体相关分子(如LPS和β-葡聚糖)的模型下进行了广泛研究。
▉ 寿命较长的先天免疫细胞:
然而,体外产生的巨噬细胞和外周血单核细胞只能存活几天。与外周血单核细胞相比,组织上驻留的更长寿命的巨噬细胞为研究人员提供研究持久“priming”效应的模型。
-
Chen等人发现蠕虫感染的影响在常驻的肺巨噬细胞中持续了45天,甚至在巨噬细胞转移到幼稚小鼠时仍然存在;
-
Yao等人发现腺病毒感染引起的记忆在组织驻留的肺泡巨噬细胞中持续了大约1个月;
-
其他组织驻留的免疫细胞(如先天淋巴细胞)也可以经过训练,在几个月后发生的病原体再次攻击时更强劲地增殖并产生炎性细胞因子。
总之,寿命较长的细胞可能拥有着更久的炎症记忆。
造血干细胞和在骨髓中产生的多能祖细胞,伴随我们一生产生骨髓和淋巴细胞谱系。先天训练如何比巨噬细胞和单核细胞的短暂寿命更长?
▉ 寿命较短的先天免疫细胞:
卡介苗(BCG)接种或β-葡聚糖可影响骨髓中的造血祖细胞,使其生成的髓系来源巨噬细胞和单核细胞向抗菌活性增高的方向转变。
高热量饮食也会引起炎症反应,带来更多的循环单核细胞和粒细胞,并增强了对LPS等刺激的反应。恢复正常饮食后,依然保留这一表观遗传记忆。其中,NLRP3炎症小体是连接饮食诱导的炎症和先天免疫启动的关键触发器。
炎症记忆和病原体保护能维持多久,问题仍然存在。
鉴于它们能够跨代传递信息,我们的生殖细胞可能是体内寿命最长的细胞。造血谱系中炎症训练的持续存在,可能严重依赖于编码记忆的细胞的寿命。
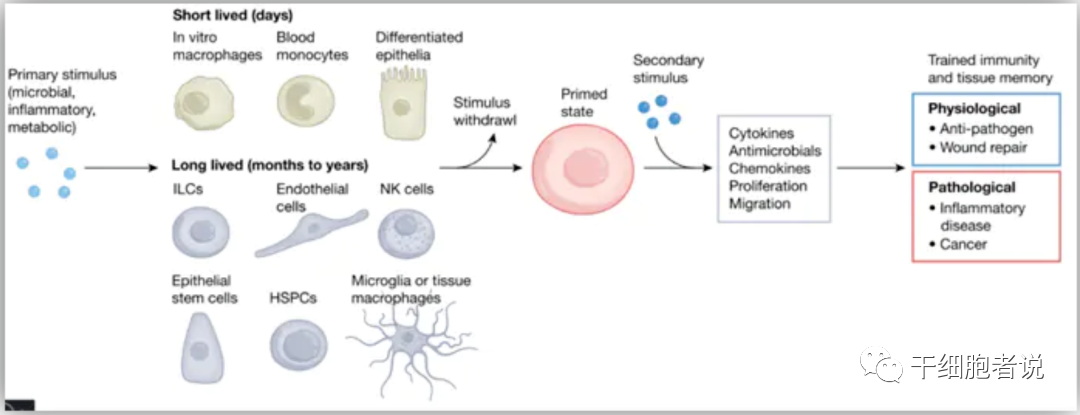
图1. 炎症与组织记忆概述
-02-炎症记忆,不仅仅是免疫细胞
免疫系统几乎无处不在,免疫细胞和组织细胞之间的交流在屏障器官(如皮肤)中尤为明显,因为屏障器官经常受到感染和炎症的攻击,通常是由激活的免疫细胞产生的细胞因子信号介导。
除了感知局部细胞因子环境外,非免疫细胞还具有感知和直接响应微生物刺激的能力。由此可能存在:细胞从炎症经历中保留的表观遗传记忆,可能不限于免疫细胞。而事实上,上皮干/祖细胞同样能够记忆发生过的炎症反应,并对组织适应性和功能产生持久的深刻影响。目前发现皮肤、肺、肠和胰腺的上皮细胞,以及神经元可能有这一功能。
组织祖细胞的持久记忆,可能也是其他组织炎症适应性的基础。除了上皮干细胞,内部分泌器官的上皮边界也受到炎性教育的支持,从而抑制组织损伤。
▉ 皮肤记忆
当皮肤短暂暴露于咪喹莫特(一种急性炎症刺激物,会激活类似于牛皮癣的17型免疫反应)时,随后愈合伤口能力增强。研究发现,除了刺激引发的应激反应,表皮干细胞还具有记忆其先前的微环境、细胞特性和功能的能力(如负责生发的毛囊干细胞也可以向表皮分化,同时在形成新的表皮后依然显著地保留了制造头发的能力)。
▉ 肌肉损伤记忆
肌肉损伤后也描述了类似记忆的状态。短暂的炎症暴露保护胰腺腺泡细胞免受随后的损伤,并限制腐蚀性胰腺酶释放到实质中。因此,除了屏障组织外,内分泌器官的上皮边界也受到炎症记忆的支持,炎症记忆被用来控制组织损伤。
炎症记忆可以传递给后代的概念,提供了对1944年荷兰饥荒的观察结果的解释,出生在饥荒期间的儿童比饥荒后出生的儿童表现出易患代谢疾病的倾向。因此,出现了这样一种情况:一个细胞必须直接经历有害的损伤、炎症介质或微生物感染,如果恰好是祖细胞,才可能将其“炎症记忆”的“经验”记忆传递给后代细胞。
非免疫细胞中的炎症记忆能持续多久?这一点目前尚无定论。
对实验室小鼠的研究表明,表观遗传记忆可以持续数月。值得一提的是,实验室小鼠是在相对无菌的条件下饲养的,并且在很大程度上不受外界各种压力因素的影响,这些压力因素可能会随着时间的推移增加或减弱对病原体、伤口或其他炎症刺激的记忆。针对人体组织或野生小鼠中炎症记忆的持久性和可逆性研究,可能会提供更准确。
-03-炎症记忆的机制
自从炎症引发或训练免疫作为概念开始以来,其根源就已经根深蒂固于染色质水平编码的表观遗传机制。最初的炎症或感染,引发细胞改变其组蛋白和染色质可及性,以激活炎症、抗菌和应激相关基因的转录。
在刺激消失不久后,大多数基因会恢复到基础表观遗传状态,一个队列在增强子处的 H3K4me1 标记和/或近端启动子处的 H3K4me3 标记的解析速度很慢。染色质在这些相关基因位点上也保持可及性,从而允许 RNA 聚合酶 II 的快速募集和二次触发时的转录激活。
至于细胞是如何触发炎症记忆的不同次级刺激结果的,目前部分研究对相关的机制进行了探索:
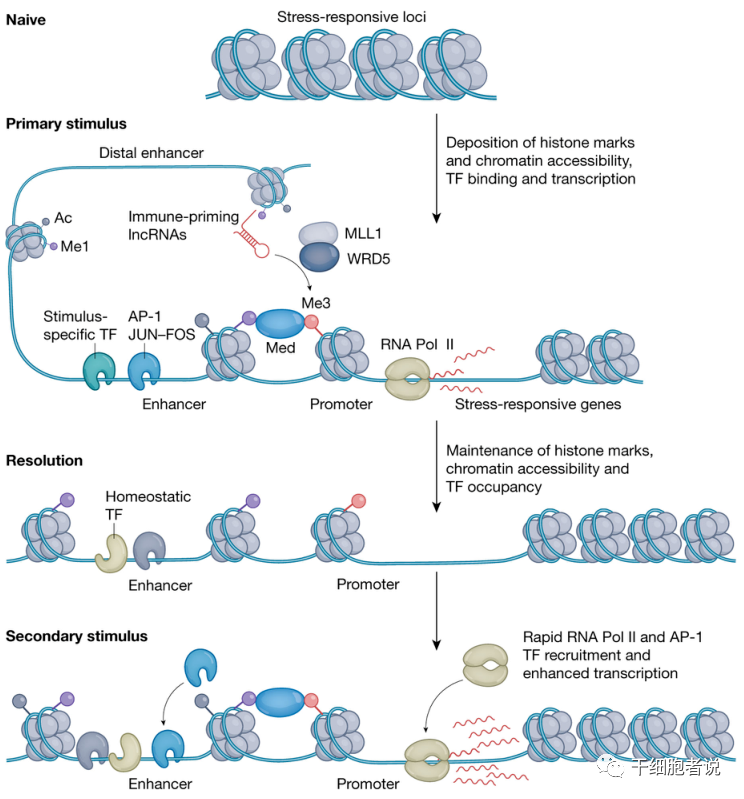
图2. 炎症记忆的机制
▉ 转录因子:非编码RNAUMLILO
在探索负责增强受过训练的免疫基因H3K4me3修饰的核机制时,Mhlanga 及其同事发现了UMLILO,这是一种长的非编码RNA,与基因座中的其他免疫基因相似,在单核细胞暴露于 β-葡聚糖时上调.基因激活后,随着拓扑相关染色质结构域的形成,免疫基因启动子与UMLILO紧密接近,然后将组蛋白修饰物 WDR5 和 MLL5 引导至这些基因,增强它们的 H3K4me3 标记并提高它们对随后的炎症反应的敏感性。
▉ 转录因子
多种转录因子可以与组蛋白修饰酶结合,也有转录因子可以作为先锋因子与核小体结合并直接打开染色质。
-
STAT家族成员被JAK-STAT信号传导到各种细胞因子下游迅速诱导;
-
NK细胞分别激活IFNα和IL-12下游的STAT1和STAT4;
-
皮肤中Th17型反应激活STAT3,是表皮干细胞建立表观遗传记忆必不可少的环节;
-
NF-κB由其抑制剂通过TNF或toll样受体信号传导而释放;
-
C/EBPβ水平可通过几种炎症相关通路之一升高,在β-葡聚糖引起的炎症记忆中具有STATs相似的作用。
▉ 转录因子:FOS相关的AP-1因子
研究发现,FOS相关的AP-1因子可能是记忆建立和回忆的必要成分。建立炎症记忆,不仅需要刺激特异性因子(如STATs),还需要一般的应激应答转录因子,从而打开通路,重塑染色质并激活转录。
一旦染色质被打开,不依赖炎症的、预先存在的转录因子就可以绑定并保存在记忆位点上。连同相关的组蛋白修饰,这些已存在的转录因子在炎症和应激反应转录因子不再存在后仍能保持可及性。值得注意的是,STATs并不需要FOS配合来获得和重新激活记忆相关基因的转录。
总体而言,解释了为什么在初始感染中幸存下来的组织和动物,通常会在下一次攻击中对更快的反应和更广泛的二次刺激敏感。
关于炎症记忆机制的许多问题仍然存在:
-
炎症记忆如何通过细胞分裂和分化保留,然后从一个细胞传递给其子代。
-
相同或不同谱系中的细胞如何存在异质性编码记忆。
-
是否可以人为地激活记忆位点以利用事实上的免疫力。
-04-炎症记忆与适应不良
尽管,“炎症记忆”在短期内对宿主生存起着至关重要的作用。但从长远来看,非适应性免疫中的炎症记忆,如果不加以控制,可能会导致慢性炎症性疾病和癌症。
具有“缓解-复发”过程的慢性上皮炎性疾病,通常在同一组织区域再次发生。
▉ 银屑病
银屑病是一种炎症性皮肤病,通常表现为由上皮过度增殖引起的红斑。值得注意的是,在缓解期间或成功的治疗干预之后,斑块消退并且皮肤看起来表型正常,但这些看起来正常的皮肤的转录分析揭示了疾病相关基因的持续存在,这些基因将其与健康的未受累皮肤区分开来。
尽管,尚未在人类银屑病中确定训练免疫的表观遗传因素。但其炎症记忆启动了后续的表皮干细胞改变。
▉ 炎性肠病
过敏和炎性肠病与类似的致敏性和复发性病理有关。事实上,虽然肠道干细胞的母体炎症训练保护了后代免受感染,但也恶化了结肠炎模型的病理学。炎性肠病的病理学是由结肠上皮损伤和修复的反复循环驱动的,最终导致胃肠功能的灾难性破坏。
周期性上皮损伤,会导致干细胞功能障碍的逐渐积累,伴随着炎症基因的表观遗传标记和炎症因子表达增加,最终导致再生失败。再生能力下降在反复截肢后的蝾螈中也观察到。
这说明:急性损伤可以加强修复机制,而重复损伤会促进慢性炎症,从而阻碍愈合。这是一把“双刃剑”。
总的来说,太多的好事实际上可能是有害的。因此,我们推测慢性炎症引起的组织损伤在我们一生中的累积效应,是细胞和机体衰老的关键驱动因素。事实上,炎症因子与端粒缩短有关,而老化的组织干细胞通常会在炎症基因位点积累表观遗传标记。
-05-小结
在过去的五年中,研究者开始意识到组织内的长寿细胞会记住它们的经历,并且能够以有益(抗病原体和促修复)或有害(炎症性疾病和癌症)的方式传递给下一代细胞。因此,通过组织内的长寿细胞调节组织反应的能力,可能也是一种保持健康和减轻疾病的有前途的手段。虽然,这并不容易实现。
毕竟,操纵细胞记忆,需要在不同的人类细胞类型中并遵循各种刺激下翔实而特定的记忆图,就类似于人类细胞图谱一样。“炎症记忆”,主要集中在长寿命的免疫细胞和上皮细胞上。
神经元的悠长寿命,成为长期储存表观遗传记忆的理想选择,其功能可能与小胶质细胞(这属于大脑的常驻巨噬细胞)合作完成。越来越多的证据表明:阿尔茨海默病与炎症和小胶质细胞功能障碍有关。小胶质细胞介导炎症记忆,或许是未来治疗阿尔茨海默病一个可能的开发方向。
原始出处:
Inflammatory memory and tissue adaptation in sickness and in health.Nature. 2022 Jul;607(7918):249-255


