STM:邓晓岚/陈建军团队报道磷酸化的TET1驱动B细胞急性淋巴细胞白血病发生与发展的分子机理
时间:2023-04-03 09:34:21 热度:37.1℃ 作者:网络
B 细胞急性淋巴细胞白血病(B-ALL)是淋巴细胞白血病的一种主要亚型。目前临床上仍然存在很多治疗问题,例如,成人B-ALL患者的5年生存率仅有30-40%;难治的B-ALL类型患者(例如MLL 基因重排和BCR-ABL1阳性)会经常抵抗现有的化疗和免疫治疗;仍然有一部分病人会复发等等。因此,目前急需开发新的治疗药物来改善临床中对难治或者高复发的B-ALL 患者的治疗效果。
TET1 基因最早被发现和鉴定为与MLL基因融合的伴侣基因, 在2009 年, 人们又发现TET1 蛋白是5-甲基胞嘧啶 (5mC) 的双加氧酶,可以去掉胞嘧啶的5-甲基化修饰 (1)。在过去的大量研究中表明, TET1以DNA去甲基化酶的身份在细胞发育,胚胎干细胞维持和发育等诸多方面发挥非常重要的调控功能。多项实体肿瘤研究显示, TET1 常常在肿瘤组织低表达并发挥肿瘤抑制性功能 (2, 3)。陈建军教授团队于2013年报道发现TET1在MLL重排的急性髓系白血病(AML)中发挥促癌的功能 (4)。接下来2015年的两篇报道发现,TET1敲除可以促进年龄大的小鼠(超过2年)发生B细胞淋巴瘤 (5),但是在年轻的小鼠(5-7周)中,TET1的缺失对B淋巴细胞的祖细胞和前体细胞没有影响 (6)。因此,人们一直认为TET1在B细胞肿瘤中往往都是像在实体瘤中一样发挥抑癌的功能。
2023年3月29日,美国希望之城国家医疗中心贝克曼研究所的邓晓岚副研究教授与陈建军教授团队在Science Translational Medicine 发表长文Phosphorylation stabilized TET1 acts as an oncoprotein and therapeutic target in B-cell acute lymphoblastic leukemia(陈振华博士为第一作者),首次揭示了TET1不依赖于去甲基化酶活性驱动B-ALL发生和发展的分子机制,并通过小分子抑制剂靶向磷酸化激酶破坏TET1蛋白的稳定性与Vincristine(一线治疗药物)联用协同治疗难治和复发的B-ALL。

为了探索TET1基因在B-ALL中的功能,作者把条件性敲除Tet1基因的小鼠前体B细胞与BCR-ABL1 或者NRASG12D基因转化的B-ALL模型结合起来发现,Tet1的敲除可以抑制B-ALL 细胞的恶性增殖并延长B-ALL 细胞的移植的小鼠生存时间。更为重要的是,作者发现在小鼠实验中,无论是过表达野生型的Tet1 蛋白还是酶活缺失的蛋白,都可以促进B-ALL的进展,说明Tet1在B-ALL中的促癌功能并不依赖它的去甲基化酶活性。接下来,作者发现TET1在B-ALL中的主要存在形式是一个截短体,并且该截短体广泛地高表达于各种亚型的B-ALL 细胞和病人样品,然而在健康细胞、AML细胞和B细胞淋巴瘤中,TET1的表达非常低或者无法检测的到。
更进一步,作者发现过表达野生型或者酶活缺失的TET1蛋白,均可以将健康小鼠前体B细胞转化为恶性增殖的B-ALL 细胞并在3-4个月内诱导免疫缺陷小鼠(NSG)发生B-ALL,进一步揭示该过程不依赖去甲基化酶的活性。在机制上,最终作者发现TET1蛋白的稳定性在B-ALL细胞中要高于其他细胞,提示蛋白翻译后修饰可能会调控TET1蛋白的稳定性。经过一系列的实验研究发现,TET1蛋白的第1164位苏氨酸和第1971、1976位丝氨酸分别受到蛋白激酶C Epsilon (PRKCE)和ATM蛋白激酶的磷酸化从而促进它的稳定和高表达。
在下游分子机制研究中,作者结合TET1-ChIP-seq与RNA-seq 测序数据发现,野生型或者酶活缺失型的TET1蛋白都主要结合在基因组中的启动子区域并调控B细胞增殖分化相关的基因。经过研究发现,TET1与转录因子STAT5B互作,增强其结合在CD72和JCHAIN基因的启动子区并促进它们的转录。早前的研究发现,STAT5B可以驱动B-ALL 的发生发展。该文进一步丰富了B-ALL 发病的机理,强调了TET1在其中参与的关键非酶活作用。CD72是B细胞受体信号通路中的关键蛋白,JCHAIN蛋白连接了IgA与IgM,最近两年来,这两个蛋白陆续被发现在B-ALL 中高表达,该文作者第一次分别阐明了这两个蛋白在B-ALL发展发挥关键致癌功能。
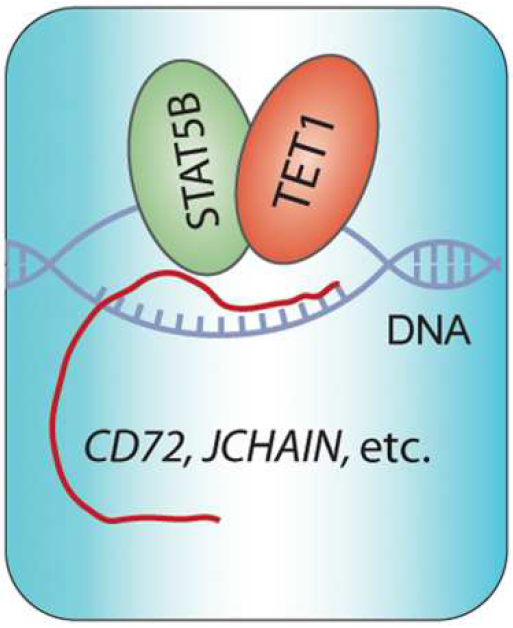
TET1和STAT5B在靶基因转录调控中的工作模型(图源自Science Translational Medicine )
最后,作者利用陈建军教授团队2017年发现的靶向TET1的转录因子(STAT蛋白)的小分子抑制剂UC-514321 (7),或者用STAT5B的选择性抑制剂AC-4-130处理B-ALL 细胞,发现它们都可以改善复发B-ALL PDX细胞移植的小鼠生存情况。更重要的发现是,作者用小分子抑制剂单独靶向PRKCE或者ATM蛋白,或者利用shRNA敲低它们的表达以减少TET1蛋白的磷酸化使其降低表达,都可以在体外抑制B-ALL细胞的增殖。
经过实验筛选后,作者发现ATM的抑制剂AZD0156与临床化疗药物Vincristine联合处理复发的、难治的B-ALL细胞表现出一定的协同作用,或者AZD0156与PRKCE的抑制剂Staurosporine联合具有类似的协同效果。作者在复发B-ALL PDX 移植的小鼠中,将ATM的抑制剂AZD0156 与Vincristine或者PRKCE的抑制剂Staurosporine分别联合起来处理小鼠,发现这两种药物组合与单独用药实验组相比,可以显著延长小鼠的生存时间。
来自美国希望之城国家医疗中心贝克曼研究所的陈振华博士,周克任博士,薛剑煌博士和Mr. Andrew Small 为本文的共同第一作者;邓晓岚副研究教授和陈建军教授为本文的共同通讯作者;浙江大学免疫所/良渚实验室研究员肖刚博士、广州实验室研究员翁桁游博士和中山大学肿瘤防治中心教授黄慧琳博士为该研究给予了大力支持和帮助,做出了重要贡献。
参考文献:
1. M. Tahiliani et al., Conversion of 5-methylcytosine to 5-hydroxymethylcytosine in mammalian DNA by MLL partner TET1. Science 324, 930-935 (2009).
2. B. Thienpont et al., Tumour hypoxia causes DNA hypermethylation by reducing TET activity. Nature 537, 63-68 (2016).
3. C. G. Lian et al., Loss of 5-hydroxymethylcytosine is an epigenetic hallmark of melanoma. Cell 150, 1135-1146 (2012).
4. H. Huang et al., TET1 plays an essential oncogenic role in MLL-rearranged leukemia. Proceedings of the National Academy of Sciences of the United States of America 110, 11994-11999 (2013).
5. L. Cimmino et al., TET1 is a tumor suppressor of hematopoietic malignancy. Nature immunology 16, 653-662 (2015).
6. Z. Zhao et al., Combined Loss of Tet1 and Tet2 Promotes B Cell, but Not Myeloid Malignancies, in Mice. Cell reports 13, 1692-1704 (2015).
7. X. Jiang et al., Targeted inhibition of STAT/TET1 axis as a therapeutic strategy for acute myeloid leukemia. Nature communications 8, 2099 (2017).


