CD19 CAR-T治疗B-NHL毒副作用临床管理中国专家共识(2022)
时间:2023-04-12 20:48:57 热度:37.1℃ 作者:网络
随着对CAR-T细胞特性的了解和CAR-T细胞治疗患者的经验增加,临床医生也越来越关注可能危及生命的CAR-T细胞相关毒性。CAR-T在恶性血液病中具有动态差异,且B-NHL中CAR-T相关毒性具有局部细胞因子释放综合征(L-CRS)等独特特征,但既往报道的CRS分级和管理指南很少提供关于管理毒性的具体建议。
国内数十位专家共同参与制定了《CD19 CAR-T治疗B-NHL毒副作用临床管理中国专家共识(2022)》,旨在为临床医生提供接受CAR-T细胞治疗B-NHL患者相关毒性的诊断、预防和治疗的标准化指南和建议。文章近日发表于《Cancer Biology & Medicine》,共同通讯作者为梁爱斌教授、韩为东教授和钱文斌教授,共同第一作者为李萍教授、刘洋教授和梁赟教授。现整理翻译供各位老师参考。


CAR-T细胞治疗前的基本检查程序应包括完整病史和体格检查,特别注意淋巴结部位、体能状态评估、诊断时淋巴瘤分类和分期记录、既往治疗和机会性感染评估(如适用)。实验室评价包括全血细胞计数(CBC)、尿液分析、血生化检查、综合代谢检查、血清铁蛋白和乳酸脱氢酶、弥散性血管内凝血检查(包括D-二聚体、纤维蛋白原、凝血酶原时间和部分凝血活酶时间测量),血清细胞因子[包括IL6、TNF-α]和C反应蛋白测量。其他推荐的检查包括HBV/HCV、HIV和梅毒螺旋体抗体。EB病毒、巨细胞病毒和人类疱疹病毒检测在某些情况下可能有用。影像学和其他检查包括使用造影剂的胸部/腹部/盆腔CT和/或全身PET/CT、MRI、心电图和超声心动图。如果怀疑结外受累,尤其是骨髓(BM)、胃肠道(GI)、胸膜/腹膜和中枢神经系统(CNS)受累,应进行相关检查,包括BM活检加穿刺、内镜超声以及浆膜和腰椎穿刺以分析浆膜积液和脑脊液(CSF)。建议对重要器官受累的患者进行器官功能检查,可选的检查包括BM细胞遗传学(核型分析)和肺功能检查。
上述检查可识别发生重度毒性风险较高的人群,相关高危因素包括:(1) ECOG≥3分;(2) 年龄≥70岁;(3) 高肿瘤负荷,即所有病灶最大直径之和(SPD)≥100 cm2;(4) 巨块型病灶,直径≥10cm;(5) 病灶位于咽部或气管旁,且存在压迫症状;(6) 病灶临近空腔器官(如胃肠道或胆管),可能因肿瘤压迫和浸润而诱发器官功能障碍;(7) 浆膜受累伴大量浆膜腔积液(胸腔/腹腔积液);(8) 乙型肝炎抗原血清阳性,乙型肝炎病毒(HBV) DNA拷贝数高于正常值上限,或未经抗病毒治疗的活动性HBV感染;(9)重要器官(如肺、肾或骨髓)受累;(10) 肿瘤相关发热。

CRS定义为免疫治疗后的超生理免疫应答,导致内源性或输注的T细胞和其他免疫效应细胞过度活化。接受CAR-T细胞治疗的B-NHL患者中CRS的发生率为23%-93%,2%-22%为重度CRS(sCRS,≥3级)
CRS的机制仍不明确。最近的研究表明CRS的主要促成因素是活化的单核/巨噬细胞而非CAR-T细胞,并且内皮活化和巨噬细胞释放的儿茶酚胺可能涉及CAR-T细胞治疗期间细胞因子释放的放大和炎症损伤的增强。焦亡细胞释放的损伤相关分子模式可能是巨噬细胞/巨噬细胞活化的上游触发因素。CAR-T细胞通过CD40-40 L、CD69、淋巴细胞活化基因-3、TNF-α与巨噬细胞直接接触也可在这一过程中发挥重要作用。
CRS的分类和分级
B-NHL的CRS具有独特特征,因此必须细化B-NHL中CRS的分类和分级,以帮助临床医生有效识别和管理该AE。
CRS根据发病时间可分为急性CRS(输注后1-3周)、晚期CRS(迟发型急性CRS,输注后3-6周)和慢性CRS(输注后≥6周),还可根据受累位置和影响范围分为局部细胞因子释放综合征(L-CRS)和系统性CRS (S-CRS)(图1)。
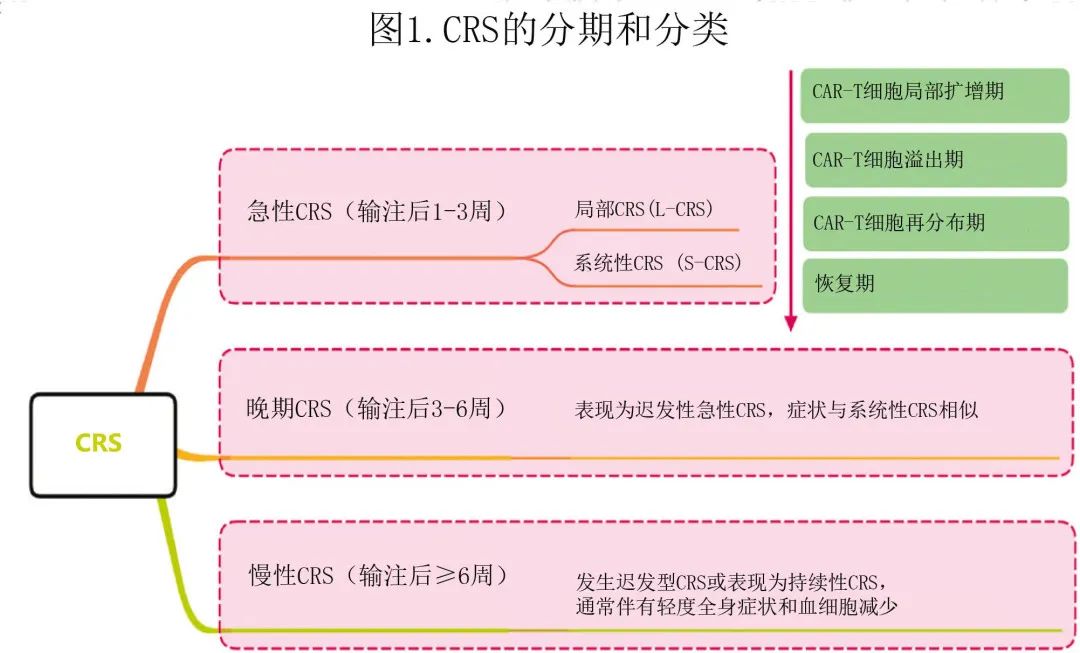
在 CAR-T细胞治疗的早期阶段,输注的CAR-T细胞在肿瘤中聚集、局部扩增,并释放多种细胞因子进而触发局部炎症反应,定义为L-CRS。随后局部扩增的CAR-T细胞和细胞因子“溢出”到循环系统中,从而促发S-CRS(图2)。
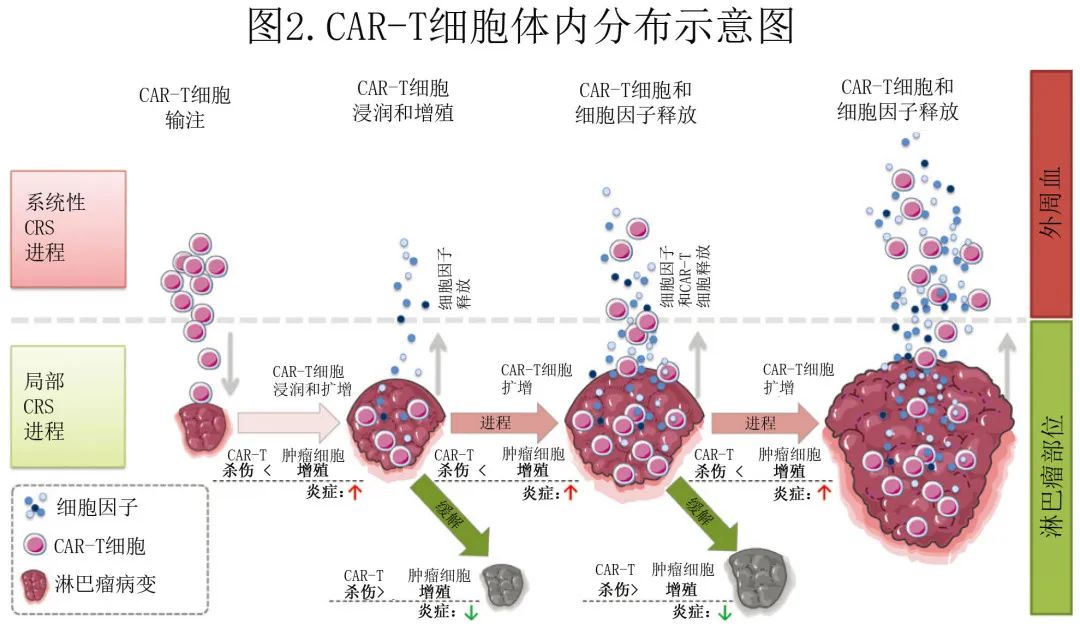
L-CRS多见于肿瘤负荷高或巨块型的患者,表现为病灶内或病灶周围发红/肿胀/增大和渗出/积液,甚至病灶部位穿孔或出血。与L-CRS不同,S-CRS的临床表现以发热、低血压、缺氧为特征,伴或不伴器官功能障碍。鉴于既往发表的CRS分级系统仅基于S-CRS症状的严重程度,可能并不完全适用于B-NHL,作者提出了一种新的CRS分级系统,其中结合了L-CRS的特异性表现,分级定义为存在发热(≥38℃)、血流动力学受损的严重程度、缺氧的严重程度和组织和器官周围病变的局部炎性表现的严重程度(表1)。

急性CRS的监测和管理
CRS风险的峰值窗口通常是CAR-T细胞输注后的前3周,这也是CRS管理的关键时期,因此临床医生必须密切监测患者,以确保CRS的早期诊断和及时干预。检查应包括完整的体格检查,特别关注生命体征和病变部位、器官系统评估和实验室检查。建议从CAR-T细胞输注开始进行心电图监测,直至急性CRS缓解;而对于sCRS高危患者,该监测应持续至少3周或直至高危因素纠正。实验室检查包括CBC、完整代谢检查、血生化检查、凝血检查、血清铁蛋白、乳酸脱氢酶、血清细胞因子分析和CAR转基因拷贝(或外周血单核细胞中的CAR-T细胞百分比),必须在输注后2周内每周至少复查(共3次),接下来2周每周一次,此后每3个月一次。对于sCRS高危患者,应更频繁甚至每天进行上述检查。也可考虑特定患者进行影像学检查,以评估病变和受累器官。
B-NHL中的CRS应按照该毒性的分级进行管理,如表2所示。
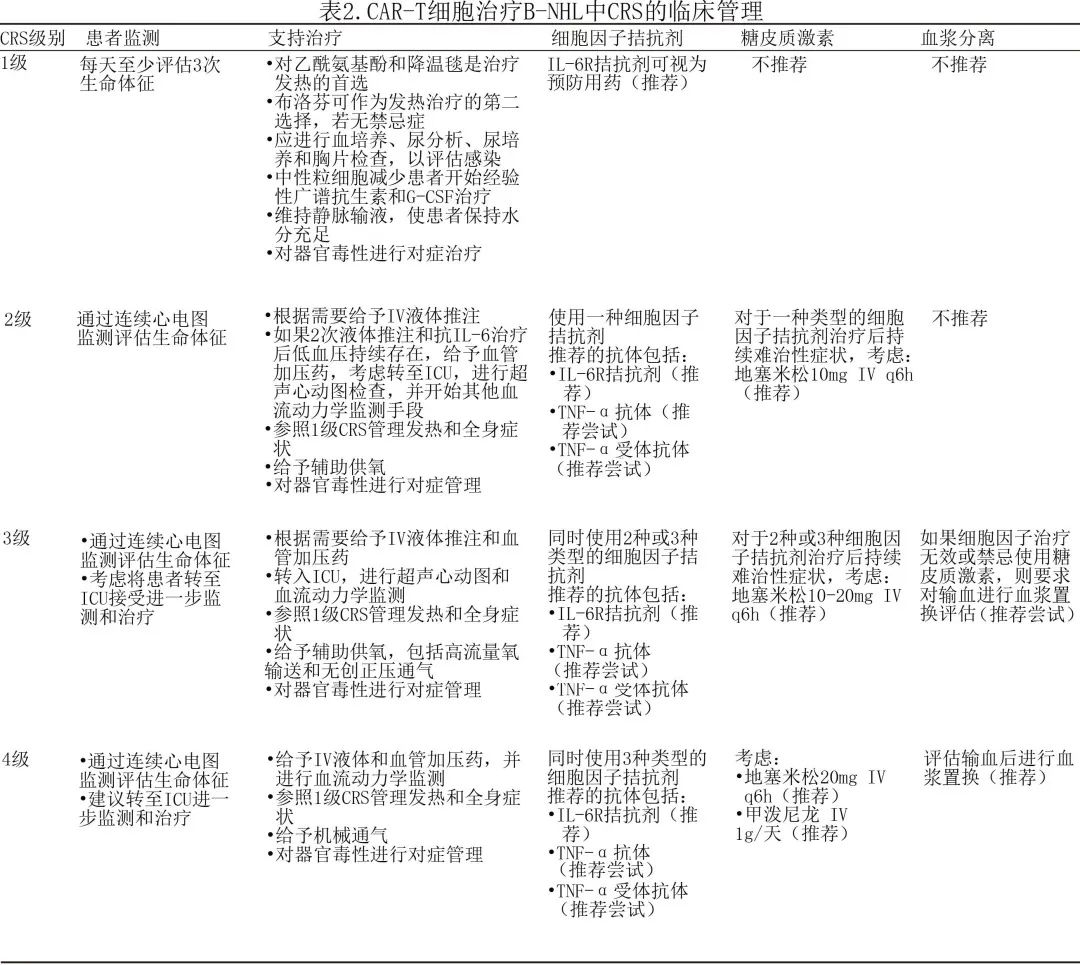
如果CRS症状持续存在或加重超过24h,应立即启动更高级别的CRS管理策略。发生sCRS时建议将患者转至ICU。一般而言,CRS患者除接受支持治疗外,还应接受托珠单抗和糖皮质激素联合治疗。对于S-CRS延长或实质性症状或合并症,建议以4-8 mg/kg(不超过800mg)托珠单抗治疗,并可根据需要在6h后重复给药。此外如果存在L-CRS或持续和难治性发热,可考虑使用抗TNF-α药物。对于接受抗IL-6和/或抗TNF-α治疗仍发生4级或持续性CRS的患者,可考虑使用糖皮质激素。对于sCRS高危患者,应从CAR-T细胞输注当天开始给予β受体阻滞剂。可进行血浆置换治疗CRS。其他支持性治疗包括针对低血压患者的退热措施、静脉液体推注和/或升压药,和/或针对缺氧患者的辅助供氧。
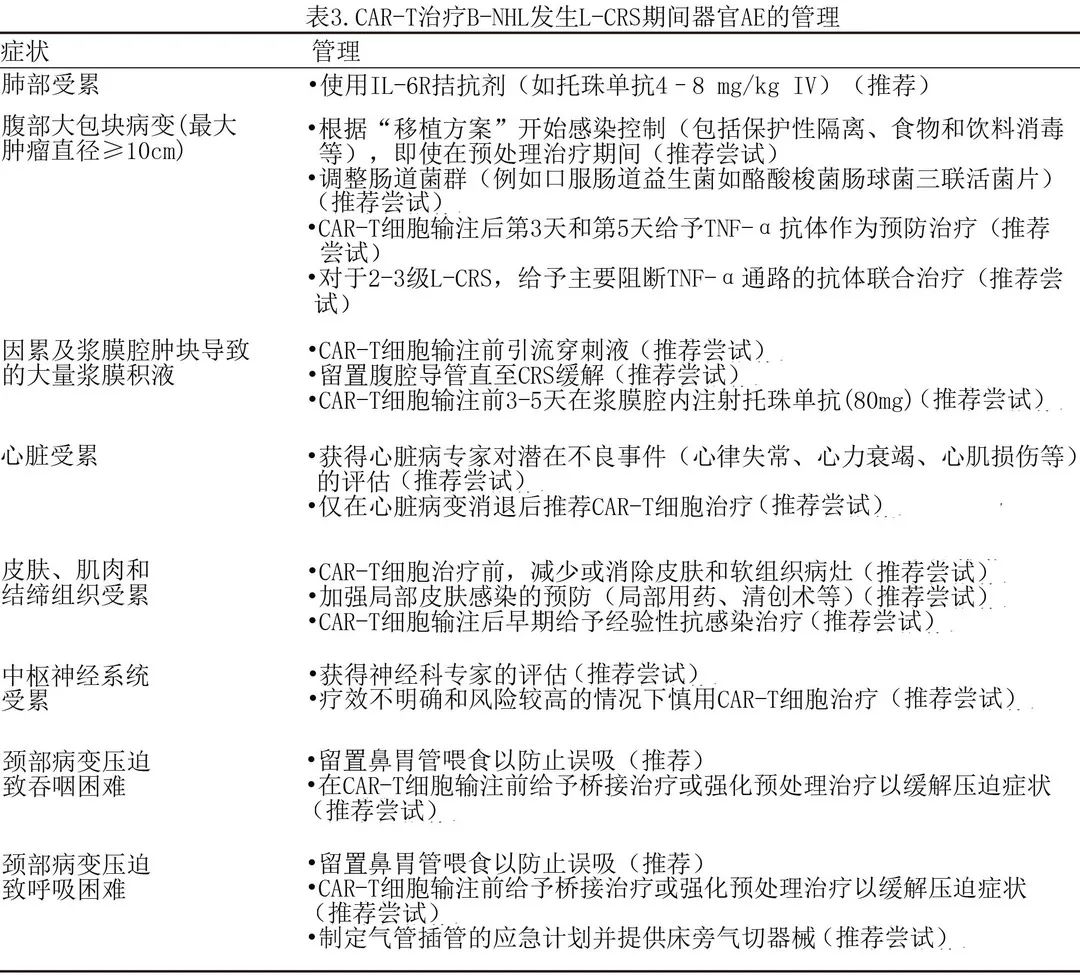
重度CRS通常与多个重要器官(如心脏、肝脏和肾脏)的功能障碍相关,可能具有致死性,应进行全面评估和适当管理。L-CRS还可能引起特定器官损伤,这取决于病变的位置。例如发生L-CRS时GI受累或GI道周围病变的患者可能会出现粘膜损伤,甚至血管破裂和病变部位出血。因此组织损伤可能通过肠道菌群促发S-CRS,建议在CAR-T细胞治疗前进行肠道清除和口服抗生素抑制肠道菌群。气管周围肿块或浆膜受累者出现压迫症状时也可考虑预防性使用抗TNF-α制剂,应行抗TNF-α治疗及局部干预,如气管切开、浆膜腔积液引流等。心脏是另一个需要特别注意的器官,肿瘤病灶位于心脏周围时应密切监测心功能。对于具有该潜在风险的患者,在CAR-T细胞治疗前进行桥接治疗是必要的。L-CRS期间器官AE的详细临床管理程序见表3。
晚期CRS
晚期CRS通常被认为是迟发型急性CRS,多发生于CAR-T细胞输注后3-6周内。与S-CRS相似,晚期CRS的临床表现为发热、血细胞减少、转氨酶水平升高、凝血障碍、CAR拷贝数增加和肿瘤残留。应注意区分晚期CRS与预处理治疗相关血液学毒性、GI毒性和感染。此外急性CRS的监测和管理策略与晚期CRS相似。
慢性CRS
慢性CRS定义为CAR-T细胞输注6周后发生的炎症或CAR-T细胞相关AE。慢性CRS的临床表现包括:(1) 间歇性低热(<38℃);(2) 疲乏和食欲不振;(3) 血细胞减少,特别是血小板减少;(4) 外周血中CAR-T细胞再扩增;(5) 残留肿瘤;(6) 部分患者出现间质性肺炎或支气管扩张样表现。应注意区分慢性CRS与感染和血液学毒性。慢性CRS的管理包括用于治疗肺部症状的抗TNF-α药物和支持治疗;此外应密切监测CBC,可对特定患者进行成分血输注支持治疗。

CAR-T细胞相关脑病综合征(CRES)是CAR-T细胞治疗时发生的另一种常见AE,其特征为治疗后出现病理性CNS进程。尽管CRES的病理生理机制尚不清楚,但其严重程度与高水平的血清细胞因子、高肿瘤负荷、血脑屏障破坏、CAR结构和表达CD19的脑壁细胞相关。
CRES的发生率为20%-64%,接受CAR-T细胞治疗的B-NHL患者中5%-28%为≥3级。CRES通常发生于CAR-T细胞输注后8周内,中位持续时间为4-6天。CRES的神经系统症状包括头痛、谵妄、认知障碍、肌震颤、共济失调、语言障碍、嗜睡、视神经乳头水肿和癫痫发作等,继发脑水肿是主要死因。
区分CRES与脑血管事件(如脑出血和梗死)至关重要,因为CAR-T细胞治疗后常发生血小板减少和凝血障碍。病史询问和脑部MRI检查可能有用。CAR-T细胞治疗后部分患者常出现单次癫痫发作。临床医生在诊断CRES时应谨慎,尤其是有脑血管意外和癫痫发作史的患者。
根据CAR-T细胞治疗相关毒性(CARTOX) CRES分级量表,通过CARTOX-10评分、颅内压升高和癫痫发作/运动无力定义进行分级。CRES分级检查包括通过眼底镜检查和脑电图(EEG)进行的全面神经学评估、通过MRI或CT扫描进行的神经影像学评估以及CSF压力测量。与CRS相似,CRES管理应基于适当的毒性级别,如表4所示。除支持性治疗外,糖皮质激素是CRES管理策略的基石;但不建议使用托珠单抗治疗CRES,除非同时发生CRS。建议对3级或4级CRES患者进行ICU监测。对于有惊厥发作史或CRES高危的患者,可在CAR-T细胞治疗前预防性使用左乙拉西坦。


噬血细胞性淋巴组织细胞增生症/巨噬细胞活化综合征(HLH/MAS)是一组严重的免疫性疾病,以T细胞和巨噬细胞过度活化、淋巴组织细胞组织浸润和免疫介导的多器官功能障碍为特征。CAR-T细胞相关性HLH/MAS通常发生在CRS恢复期或伴随CRS。与S-CRS相比,HLH/MAS特征性的临床表现包括:肝脾肿大;骨髓噬血细胞和噬血现象;至少2种造血细胞谱系的血细胞减少;高甘油三酯血症;血清铁蛋白、细胞因子和可溶性CD25水平升高。HLH/MAS可导致长期白细胞减少或中性粒细胞减少,从而增加严重感染的风险。
HLH/MAS的早期阶段容易被忽视,因为其特征也常发生在CAR-T细胞治疗后的CRS、感染和骨髓抑制中。如果存在以下情况应高度怀疑HLH/MAS:血液CAR-T细胞水平升高超过2周,并在2周后再次升高;复发性发热伴血细胞减少或肝脾肿大;血清铁蛋白持续升高。
目前CAR-T细胞治疗的患者中尚无HLH/MAS的标准临床管理,根据国内多个中心的累积经验,并咨询在治疗该毒性方面有经验的专家,作者为HLH/MAS的临床管理提供以下建议:(1) 密切监测CAR-T细胞治疗后患者的生命体征和CBC;(2) 密切监测血清铁蛋白和甘油三酯浓度;(3) 如果患者在CAR-T细胞输注后出现不明原因的发热和血细胞减少,须鉴别HLH/MAS;(4) 如果诊断为HLH/MAS,建议加入低剂量依托泊苷(每周50-100 mg/m2)进行治疗;(5)JAK-2抑制剂(芦可替尼)、CTLA-4激动剂(abatacept)和抗CD52抗体(alemtuzumab)可用于特定患者;(6) 紧急情况下可考虑血浆置换;(7) 在某些情况下可考虑使用新药如γ干扰素抗体。

骨髓抑制引起的血细胞减少是CAR-T细胞治疗后患者最常见的AE之一;3-4级中性粒细胞减少、贫血和血小板减少的发生率分别为45%-69%、30%-37%和15%-30%。至少15%的患者在3个月后发生长期重度血细胞减少。
鉴于血细胞减少会增加感染和相关并发症(如脑出血)的风险,应根据其分级进行以下管理措施:(1) 预防细菌和真菌感染,直至严重白细胞减少或中性粒细胞减少纠正;(2) 严重贫血患者补充低流量氧和浓缩红细胞输注;(3) 严重血小板减少患者预防性使用止血剂和输注血小板;(4) 额外的预防措施(如紫外线室内消毒或使用软牙刷)可用于任何级别的白细胞减少或血小板减少患者。

CAR-T细胞治疗后常见感染,发生率高达70%,其中高达40%的感染发生在第一个月内。最常见的感染是细菌(16%-30%),多发生于前2周内。可能导致感染的因素包括预处理或既往化疗、CAR-T细胞介导的B细胞缺乏症/低丙球蛋白血症和长期血细胞减少。
感染的表现在发热、低血压和缺氧方面可酷似CRS,是诊断的主要难点,也没有生物标志物可用于区分2种疾病。此外由于感染通常发生在CRS背景下,并可能加重CRS,因此早期识别和及时干预至关重要。有研究表明,严重感染的独特特征包括血清IL-6二次升高以及血清IL-8和IL-1β的高水平,可能有助于严重感染和CRS之间的鉴别诊断。如果CRS和感染无法区分,建议考虑CRS治疗联合抗菌预防。
CAR-T细胞治疗期间并发感染可导致CAR-T细胞相关毒性复杂化,包括CRS和神经毒性。此外约10%的重度或危及生命的感染可能发生在预处理期间和之后。对于基线时存在活动性或不受控制的感染的患者,在感染恢复前不得开始CAR-T细胞治疗。
通常需在预处理治疗前和治疗后3个月内预防耶氏肺孢子菌肺炎和带状疱疹再激活。需注意CAR-T治疗可能会给携带者带来HBV再激活的风险,因此对于HBV携带者,应在预处理治疗前开始预防性使用恩替卡韦,并持续至少6个月;此外每月随访监测HBV DNA水平对早期发现HBV再激活也有必要。
应根据患者特征(如既往造血干细胞移植和感染史),对预防细菌或真菌感染的决策进行风险调整。预处理化疗后中性粒细胞计数降至<0.5× 109/L时可考虑使用粒细胞集落刺激因子。如果怀疑感染,应立即开始经验性广谱抗菌治疗。预期有持续性中性粒细胞减少的患者,通常在4-7天后加用经验性抗真菌治疗。
与其他抗肿瘤治疗相比,CAR-T细胞介导的全身性免疫抑制更常见发生于特定部位的感染(皮肤和软组织、泌尿系统和导管相关感染)。值得注意的是,肿瘤累及皮肤和软组织或浆膜的感染可能为重度,并因并发L-CR而加重。特殊部位感染的管理原则见表5。


B细胞缺乏症/低丙球蛋白血症
持续性B细胞缺乏症/低丙球蛋白血症是一种可预期的靶向、脱靶毒性,是CAR-T细胞治疗后的特征性不良反应,可根据B细胞绝对计数<61个细胞/μL和血清免疫球蛋白G(IgG) ≤400 mg/dL进行诊断。几乎所有接受CAR-T细胞治疗的患者都会出现不同程度的B细胞缺陷,从而增加体液免疫功能障碍相关的感染风险。预防性静脉注射人免疫球蛋白(IVIG)是接受CAR-T细胞治疗患者的常规辅助治疗。低丙球蛋白血症管理的实用策略如下。
i.每月IVIG替代治疗,直至B细胞恢复至正常范围或CAR-T细胞输注后6个月。
ii.对于血清IgG≤ 400mg/dL且感染严重或复发的患者,应继续每月IVIG替代治疗,直至风险因素消除。
iii.建议对感染高危患者定期监测血清IgG、IgM和IgA水平及血CD19+或CD20+ B细胞计数。
肿瘤溶解综合征
肿瘤溶解综合征(TLS)是由于细胞内大量内容物和代谢产物快速释放到体循环中引起的一组疾病,其临床表现包括高尿酸血症、高磷血症、低钙血症、高钾血症和急性肾功能不全。TLS的诊断标准包括(1) 血清钾水平升高25%;(2) 钙水平降低25%;(3) 血清肌酐>221 μmol/L;(4) 血清尿酸或尿素氮水平升高25%;(5) 部分患者出现心律失常和肾衰竭。
对于高肿瘤负荷(SPD≥100 cm2或直径≥10 cm的巨块型病灶)或高肿瘤增殖活性(Ki67 ≥85%) 的患者,应考虑TLS预防。建议在预处理治疗前24h开始水化和碱化,必要时使用利尿剂以确保尿量>3000 mL/天。可给予碳酸氢钠以维持尿液pH值在7.0-7.5。
TLS的治疗包括(1) 频繁监测心电图、血压和血氧饱和度;(2) 充分静脉补液(≥3000 mL/天)以维持尿量(≥3000 mL/天),必要时使用利尿剂;(3) 给予碳酸氢钠以确保尿液pH值在7.0-7.5之间;(4) 纠正液体和电解质紊乱;(5) 别嘌呤醇或非布司他治疗高尿酸血症;(6) 对发生肾衰竭伴未纠正的电解质紊乱的患者进行血液透析。
过敏反应
输注相关过敏反应的发生率相对较低(3%以内),过敏性休克罕见。一般过敏反应很容易被误认为其他AE的继发症状。例如皮疹通常发生在CAR-T细胞输注后的前2周内,并在3-5天内自行消退。除过敏外,皮疹也可能归因于CRS诱导的毛细血管内皮脆性增加。过敏反应高危人群包括可能对以下药物过敏的人群:(1)CAR-T生产过程中的体外培养试剂;(2)病毒载体杂质;(3)CAR-T前未恢复的炎性背景导致的T细胞活化。
其管理原则包括以下内容:(1) 排除入组时有超敏反应的患者;(2) 在CAR-T细胞制造过程中严格控制程序和试剂;(3) 输注前进行抗菌治疗,以消除体内炎性背景;(4) 预防性使用抗过敏药物(如苯海拉明或异丙嗪)。
CAR-T细胞过度增殖
应在CAR-T细胞输注后的第一个月内监测CAR-T细胞水平,前2周内每2-3天采集一次血样,此后每周采集一次。下列情况下应高度怀疑CAR-T细胞过度增殖:(1) 外周血白细胞计数≥10 × 109/L;(2) 白细胞中淋巴细胞百分比≥70%;(3)CAR+ T细胞绝对计数> 600个/μL。应考虑识别这一情况的指征包括:
1)CAR-T细胞的扩增是否与肿瘤大小的变化一致?
2)CAR-T细胞是否位于外周血以外的其他部位或在其他部位扩增?
3)活化的T细胞增殖失控是否由病毒感染引起?
控制CAR-T细胞过度增殖的管理实践包括糖皮质激素和其他免疫抑制剂(例如抗胸腺细胞球蛋白或抗CD52抗体)。严重患者可联合使用2种或2种以上免疫抑制剂。
二次肿瘤
CAR-T细胞治疗后二次肿瘤的发生率约为15%,与接受其他抗肿瘤治疗相似,其中急性髓系白血病和骨髓增生异常综合征是最常见的二次血液系统恶性肿瘤。二次肿瘤通常发生在CAR-T细胞治疗的第一年后,定期随访对于CAR-T细胞治疗后早期识别二次肿瘤非常重要。有研究认为与表观遗传学药物(如地西他滨)联合治疗可改善患者预后

CAR-T细胞疗法是R/R B-NHL患者的潜在治愈性治疗,而CAR-T细胞相关毒性可能会降低生存获益。目前管理B-NHL中CAR-T相关毒性的全面建议较少,因此在目前国内多家机构的认识和临床经验基础上,作者编撰了这一共识。该共识完善了CRS分级系统和分类,并为B-NHL的CAR-T细胞治疗中观察到的毒性分级、监测和管理提供了全面和详细的实践建议。总而言之,该共识有助于临床医生有效管理CAR-T细胞治疗B-NHL中的相关毒性。
参考文献
Ping Li, Yang Liu , Yun Liang,et al .2022 Chinese expert consensus and guidelines on clinical management of toxicity in anti-CD19 chimeric antigen receptor T-cell therapy for B-cell non-Hodgkin lymphoma. Cancer Biol Med . 2023 Mar 2;20(2):j.issn.2095-3941.2022.0585. doi: 10.20892/j.issn.2095-3941.2022.0585.


