阿得贝利单抗获批广泛期小细胞肺癌一线治疗适应症,为中国小细胞肺癌患者带来新选择
时间:2023-08-21 17:40:12 热度:37.1℃ 作者:网络
2023年3月3日,中国国家药品监督管理局(NMPA)发布的最新批件显示,江苏恒瑞医药自主研发的PD-L1抑制剂阿得贝利单抗(艾瑞利®)已于2月28日获批上市,用于联合卡铂和依托泊苷一线治疗广泛期小细胞肺癌(ES-SCLC)。阿得贝利单抗成为我国首个获批小细胞肺癌适应症的自主研发PD-L1抑制剂,打破了进口PD-L1抑制剂在这一领域的垄断地位,为广大患者带来全新治疗选择的同时再次力证了我国自主研发创新药物的雄厚实力。
此次阿得贝利单抗一线治疗适应症的获批是基于吉林省肿瘤医院程颖教授和中国医学科学院肿瘤医院王洁教授共同牵头开展的一项多中心、随机、安慰剂对照的III期研究——CAPSTONE-1的成功。该研究提示,阿得贝利单抗联合化疗显著改善患者的总生存期(mOS: 15.3个月vs 12.8个月),降低死亡风险达28%,2年生存率达31.3%(vs 化疗17.2%),且具有良好的安全性,≥3级的irAE发生率均不超过1.8%。这一突破性成果也于2022年5月发表在《柳叶刀·肿瘤学》杂志,获得国内外学界的广泛认可。
现特别邀请Leading PI程颖教授接受专访,分享研究成果,畅谈阿得贝利单抗获批ES-SCLC一线治疗适应证的意义,指导临床实践。

Q1:近日,小细胞肺癌领域又传来重磅喜讯,基于您和王洁教授共同牵头开展的CAPSTONE-1研究,阿得贝利单抗获批ES-SCLC的一线治疗适应症。请您结合近年来ES-SCLC的治疗进展,谈谈该适应证获批对中国ES-SCLC的临床实践有何意义。
程颖教授:免疫治疗的飞速发展,推动了小细胞肺癌治疗的进步,国际上IMpower133和CASPIAN研究证实了两款PD-L1联合化疗能够显著改善广泛期小细胞肺癌的生存。虽然这两款PD-L1抑制剂在我国也陆续获批,但价格昂贵,而且没能够进入医保,小细胞肺癌免疫治疗面临落地的困境。我国自主研发的PD-1/PD-L1抑制剂具有更好的可及性,而且在非小细胞肺癌的研究中获得了与国际原研药物一致的结果,我们开展了 CAPSTONE-1研究,我国自主研发的PD-L1抑制剂阿得贝利单抗联合化疗一线治疗广泛期小细胞肺癌的3期随机对照研究,这项研究是首个针对中国广泛期小细胞肺癌免疫一线治疗的III期研究,研究纳入了中国47家医院462例中国广泛期小细胞肺癌患者,是目前已公布结果的、样本量最大的中国小细胞肺癌免疫治疗的研究。
研究证实阿得贝利单抗联合化疗可使广泛期小细胞肺癌患者有显著的OS获益,其中位OS更是达到了15.3个月,与安慰剂联合化疗相比延长2.5个月,可以降低28%的死亡风险,2年OS率达31.3%(化疗组17.2%)。同时,联合治疗组中位PFS为5.8个月,显著降低33%的疾病进展或死亡风险,1年的PFS率为19.7%,是对照组5.9%的3倍多,更加展现了阿得贝利单抗稳健持久的肿瘤控制作用,也是提示我们提升患者一线治疗的PFS对于延缓疾病进展意义重大。客观缓解率(ORR)作为肿瘤评价的重要指标,联合治疗组也取得了令人欣慰的数据,ORR达70.4%,较化疗组相比具有明显优势。
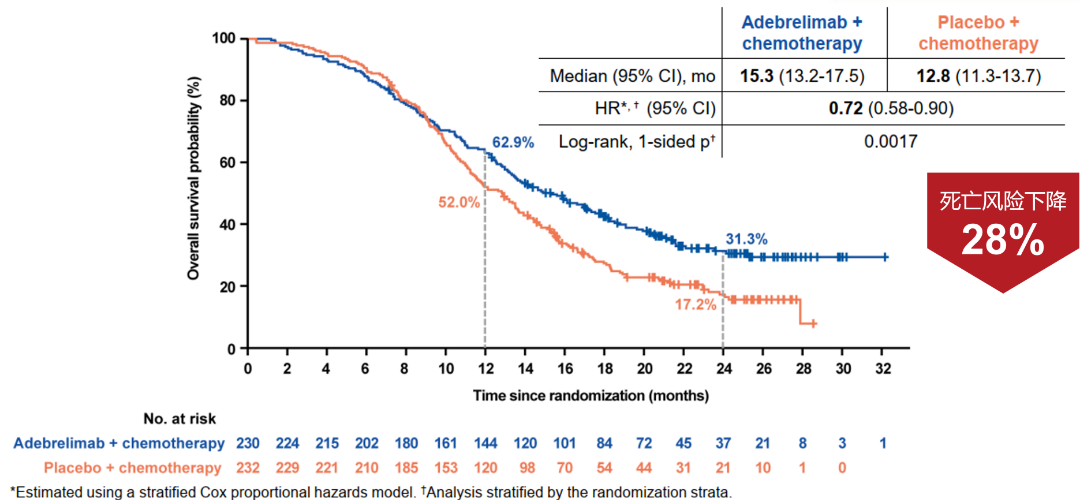
图1 OS生存曲线
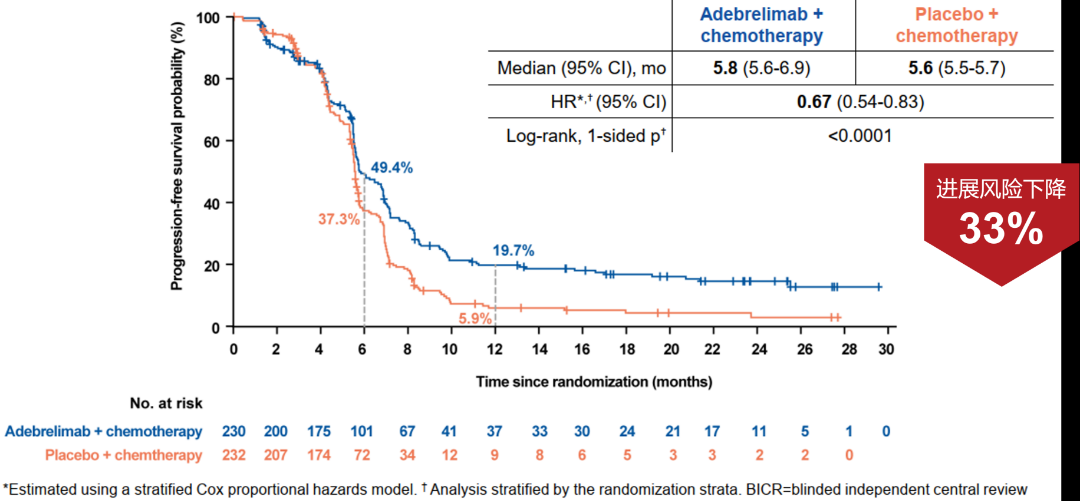
图2 PFS生存曲线
安全性方面,CAPSTONE-1研究更为出众,阿得贝利单抗联合化疗组免疫相关不良反应(irAEs)发生率为27.8%,相比对照组仅提升10.6%,3级以上irAE,联合治疗组发生率均不超过1.8%,且联合治疗组中因不良反应(AE)导致停药和死亡的发生率仅为5.2%和0.9%。CAPSTONE-1研究达到了主要终点,而且所有疗效的指标都获得一致结果,进一步证实了国际研究的结果。阿得贝利单抗的获批上市,为中国广泛期小细胞肺癌的临床实践提供了一个疗效卓,安全性优异的一线标准治疗方案。阿得贝利单抗作为民族制药企业自主研发的PD-L1抑制剂,获批上市后,有望打破进口PD-L1抑制剂药物的垄断,惠及更多中国小细胞肺癌患者。
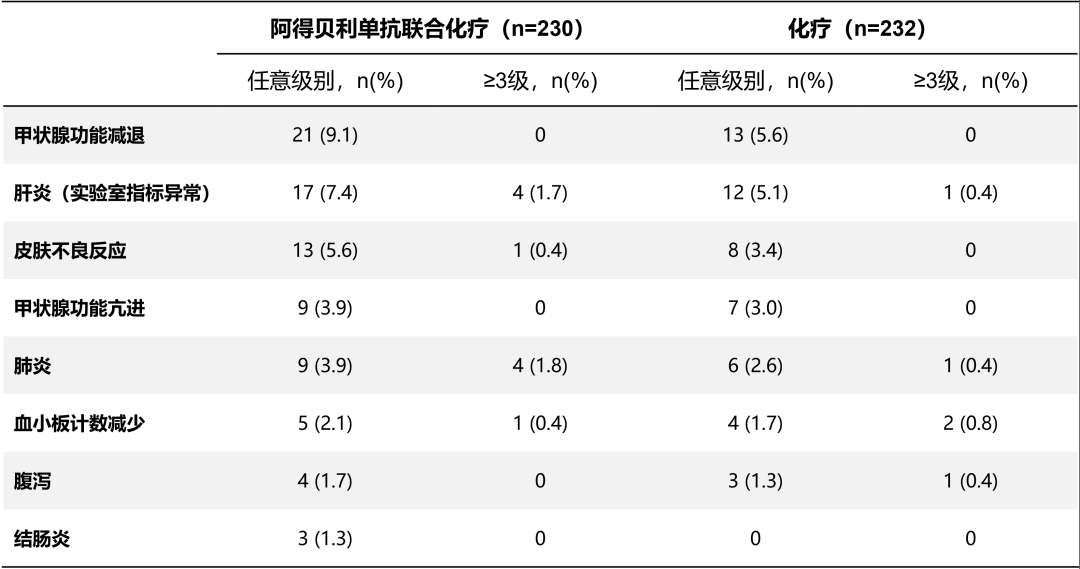
图3 阿得贝利单抗联合化疗不良反应表格
CAPSTONE-1研究是PD-L1抑制剂联合化疗在中国广泛期小细胞肺癌人群中疗效的有力印证,该研究得到了国内外同行的广泛关注和认可,2022年4月13日在AACR会议上进行了口头报告,仅相隔1个月时间即全文在线发表于国际肿瘤领域顶级杂志THE Lancet Oncology,不仅进一步彰显了中国研究者、民族药企的研究实力,也侧面反映出国外同行专家对中国原创研究科学性和在小细胞肺癌治疗领域所做出贡献的认可。
Q2:请您谈谈阿得贝利单抗作为我国自主研发的全新PD-L1抑制剂,有什么样特点可以使其在取得卓越疗效的同时也展现了出色的安全性。
程颖教授:阿得贝利单抗不同于已经上市的2个进口PD-L1抑制剂,其选择了与FcγR结合能力较弱的IgG4抗体类型。IgG4型抗体本身无补体依赖的细胞毒性作用(CDC),同时阿得贝利单抗进一步通过Fc段234A/235A定点突变改造,进一步降低了其和免疫效应细胞表面FcγR结合的能力,从而消除了抗体依赖的细胞介导的细胞毒性作用(ADCC)、抗体依赖的细胞介导的吞噬作用(ADCP),同时也降低了抗体依赖性细胞因子释放(ADCR)效应。随着对免疫检查点抑制剂研究的深入,发现PD-L1不仅仅表达在肿瘤细胞上,在巨噬细胞、树突细胞、T细胞等免疫细胞上皆有表达,抑制PD-L1/PD-1通路的单克隆抗体,应该更加专注于阻断这一信号通路,通过抗体Fc段的改造就很好的避免了由FcγR受体介导的效应功能对非靶细胞的杀伤,抗体功能更加纯净。此外,其Fab段采用S228P突变改造,避免lgG4抗体的Fab段置换,抗体更加稳定。
从分子结构角度看,相比于既往上市的PD-L1抗体,阿得贝利单抗具有独特的与PD-L1的结合表位,其结合的角度更加居中,结合区域与结合面积更接近天然配体PD-1。同时阿得贝利单抗与PD-L1结合的解离常数Kd值仅为0.27*10-10nmol/L,亲和力相较于已上市的PD-L1抗体更强。
临床前研究提示阿得贝利单抗刺激T细胞释放IFN-γ的EC50值更低,激活DC细胞和T细胞能力更强,具有良好的抗瘤活性。
因此,全新的结构修饰与优化让阿得贝利单抗成为免疫治疗时代中,治疗ES-SCLC的一个疗效卓越、安全性优异的新一代选择。
Q3:阿得贝利单抗在ES-SCLC中已经取得了巨大的成功,请您谈谈该药物在SCLC领域的应用前景和未来的探索方向?
程颖教授:阿得贝利单抗联合化疗一线治疗ES-SCLC的疗效卓越,安全性优异,作为民族自主研发的全新PD-L1抑制剂,获批上市后将为患者带来更加可及的药物选择,成为中国广泛期小细胞肺癌一线治疗新的选择。随着阿得贝利单抗在小细胞肺癌一线治疗的获批,可以在真实世界中更加广泛的人群中评价阿得贝利单抗治疗的疗效和安全性, 让更多的让中国患者有应用阿得贝利单抗的机会,真正推动我国小细胞肺癌患者整体生存期的提升。
基于CAPSTONE-1研究卓越的疗效和安全性数据,我们也开展了阿得贝利单抗联合同步放化疗治疗局限期小细胞肺癌的III期研究。我们采用了更加大胆的设计,在局限期小细胞肺癌诱导治疗开始就引入免疫治疗。为了避免胸部放疗与免疫治疗联合增加肺炎的发生,我们设计上采用了两阶段设计,分别为安全性导入期和III期随机对照试验。第一阶段导入期,由安全监测委员会(SMC)对第一阶段受试者的安全性数据进行分析与讨论决定第二阶段研究的开展。经过SMC的评估,确认免疫治疗从诱导治疗开始就介入的模式是安全可行的,免疫治疗联合同步放化疗并没有增加额外的毒性。目前第一阶段导入期已经完成。第二阶段为III期随机对照研究部分,为了保证不同研究胸部放疗同质化,我们制定了放疗手册与放疗质控手册,确保胸部放疗的每个环节标准化、精细化,目前第二阶段正在如火如荼进行中。此外,阿得贝利单抗联合其他药物包括PARP抑制剂,抗血管药物或者化疗在复发小细胞肺癌的疗效和安全性也是值得探索的方向。
感谢全国的同道们对研究的支持,我们一起共同努力,希望能够在中国的患者中探索出更加适合中国患者的治疗模式,共同为中国肿瘤患者的治疗做更多努力。


