Neuron | 阿尔茨海默病新进展!中国科学院陈椰林/耿泱发现全新机制,微小差异带来巨大致病风险
时间:2023-04-14 19:12:37 热度:37.1℃ 作者:网络
异常低γ-分泌酶活性与家族性阿尔茨海默病(fAD)基础上的大多数早老素突变有关。然而,γ-分泌酶在更普遍的散发性AD (sAD)中的作用仍未得到解决。
2023年4月10日,中国科学院上海有机化学研究所陈椰林及耿泱共同通讯在Neuron在线发表题为“Differential and substrate-specific inhibition of γ-secretase by the C-terminal region of ApoE2, ApoE3, and ApoE4”的研究论文,该研究揭示了ApoE2、ApoE3 和 ApoE4 C末端区域对γ分泌酶的差异和底物特异性抑制。
该研究报道了人类载脂蛋白E (ApoE), sAD最重要的遗传危险因素,与γ-分泌酶相互作用,并通过其保守的C端区域(CT)以细胞自主方式以底物特异性抑制γ-分泌酶。这种ApoE CT介导的抑制活性在不同的ApoE亚型中受到不同程度的损害,导致ApoE2 > ApoE3 > ApoE4效力等级顺序与其相关的AD风险呈负相关。有趣的是,在AD小鼠模型中,神经元ApoE CT从其他区域迁移到基底骨下的淀粉样斑块,减轻了斑块负担。总之,该研究数据揭示了ApoE作为一种具有底物特异性的γ-分泌酶抑制剂的隐藏作用,并表明ApoE的这种精确的γ-抑制可能可以预防sAD的风险。

阿尔茨海默病(AD)是最常见的神经退行性疾病,影响着全球近5000万人。β-淀粉样蛋白(Aβ)假说将AD归因于β-分泌酶和γ-分泌酶连续裂解淀粉样前体蛋白(APP)产生的肽Aβ的过度聚集和γ-分泌酶的催化亚基早老素1 (PS1)和早老素2 (PS2)的突变,导致罕见的家族性AD (fAD)。基于这些证据,γ-分泌酶被认为是AD的药物靶点。
遗憾的是,使用传统的γ-分泌酶抑制剂治疗会引起严重的副作用,最近的研究发现,fAD相关的早老蛋白突变通常与γ-分泌酶的整体活性降低有关,这与基于Aβ假设的γ-分泌酶的预测作用相反。鉴于Aβ药物发现工作的结果不令人满意,迫切需要揭示γ-分泌酶在更普遍的散发性AD (sAD)中尚未解决的作用。
sAD没有致病基因,但其发病风险受多种遗传因素影响。其中,载脂蛋白E4 (ApoE4)影响最大。ApoE基因编码的三种亚型仅在N端区(NT)存在单氨基酸差异:ApoE2、-3和-4。ApoE4不仅增加了AD的发病风险,而且还会提前发病年龄,加重AD的严重程度。在啮齿类动物的大脑中,ApoE通常只在神经胶质中检测到,而Aβ则由神经元产生。然而,ApoE也在人类神经元和受伤的啮齿动物神经元中表达。
人脑中ApoE的代谢与神经元中的ApoE更相似,而与神经胶质中的ApoE更相似。最近的一项研究使用携带不同ApoE亚型的人诱导多能干细胞(hiPSC)来源的神经元显示,ApoE4阳性神经元中Aβ的产生增加,这表明ApoE在调节神经元中APP切割方面具有细胞自主功能。这一证据支持了神经元载脂蛋白E的关键作用,这在很大程度上仍未得到研究。
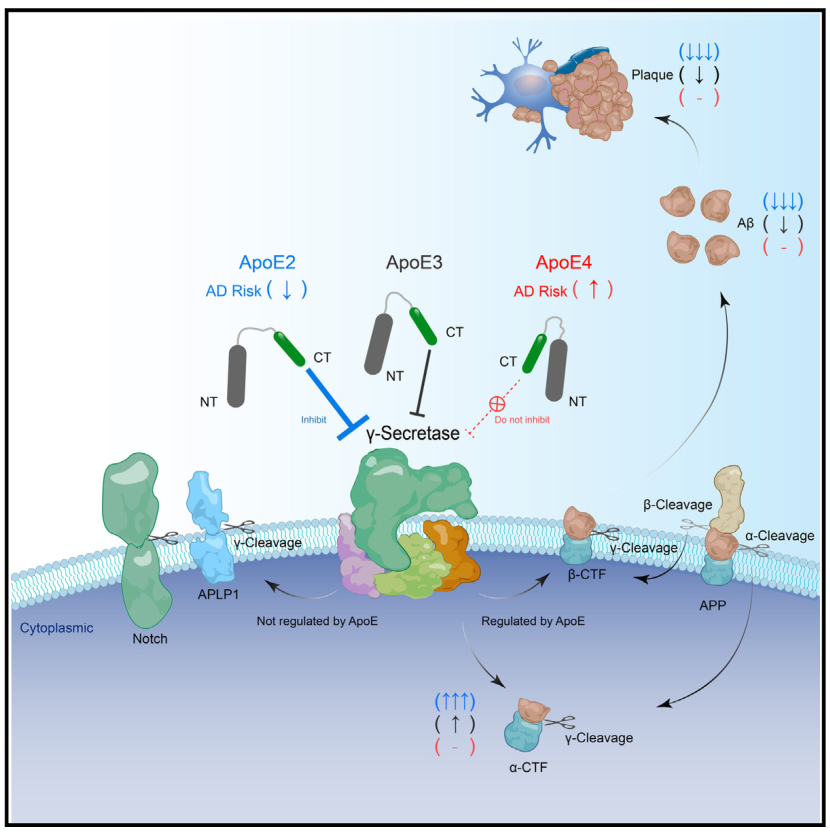
机理模式图(图源自Neuron )
总之,该研究结果支持精确抑制γ-分泌酶可以预防sAD的风险,这与fAD通常与γ-分泌酶活性降低相关。该研究还发现ApoE CT是一种有效的γ-分泌酶抑制剂,具有罕见的底物特异性,可以从远处迁移到斑块周围的淀粉样蛋白热点区域发挥局部作用。
原文链接:
https://www.cell.com/neuron/fulltext/S0896-6273(23)00220-9


