【论著】| m6Am修饰酶PCIF1调控靶基因ACOT8参与胃癌进展的机制研究
时间:2023-09-06 20:56:35 热度:37.1℃ 作者:网络
[摘要]
背景与目的:最新证据显示N6, 2'-O- 二甲基腺苷(N6, 2'-O-dimethyladenosine,m6Am)修饰酶磷酸化C末端结构域相互作用因子1(phosphorylated c-terminal domain-interacting factor 1,PCIF1)可能是胃癌的重要生物标志物及治疗靶点。然而,这种新的PCIF1分子机制与胃癌进展的关系仍有待进一步探索。本研究分析PCIF1对胃癌细胞增殖、迁移和侵袭的调控作用及其调控靶基因酰基辅酶A硫代酯酶8(acyl-CoA thioesterase 8,ACOT8)在胃癌进展中的机制。
方法:使用基因表达谱交互分析(gene expression profiling interactive analysis,GEPIA)分析胃癌患者的胃癌组织和非胃癌组织中的PCIF1表达,并分析了PCIF1表达与胃癌患者总生存率的相关性。收集2019年——2021年长沙市第一医院消化内科就诊患者的89对胃癌组织和匹配的癌旁组织。通过实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)和蛋白质印迹法(Western blot)分析PCIF1表达。在体外实验中,将SNU5细胞分为PCIF1敲低(sh-PCIF1)组和相应对照(sh-NC)组,将AGS细胞分为载体对照组(normal control,NC)组和PCIF1过表达(PCIF1)组。使用细胞计数试剂盒-8(cell counting kit-8,CCK-8)、5-乙炔基-2'-脱氧尿苷(5-ethynyl-2'-deoxyuridine,EdU)和transwell法分析了PCIF1对胃癌细胞增殖、侵袭和迁移的影响。此外,在PCIF1过表达的AGS细胞中敲低ACOT8并进行了拯救实验。采用皮下异种移植瘤模型来测定PCIF1在胃癌中的生物学效应。
结果:PCIF1在胃癌组织和细胞系中呈高表达,并且PCIF1高表达胃癌患者的预后较差。与sh-NC组相比,sh-PCIF1组的细胞活力、EdU阳性细胞、迁移和侵袭细胞数均显著降低(P<0.05)。与NC组相比,PCIF1组的细胞活力、EdU阳性细胞、迁移和侵袭细胞数均显著增加(P<0.05)。在PCIF1过表达的AGS细胞中,敲低ACOT8的表达可降低细胞活力、EdU阳性细胞、迁移和侵袭细胞数。在体内实验中,与NC组相比, PCIF1过表达组裸鼠的移植瘤体积和重量均显著增加(P<0.05)。
结论:PCIF1在胃癌细胞系和组织中上调。此外,PCIF1/ACOT8轴参与介导胃癌细胞的恶性行为产生。
[关键词] N6, 2'-O-二甲基腺苷;磷酸化C末端结构域相互作用因子1;酰基辅酶A硫代酯酶8;胃癌;增殖;转移
胃癌在世界范围内普遍存在,其特点是早期诊断存在困难;大多数患者在确诊后往往错过最佳治疗时机,即使治疗后5年生存率也不足20%,严重威胁人类健康[1]。胃癌发病机制涉及多种因素、发育过程中的多个步骤以及多重基因突变和异常[2]。因此,迫切需要确定胃癌早期的诊断标志物和治疗靶点。最近,表观转录组学已成为癌症研究的一个有吸引力的领域[3]。在RNA中发现了100多种转录后修饰方式,其中N6, 2'-O-二甲基腺苷(N6, 2'-O-dimethyladenosine,m6Am)是一种可逆的RNA修饰,有利于mRNA的翻译、表达和稳定性[4]。先前的研究[5]已将磷酸化C末端结构域相互作用因子1(phosphorylated C-terminal domain-interacting factor 1,PCIF1)确定为m6Am写入蛋白,其通过调节胰岛β细胞的功能或存活参与葡萄糖稳态。抑制PCIF1介导的mRNA中m6Am修饰会导致结直肠癌干细胞能力降低[6]。值得注意的是,还有学者发现PCIF1激活在胃癌的发生和发展中起着重要作用,并且可能是胃癌的重要生物标志物及治疗靶点[7]。然而,PCIF1作用的分子机制及其与胃癌进展的关系仍有待进一步探索。在本研究中,我们分析了PCIF1对胃癌细胞增殖、迁移和侵袭的调控作用及分子机制。
1 材料和方法
1.1 GEPIA数据库分析
从癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库中获得408个胃癌组织和211个非胃癌组织的mRNA表达谱并进行分析。利用基因表达谱交互分析(Gene Expression Profiling Interactive Analysis,GEPIA)计算胃癌患者的10年总生存(overall survival,OS)率,并分析其与PCIF1的相关性。
1.2 临床标本
收集2019年—2021年从长沙市第一医院获得89对胃癌组织和非胃癌组织(距胃癌边缘超过5 cm)。没有患者术前接受局部或全身化疗、放疗或靶向治疗,所有组织均由两名病理学家进行组织学鉴定。切除的标本立即处理并储存在-80℃。所有患者都签署了知情同意书。
1.3 细胞培养
正常人胃黏膜细胞系(GES-1)和胃腺癌细胞系(AGS、MKN45、SNU-5和NCI-N87;美国ATCC)接种在含有10%胎牛血清(美国Gibco公司)和1%双抗生素(青霉素/链霉素,美国Thermo Fisher Scientific公司)的Dulbecco改良Eagle培养基(DMEM)中培养。
实验1考察PCIF1对胃癌细胞增殖、迁移和侵袭的影响。将SNU5细胞分为PCIF1敲低(sh-PCIF1)组和相应对照(sh-NC)组;其中sh-NC组和sh-PCIF1组分别使用LipofectamineTM3000将sh-NC或sh-PCIF1转染细胞24 h。将AGS细胞分为载体(NC)组和PCIF1过表达(PCIF1)组;其中NC组和PCIF1组AGS细胞分别使用LipofectamineTM3000将NC或PCIF1质粒转染细胞24 h。实验2考察PCIF1和酰基辅酶A硫代酯酶8(Acyl-CoA thioesterase 8,ACOT8)在胃癌细胞中的作用相互关系。将AGS细胞分为NC组、PCIF1组、PCIF1 + sh-NC组和PCIF1 + sh-ACOT8 组。
1.4 细胞转染
将AGS细胞以5×104个细胞/mL接种到6孔板中,并在细胞密度达到约70%时,根据LipofectamineTM3000(美国Thermo Fisher Scientific公司)的说明将PCIF1质粒、PCIF1 shRNA(sh-PCIF1)、ACOT8 shRNA(sh-ACOT8)和相应的NC(上海GenePharma公司)转染细胞。采用实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)检查转染效率。
1.5 RTFQ-PCR分析
采用TRIzol试剂(美国Thermo Fisher Scientific公司)从胃癌组织或细胞获得总RNA。然后,使用PrimeScript RT Reagent Kit(日本TaKaRa公司)进行反转录,使用TB Green Premix Ex TaqⅡ(日本TaKaRa公司)在ABI-7900 RTFQ-PCR系统(美国Applied Biosystems公司)进行RTFQ-PCR检测。RTFQ-PCR检测用的引物由广州吉赛生物科技股份有限公司设计合成。使用标准的2-ΔΔCT(周期阈值)方法测定PCIF1、ACOT8的相对表达水平。用于RTFQ-PCR的引物序列如下:ACOT8有义链5'-AGCTCCCGTGCCTTATGGTTA-3',反义链5'-GGCTGGTAGGTTCCCGGAT A-3';PCIF1有义链5'-ACTTGGCTCCCTTATCTGACC-3',反义链5'-TGTGCAGTGTGAGAAAGGCTT-3';GAPDH有义链5'-GGAGCGAGATCCCTCCAAAAT-3',反义链5'-GGCTGTTGTCATA CTTCTCATGG-3'。
1.6 RNA免疫沉淀定量聚合酶链反应(RNA immunoprecipitation quantitative polymerase chain reaction,RIP-qPCR)分析
使用离心柱(MiniBEST Universal RNA Extraction Kit;日本TaKaRa公司)以获得完整的总RNA,然后使用polyATtract mRNA分离系统(美国Promega公司)处理mRNA以进行纯化。随后,使用PCIF1或IgG抗体进一步用于RIP-qPCR以检测PCIF1结合ACOT8 mRNA。通过RIP-qPCR对产生的IP进行分析。
1.7 蛋白质印迹法(Western blot)检测
通过放射免疫沉淀测定缓冲液制备胃癌组织或细胞蛋白质,并通过二喹啉甲酸(bicinchoninic acid,BCA)蛋白质测定试剂盒(上海Beyotime公司)进行定量。对样品进行10%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE)分离,然后转移到聚偏二氟乙烯膜(美国Millipore公司)。将膜用5%脱脂牛奶封闭,用一抗在4℃下温育过夜,并与相应的HRP偶联二抗温育,通过化学发光法检测印迹带。使用的抗体包括针对PCIF1和GAPDH(作为阴性对照)的抗体购自英国Abcam公司,一抗均购自美国Proteintech公司。
1.8 细胞增殖试验
细胞计数试剂盒-8(cell counting kit-8,CCK-8)购自日本Dojindo公司,将其和5-乙炔基-2'-脱氧尿苷(5-ethynyl-2'-deoxyuridine,EdU)掺入试验评估细胞活力:将1×103个细胞接种到96孔板中并温育过夜,在指定时间点(24、48、72、96和120 h)向每个孔中加入10 μL CCK-8溶液试剂,并将细胞在黑暗中温育2 h。随后,通过Bio-Tek Elx 800酶标仪(美国Bio-Tek Instruments公司)测量450 nm波长处的吸光度(D)值。对于EdU测定,使用Cell-Light EdU Apollo 488体外成像试剂盒(广州锐博生物技术有限公司)检测胃癌细胞的DNA合成。在24孔板中培养总共5×104个细胞。随后,将细胞与EdU溶液一起温育2 h,与1×Apollo反应混合物反应30 min,并用Hoechst 33342染色30 min。通过ZEISS LSM800共聚焦显微镜(德国Carl Zeiss AG公司)对细胞进行检测和成像。
1.9 Transwell检测
将转染的胃癌细胞(2×104个细胞/孔)接种在transwell小室(美国Corning公司)中用于迁移测定,或接种在预涂有100 μL 1 μg/μL的Matrigel基质胶(美国BD Biosciences公司)的小室中用于侵袭性测定。分别将无血清培养基和完全培养基添加到上室和下室。温育24 h后,侵入的细胞用4%的多聚甲醛固定,1%的结晶紫染色,显微镜下拍照。
1.10 动物实验
BALB/c裸鼠(雌性,6~8周)购自北京维通利华实验动物技术有限公司。将小鼠随机分为NC组和PCIF1组,每组6只。将稳定转染的PCIF1过表达的AGS细胞(1×106个细胞)或载体转染细胞皮下注射到裸鼠的右背侧。在指定的时间点监测肿瘤体积。注射后25 d,处死小鼠,切除肿瘤,称重,拍照。
1.11 免疫组织化学检测
将移植瘤组织固定在4%的多聚甲醛中,并将石蜡包埋的组织切成4 μm的切片。阻断内源性过氧化物酶活性后,切片与一抗在4℃下温育过夜,然后在37℃下与HRP偶联的二抗温育1 h。接下来,切片用HRP底物进行DAB染色。免疫组织化学检测用PCIF1和ACOT8抗体购自英国Abcam公司。
1.12 统计学处理
所有数据均以x±s的形式呈现。使用Student’s t检验(双尾)或单因素方差分析(ANOVA)检验分析实验结果。P<0.05为差异有统计学意义。数据统计分析均使用SPSS 21.0进行处理。
2 结 果
2.1 PCIF1在胃癌组织和细胞中表现出显著升高的表达
首先,我们分析了GEPIA数据库和临床样本,发现PCIF1在胃癌组织中的表达显著增加(图 1A~C)。然后,使用GEPIA数据库分析了PCIF1表达水平与胃癌患者OS之间的相关性,发现PCIF1低表达患者具有更好的生存预测(图1D)。此外,胃癌细胞系(AGS、BGC823、MKN45 和 SGC7901)中PCIF1的表达显著高于非胃癌细胞系(GES-1)中的表达(图1E)。上述结果表明,PCIF1在胃癌组织和细胞中的表达明显更高。
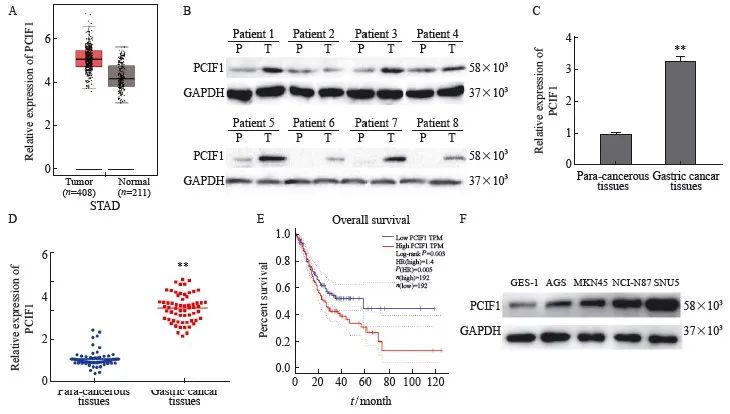
图1 胃癌组织和细胞中PCIF1表达
Fig. 1 Expression of PCIF1 in gastric cancer tissues and cells
A: The expressions of PCIF1 in gastric cancer tissues and normal control tissues were evaluated by GEPIA database; B: The relative expression levels of PCIF1 in para-cancerous tissues (P) and gastric cancer tissues (T) were examined by Western blot; C: The relative expression levels of PCIF1 in gastric cancer tissues and non-gastric cancer tissues were examined by RTFQ-PCR; D: GEPIA database analysis revealed that the high expression of PCIF1 indicated that the overall survival prediction of gastric cancer patients was better; E: The expression level of PCIF1 in gastric cancer cell lines was examined by Western blot. **: P<0.01, compared with para-cancerous tissues.
2.2 PCIF1是胃癌细胞恶性行为所必需的
为了评估PCIF1在胃癌中的作用,我们通过shRNA在SNU5细胞中稳定地敲低了PCIF1的表达(图2A)。与sh-NC组相比,sh-PCIF1组的细胞活力、EdU阳性细胞、迁移和侵袭细胞数均显著降低(P<0.05,图2B~F)。此外,我们通过慢病毒在AGS细胞中过表达PCIF1(图3A)。与NC组相比,PCIF1过表达组的细胞活力、EdU阳性细胞、迁移和侵袭细胞数均显著增加(P<0.05)(图3B~F)。这些数据表明,PCIF1在体外促进胃癌增殖和迁移。
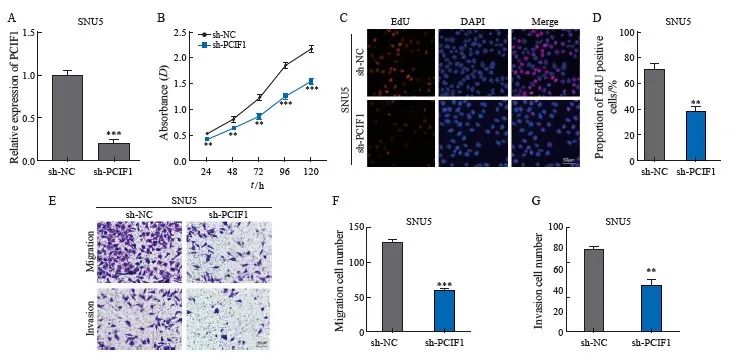
图2 敲除PCIF1在体外抑制胃癌增殖、迁移和侵袭
Fig. 2 Knockout PCIF1 inhibits the proliferation, migration and invasion of gastric cancer in vitro
A: RTFQ-PCR was used to evaluate the expression of PCIF1 knocked down by shRNA in SNU5 cells; B: CCK-8 assay was performed to evaluate the viability of SNU5 cells silenced by PCIF1; C: EdU assay was performed to evaluate the proliferation ability of SNU5 cells silenced by PCIF1; D-F: The effect of PCIF1 knock-down on migration and invasion of SNU5 cells was detected by transwell assay. *:P<0.05, compared with sh-NC group; **:P<0.01, compared with sh-NC group; ***: P<0.001, compared with sh-NC group.
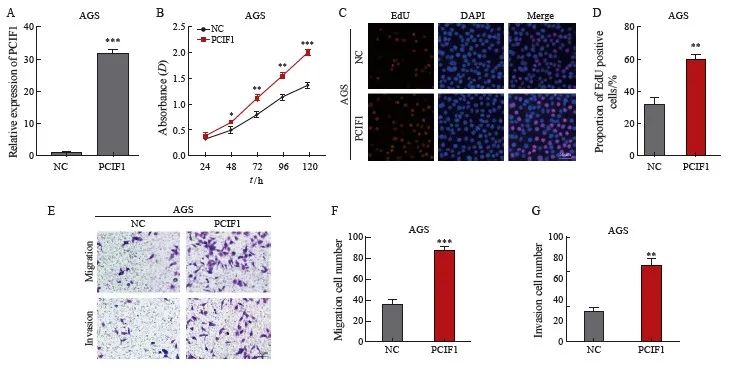
图3 PCIF1在体外促进胃癌增殖、迁移和侵袭
Fig.3 PCIF1 promotes the proliferation, migration and invasion of gastric cancer in vitro
A: RTFQ-PCR was used to evaluate the expression of PCIF1 upregulated by lentivirus in AGS cells; B: CCK-8 assay was performed to evaluate the activity of AGS cells up-regulated by PCIF1; C: EdU assay was performed to evaluate the proliferation ability of AGS cells up-regulated by PCIF1; D-F: Transwell was used to detect the effect of PCIF1 upregulation on the migration and invasion of AGS cells. *: P<0.05, compared with NC group; **:P<0.01, compared with NC group; ***:P<0.001, compared with NC group.
2.3 PCIF1调节胃癌中的ACOT8表达
为了进一步研究PCIF1在胃癌增殖和侵袭中的作用机制,首先对m6A2Target数据库中潜在的修饰底物进行了预测,显示ACOT8是A549细胞系中经过验证的PCIF1修饰底物。然而,在胃癌中 PCIF1和ACOT8之间的关系仍不清楚。因此,我们通过GEPIA数据库分析了胃癌中PCIF1和ACOT8之间mRNA表达的相关性,结果显示, PCIF1表达水平与ACOT8表达水平显著相关(图4A)。过表达PCIF1增强了AGS细胞中ACOT8 mRNA的表达(图4B)。RIP-qPCR结果显示,过表达PCIF1显著增强了AGS细胞中PCIF1结合ACOT8 mRNA的富集(图4C)。此外,测量了用RNA合成抑制剂α-鹅膏菌素处理的AGS细胞中ACOT8 mRNA的损失,结果显示PCIF1过表达延长了AGS细胞中ACOT8 mRNA的半衰期(图4D)。
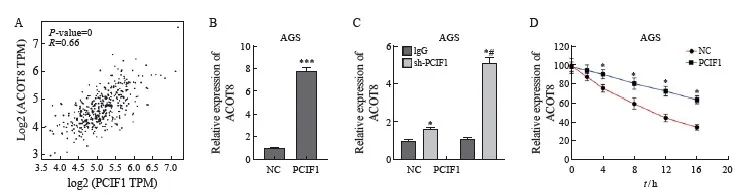
图4 PCIF1调节胃癌中的ACOT8表达
Fig. 4 PCIF1 regulates the expression of ACOT8 in gastric cancer
A: The correlation between PCIF1 and ACOT8 expression was analyzed by GEPIA database. B: RTFQ-PCR was used to evaluate the effect of overexpressing PCIF1 on ACOT8 expression in AGS cells (***:P<0.001, compared with NC group). C: RIP-qPCR was used to detect the enrichment of PCIF1 combined with ACOT8 in AGS cells (*: P<0.05, compared with IgG in NC group; #:P<0.05, compared with sh-PCIF1 in NC group). D: Overexpression of PCIF1 prolonged the half-life of ACOT8 mRNA in AGS cells (*:P<0.05, compared with NC group).
2.4 PCIF1通过调节ACOT8抑制胃癌细胞增殖和侵袭
为了证实PCIF1通过ACOT8发挥促肿瘤作用,我们敲低了PCIF1过表达的AGS细胞中ACOT8的表达并进行了拯救实验(图5A)。与PCIF1组相比,PCIF1 + sh-ACOT8组的细胞活力、EdU阳性细胞、迁移和侵袭细胞数均显著降低(P<0.05,图5B~F)。这些数据表明PCIF1通过调节ACOT8促进胃癌细胞增殖和侵袭。
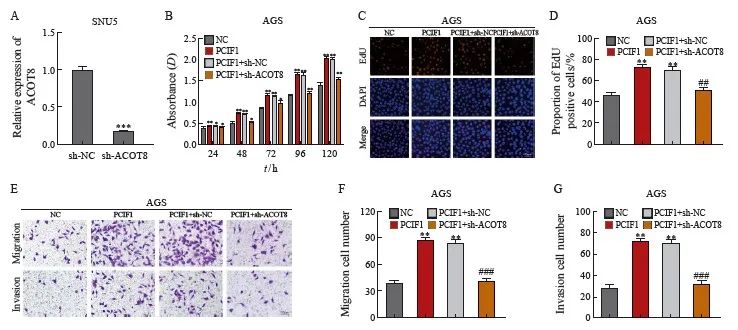
图5 PCIF1通过ACOT8发挥其促肿瘤作用
Fig. 5 PCIF1 exerts its tumor-promoting effect through ACOT8
A: RTFQ-PCR was used to confirm the efficiency of sh-ACOT8 in PCIF1 overexpressing AGS cells; B: CCK-8 assay was performed to assess the effect of ACOT8 silencing on the proliferative capacity of PCIF1 overexpressing AGS cells; C: EdU analysis of the effect of ACOT8 silencing on the proliferation of PCIF1 overexpressing AGS cells; D-F: Transwell assessment of the effect of ACOT8 silencing on migration and invasion of PCIF1 overexpressing AGS cells. *: P<0.05, compared with NC group;**: P<0.01, compared with NC group;***: P<0.001, compared with NC group; #: P<0.05, compared with PCIF1 group; ##:P<0.01, compared with PCIF1 group; ###: P<0.001, compared with PCIF1 group.
2.5 PCIF1在体内促进胃癌生长
采用皮下异种移植瘤模型来测定PCIF1对胃癌生长表达的影响。与NC组相比,PCIF1过表达组裸鼠的肿瘤体积和重量均显著增加(P<0.05,图6A~C)。免疫组织化学检测结果显示,PCIF1过表达组肿瘤组织中PCIF1和ACOT8的表达水平均明显增加(图6D)。
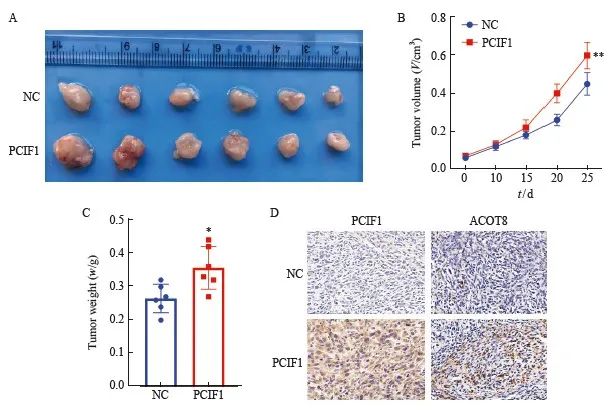
图6 PCIF1在体内促进胃癌生长
Fig. 6 PCIF1 promotes the growth of gastric cancer in vivo
A: Representative tumors after transplantation of PCIF1 overexpression or negative control AGS cells into nude mice; B: Comparison of tumor volumes in PCIF1 overexpressing or negative AGS cell transplanted tumor nude mice; C: Comparison of tumor weights; D: Expression levels of PCIF1 and ACOT8 in tumor tissues were determined using immunohistochemistry. *:P<0.05, compared with NC group; **:P<0.01, compared with NC group.
3 讨 论
研究[7-8]表明,m6Am修饰的异常与包括胃癌在内的多种肿瘤的发生、发展过程密切相关。Hu等[8]研究发现,血清中的m6Am可能作为结直肠癌和胃癌的早期发现和预后预测的潜在生物标志物。有研究[6]发现,FTO介导的细胞质m6Am去甲基化调节结直肠癌细胞的干细胞样特性。然而,PCIF1作为最新发现的m6Am唯一已知的修饰酶[9],其是否参与胃癌的进展仍不清楚。因此,我们目前的研究集中在PCIF1的作用上,并发现胃癌中PCIF1表达升高,并且PCIF1表达升高与胃癌患者较差的生存率相关。我们证实PCIF1在体外可促进胃癌细胞的生长和侵袭能力,PCIF1通过介导ACOT8参与调节胃癌的进展。ACOT8随后被证实是胃癌的致癌驱动因子。总之,PCIF1/ACOT8轴在胃癌进展中发挥重要 作用。
m6Am是细胞mRNA和一些小核RNA中第二常见的修饰,它发生在mRNA帽附近[10]。在正常生理条件下,甲基化修饰受到甲基转移酶和去
甲基化酶的精确调控,参与调控甲基化RNA的可变剪接、核输出、稳定性、翻译或降解,从而影响细胞代谢、细胞增殖和细胞分化[11]。研究[12]表明,由导致甲基化位点获得或丢失的突变或失调导致的RNA甲基化异常与包括胃癌在内的各种肿瘤的起始、进展转移和抑制密切相关。PCIF1作为唯一已知的哺乳动物mRNA m6Am甲基转移酶,到目前为止,只有两项研究证明了PCIF1在癌症中的作用。Zhuo等[7]发现了circ-ATAD1/miR-140-3p/YY1/PCIF1信号转导通路在加速胃癌细胞进展中的作用。Relier等[6]研究表明,PCIF1沉默减少了结肠球形成和m6Am/m6A比率,并导致CRC1结直肠癌细胞系对化疗产生耐药性。有研究[13]通过泛癌分析探索PCIF1的致癌和免疫原性作用,结果显示,PCIF1表达与癌症患者预后及免疫浸润相关,表明它是癌症治疗的潜在靶点。本研究通过功能丧失和功能获得实验证明了PCIF1在体外促进胃癌细胞的增殖、迁移和侵袭,并采用皮下异种移植瘤模型在体内验证了PCIF1的促肿瘤作用。
此外,我们还研究了PCIF1抑制胃癌生长和转移的潜在机制。基于m6A2Target数据库中PCIF1的预测底物,ACOT8是PCIF1用于m6A修饰的潜在底物。因此,本研究验证了胃癌细胞中PCIF1和ACOT8之间的关系。值得注意的是,PCIF1不仅与来自TCGA数据库的STAD中的ACOT8表达呈正相关,而且RTFQ-PCR检测结果也证实了PCIF1在胃癌细胞中过表达后ACOT8的变化。此外,本研究结果还表明,PCIF1可以延长ACOT8 mRNA在胃癌细胞中的半衰期。ACOT8是一种过氧化物酶体脂解相关酶,催化脂肪酰基辅酶A分解为FFA和辅酶A分子进行β-氧化[14]。由于ACOT8在直肠癌和肝癌细胞中高表达,已经有研究[15-16]报道了ACOT8在肿瘤发生、发展中的潜在作用。随后,本研究通过拯救实验证实了PCIF1通过调节ACOT8促进胃癌细胞增殖和侵袭。以往研究[10,17- 18]结果显示, m6Am修饰并不会改变 mRNA 转录或稳定性,因此PCIF1如何调节ACOT8表达有待于进一步 研究。
总之,本研究分析了PCIF1在胃癌中的作用机制。本研究结果表明,PCIF1在胃癌细胞系和组织中表达上调。此外,PCIF1/ACOT8轴参与介导胃癌细胞的恶性生物学行为产生。因此PCIF1可能是治疗胃癌的一个潜在靶点。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] SHIMURA T, KANDIMALLA R, OKUGAWA Y, et al. Novel evidence for m6A methylation regulators as prognostic biomarkers and FTO as a potential therapeutic target in gastric cancer[J]. Br J Cancer, 2022, 126(2): 228-237.
[2] RAY K. New markers and models of premalignancy and the early development of gastric cancer[J]. Nat Rev Gastroenterol Hepatol, 2020, 17(4): 193.
[3] 杨 敏, 赵国林, 张东伟. N6-甲基腺苷修饰在肿瘤及病毒感染中的研究进展[J]. 中华实验外科杂志, 2021, 38(4): 774-777.
YANG M, ZHAO G L, ZHANG D W. Research progress of N6-methyladenosine modification in tumor and virus infection[J]. Chin J Exp Surg, 2021, 38(4): 774-777.
[4] TAN B, LIU H, ZHANG S Y, et al. Viral and cellular N6-methyladenosine and N6, 2'-O-dimethyladenosine epitranscriptomes in the KSHV life cycle[J]. Nat Microbiol, 2018, 3(1): 108-120.
[5] TARTELL M A, BOULIAS K, HOFFMANN G B, et al. Methylation of viral mRNA cap structures by PCIF1 attenuates the antiviral activity of interferon-Β[J]. Proc Natl Acad Sci U S A, 2021, 118(29): e2025769118.
[6] RELIER S, RIPOLL J, GUILLORIT H, et al. FTO-mediated cytoplasmic m6Am demethylation adjusts stem-like properties in colorectal cancer cell[J]. Nat Commun, 2021, 12(1): 1716.
[7] ZHUO W, SUN M, WANG K, et al. m6Am methyltransferase PCIF1 is essential for aggressiveness of gastric cancer cells by inhibiting TM9SF1 mRNA translation[J]. Cell Discov, 2022, 8(1): 48.
[8] WU W Z, ZHANG F, ZHAO J, et al. The N6-methyladenosine: mechanisms, diagnostic value, immunotherapy prospects and challenges in gastric cancer[J]. Exp Cell Res, 2022, 415(2):113115.
[9] GAO S F, ZHOU J B, HU Z Y, et al. Effects of the m6Am methyltransferase PCIF1 on cell proliferation and survival in gliomas[J]. Biochim Biophys Acta Mol Basis Dis, 2022, 1868(11): 166498.
[10] LUO Q, MO J Z, CHEN H, et al. Structural insights into molecular mechanism for N6-adenosine methylation by MTA70 family methyltransferase METTL4[J]. Nat Commun, 2022, 13(1): 5636.
[11] XIE S S, CHEN W W, CHEN K H, et al. Emerging roles of RNA methylation in gastrointestinal cancers[J]. Cancer Cell Int, 2020, 20(1): 585.
[12] LI Q H, HE W L, WAN G H. Methyladenosine modification in RNAs: classification and roles in gastrointestinal cancers[J]. Front Oncol, 2020, 10: 586789.
[13] JIN M Z, ZHANG Y G, JIN W L, et al. A pan-cancer analysis of the oncogenic and immunogenic role of m6Am methyltransferase PCIF1[J]. Front Oncol, 2021, 11: 753393.
[14] PALMEIRA J D F, ARGAÑARAZ G A, DE OLIVEIRA G X L M, et al. Physiological relevance of ACOT8-Nef interaction in HIV infection[J]. Rev Med Virol, 2019, 29(5): e2057.
[15] GHARIB E, NASRINASRABADI P, ZALI M R. Development and validation of a lipogenic genes panel for diagnosis and recurrence of colorectal cancer[J]. PLoS One, 2020, 15(3): e0229864.
[16] YOU B J, CHEN L Y, HSU P H, et al. Orlistat displays antitumor activity and enhances the efficacy of paclitaxel in human hepatoma Hep3B cells[J]. Chem Res Toxicol, 2019, 32(2): 255-264.
[17] BOULIAS K, TOCZYDŁOWSKA-SOCHA D, HAWLEY B R, et al. Identification of the m6Am methyltransferase PCIF1 reveals the location and functions of m6Am in the transcriptome[J]. Mol Cell, 2019, 75(3): 631-643.e8.
[18] SUN H X, ZHANG M L, LI K, et al. Cap-specific, terminal N6-methylation by a mammalian m6Am methyltransferase[J]. Cell Res, 2019, 29(1): 80-82.


