我国学者发现:高强度智能微针用于椎间盘修复!
时间:2023-09-10 20:03:06 热度:37.1℃ 作者:网络
椎间盘退行性变(IVDD)是一个全球性的公共卫生问题。针刺或椎间盘摘除引起的纤维环损伤可再次触发IVDD。然而,目前还没有合适的方法来治疗房颤损伤。在本研究中,苏州大学韩凤选开发了高强度智能微针(MNs),它可以通过局部微创的方法穿透房颤组织,实现对药物的加速释放和近红外热疗的远程控制。负载双氯芬酸钠的PDA/GelMA复合MNs在细胞外“进攻”炎症微环境,减轻对细胞的损伤,在细胞内增加细胞保护性热休克蛋白的水平,以增强对敌对微环境的防御,实现“攻守兼备”。体外实验证明,光热与抗炎协同治疗能有效减轻炎症反应,抑制细胞凋亡,促进细胞外基质(ECM)的合成。体内实验表明,MNs可减轻炎症反应,促进细胞外基质沉积,降低细胞凋亡水平,恢复大鼠椎间盘的生物力学特性。总体而言,这种高强度的智能MNs显示出良好的“攻防”效果,可以为IVD修复提供一种新的策略。该研究以题为“High-Strength Smart Microneedles with “Offensive and Defensive” Effects for Intervertebral Disc Repair”的论文发表在《Advanced Materials》上。

该研究开发了高强度的智能MNs,它可以通过局部微创的方法穿透AF组织,随后通过近红外远程控制加速抗炎药物的释放和热疗。这种复合MNs的设计目的是在细胞外“攻击”炎症微环境,减轻对细胞的损伤,在细胞内增加细胞保护性HSP的水平,增强对敌对微环境的防御,达到“攻防兼备”的效果。评估了MNs对炎症、细胞凋亡、基质合成以及体内组织修复的影响。认为这种“攻防兼备”的MNs可以通过减轻细胞外炎症微环境、增强细胞的自我保护能力来促进IVD修复(方案1)。
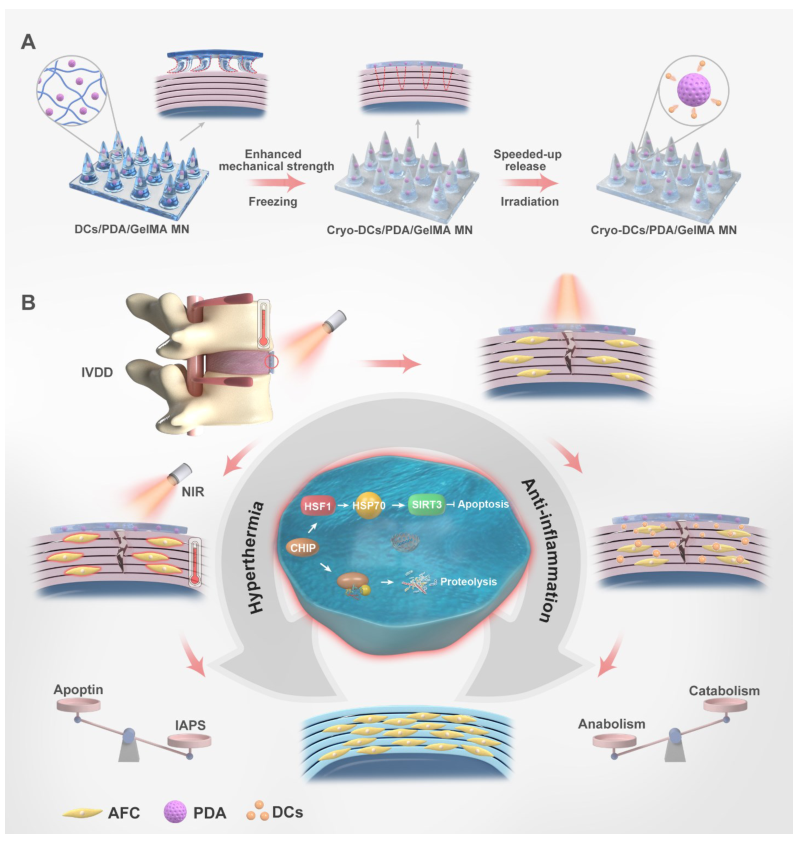
IVDD复合MNs的示意图
【复合水凝胶的表征】
PDA纳米颗粒是通过在去离子水/均三甲苯界面组装PDA初级颗粒和F127稳定乳液液滴来合成的。随后,将PDA纳米颗粒添加到GelMA溶液中,产生不同颗粒量的复合水凝胶。复合水凝胶还现出优异的光热性能。水凝胶上的纤维环细胞(AFCs)铺展良好,皱纹最小,表明细胞很好地粘附在水凝胶表面,并且它们的生长状态没有受到显着影响。同样,CCK8 测定和活/死染色的结果表明,近红外辐射对AFCs的增殖和活性几乎没有影响。因此,考虑到其在载药和光热治疗方面的潜在应用,选择含有0.4% PDA(wt/v)纳米粒子的复合水凝胶进行后续实验。
然后,测量了PDA和复合水凝胶的载药和递送能力,发现PDA纳米颗粒对DCs的包封率为74±2.6%。随后,将负载DCs的PDA添加到水凝胶中,药物释放结果显示,在特定时间间隔的NIR照射10分钟后,DCs出现显着的爆发释放,表明NIR照射影响复合水凝胶的药物释放行为。研究发现,高温伴随着AFCs的氧化应激,添加PDA可以降低ROS水平。因此,所构建的复合水凝胶具有由近红外切换触发的智能药物释放,可能是体内治疗的绝佳候选者。
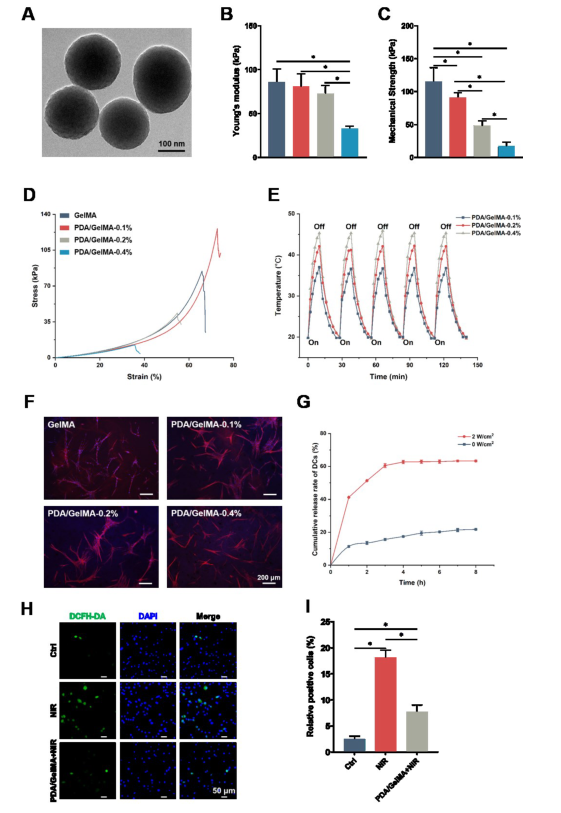
图1.复合水凝胶的表征
【光热疗法对AFCs的影响】
温和的热疗(40-43℃)已被证明可以促进组织修复而不损伤周围的健康组织。为了确定纤维环细胞(AFCs)是否能够以细胞自主的方式感知高温,定期用近红外辐射水凝胶上的细胞。qPCR分析表明,AFCs中HSP基因的转录因光热刺激而显着增加。Western blot分析检测不同组AFCs中热休克蛋白相关蛋白和合成代谢相关蛋白的表达情况,结果与qPCR结果相似。总的来说,这些发现表明PTT在IVD组织工程中具有广阔的应用前景。
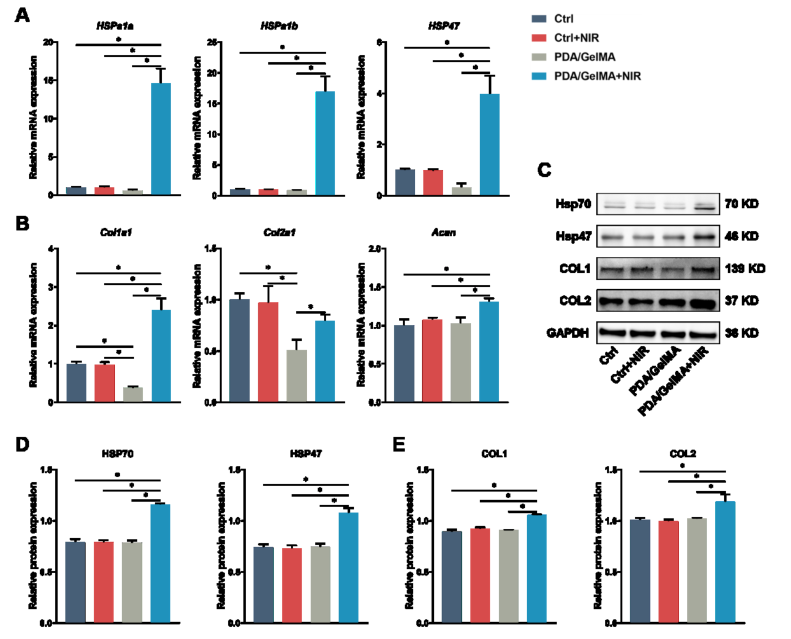
图2. 通过PTT体外调节AFCs中的基因和蛋白质表达
【抗炎治疗与PPT的体外协同作用】
本研究采用LPS诱导的IVDD模型来验证协同抗炎和PTT治疗对IVDD的修复效果。qPCR 分析结果表明,LPS增加了AFCs中炎症基因的水平。DCs/PDA/GelMA+NIR组炎症相关基因的表达下降最为显着。在NIR激发下,AFCs中HSP基因的转录增加,并且在 DCs/PDA/GelMA+NIR组中还观察到分解代谢相关基因的表达增加和合成代谢相关基因的表达减少。接下来,在蛋白质水平上评估协同治疗对AFCs的治疗效果。结果表明,DCs/PDA/GelMA组中COL1和COL2蛋白的表达量高于LPS和LPS+NIR组,并且DCs/PDA/GelMA+NIR组中蛋白水平进一步升高。流式细胞术分析表明,抗炎作用可以在一定程度上降低细胞凋亡水平,但PTT和抗炎作用联合抗凋亡作用最显着。因此,协同治疗可以有效减少AFCs的凋亡,促进细胞修复。
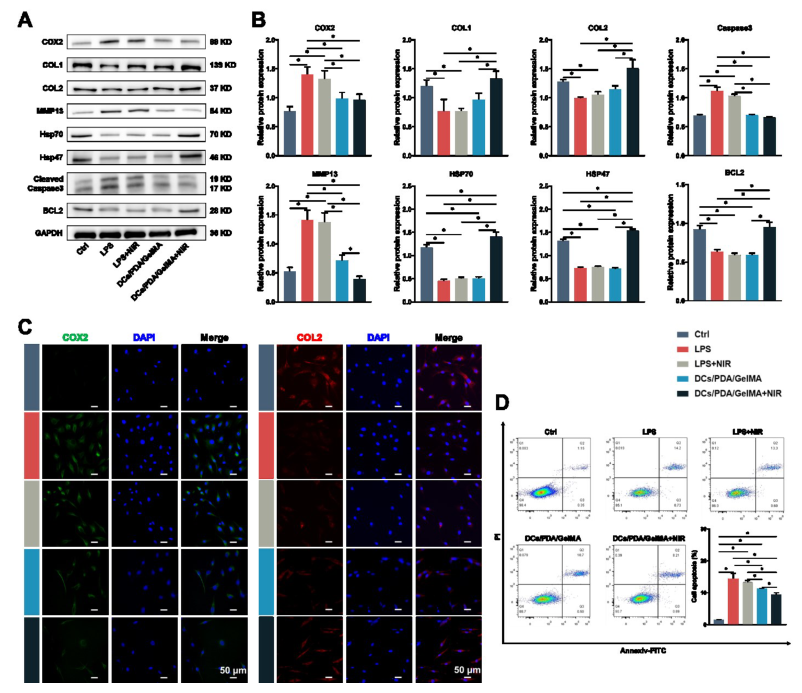
图3.抗炎与PTT协同治疗后AFCs蛋白表达
【复合MNs的特征】
微针 (MN)技术提供了一种有前途的方法,以微创方式将药物精确、受控地输送到特定组织。为了制备复合MNs,将预凝胶溶液填充到具有MNs阵列图案的PDMS模具中,然后光交联形成MNs,随后脱模并干燥。由此产生的金字塔形MNs的高度为 00 µm,底部直径为270 µm。此外,掺入PDA纳米颗粒赋予复合MNs优异的光热性能,其呈现不透明的黑色。为了提高机械强度,采用冷冻方法制备cryo-MNs。事实上,纳米颗粒的添加并没有改MNs的机械强度,冷冻处理后机械强度得到有效提高,能够成功渗透到大鼠IVD中。

图 4.复合MNs的表征
【复合MNs对IVD的体内修复】
为了评估体内治疗效果,使用复合MNs穿刺术后大鼠的IVD。结果表明,抗炎和PTT的协同治疗可以促进ECM合成,抑制细胞凋亡,恢复NP组织完整性,从而抑制IVDD。
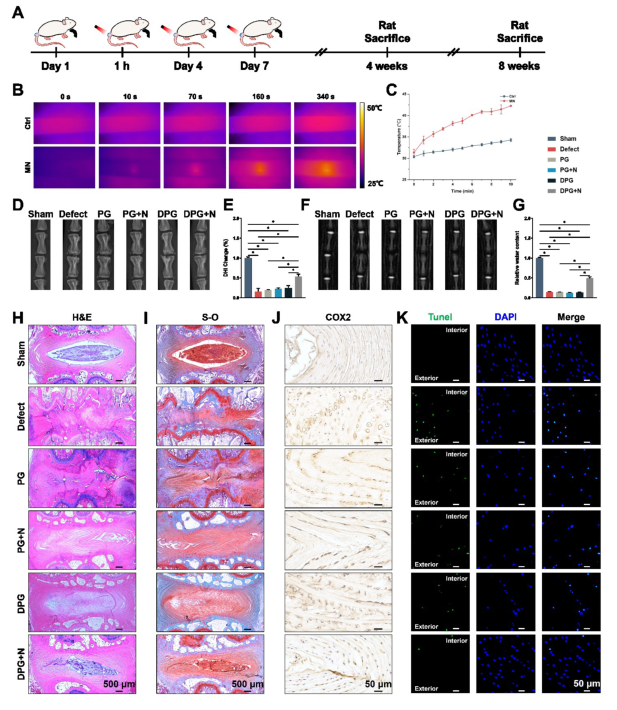
图 5.复合MNs对IVD的体内修复
【离体尾椎的生物力学分析】
考虑到轻微的椎间盘损伤可能会引起IVD微观行为的显着变化,从而导致生物力学改变,该研究通过生物力学测试评估了使用复合MNs进行IVD修复后生物功能的恢复情况。轴向循环拉压试验结果显示,与Sham组相比,Defect组的轴向活动范围(ROM)和轴向中性区(NZ)长度显着增加,提示IVDD的发生。DPG+N组的NZ轴向长度减少最显着,压缩刚度和拉伸刚度减少最小,表明生物力学功能得到了一定程度的恢复。

图 6.生物力学分析
【基因网络与AFCs信号转导的协同治疗】
为了了解PTT协同治疗和AFCs抗炎作用的机制作用,在相应治疗后通过RNA测序对AFCs进行转录组分析。结果表明协同治疗对AFCs的转录组有影响。基因本体(GO)生物过程结果显示LPS组中与蛋白质泛素化、细胞凋亡过程和蛋白水解相关的基因上调。然后,该研究在蛋白质水平上探讨了协同治疗的生物学机制。结果表明协同作用可以影响CHIP的下游基因,从而发挥治疗作用。总的来说,协同治疗通过调节蛋白质泛素化和细胞凋亡来促进组织修复。
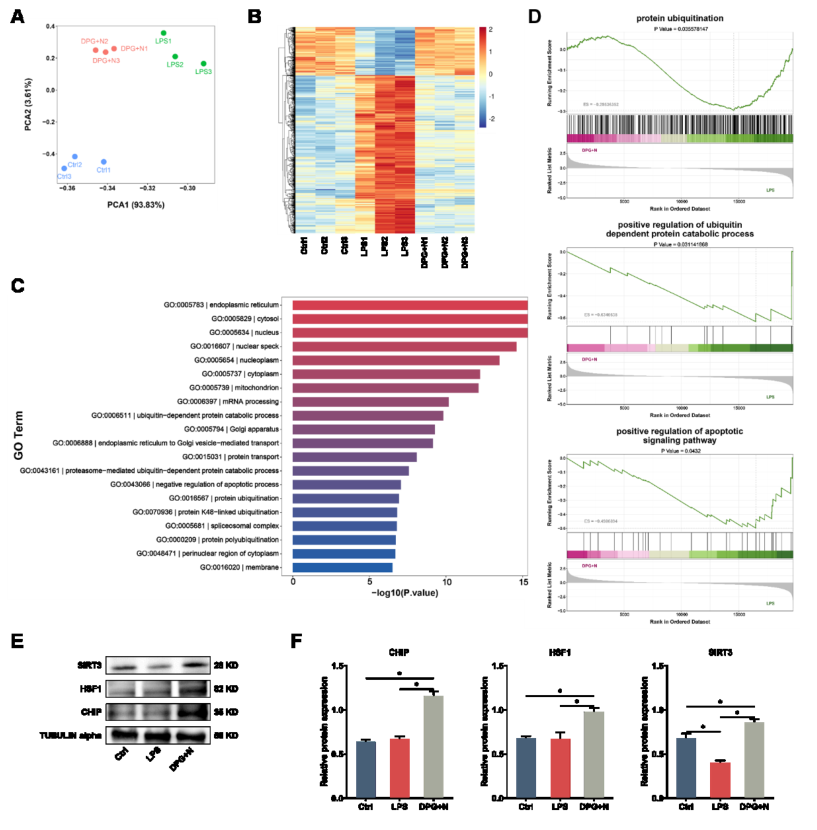
图 7. 协同治疗的分子机制
【小结】
本研究开发了高强度、智能的MNs,可以穿透并锚定于房颤组织,局部释放抗炎药物,并通过近红外远程控制实现热疗。 DCs的释放通过NIR调节缓解IVDD的炎症微环境,复合水凝胶产生的温和热量通过调节蛋白质泛素化和细胞凋亡促进AF组织修复。这种具有“攻防”作用的高强度智能MNs,对外调节细胞外微环境,对内调节细胞的自我保护,促进IVD修复,为IVD修复,特别是容易被忽视的AF缺陷的修复提供了新的策略。由于仍需要优化,未来对该系统的研究将集中在近红外穿透力的提高和长期效率验证上。
原文链接:
https://doi.org/10.1002/adma.202305468


