JCI Insight:PGC-1α介导的血管生成可预防小鼠肺动脉高压
时间:2023-09-11 16:58:13 热度:37.1℃ 作者:网络
研究背景:
肺动脉高压(PH)是一种生命威胁的疾病,其特点是肺小动脉逐渐狭窄。尽管VEGF在PH患者的肺部和动物PH模型中高度表达,但血管生成的参与仍然不明确。为了澄清PH中血管生成的病理生理功能,我们使用三维成像比较了缺氧(Hx)和SU5416(VEGFR2抑制剂)加Hx(SuHx)小鼠PH模型中的血管生成反应。
研究方法及研究结果:
三维成像分析显示,Hx-PH小鼠的肺部出现了血管生成反应,但SuHx-PH模型的血管生成反应不明显。选择性的VEGFR2抑制剂cabozantinib与Hx一起使用也抑制了血管生成反应,并使Hx-PH恶化,程度与SuHx相同。在Hx-PH小鼠的肺部,内皮细胞增殖活化受体γ共激活因子1α(PGC-1α)的表达随着血管生成而增加,但SuHx小鼠中没有。在肺内皮细胞特异性Ppargc1a-KO小鼠中,Hx引起的血管生成受到抑制,氧化应激、细胞衰老和DNA损伤增加,PH也恶化。相反,使用baicalin(一种增强内皮细胞中PGC-1α活性的黄酮类化合物)治疗改善了Hx-PH,增加了Vegfa的表达和血管生成。肺内皮细胞PGC-1α介导的血管生成对于适应Hx的反应至关重要,可能代表了PH的潜在治疗靶点。
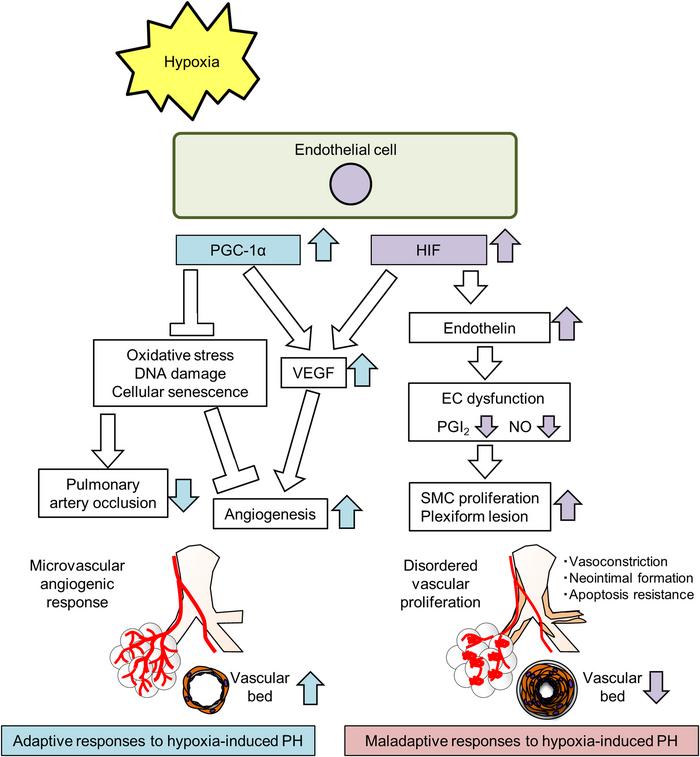
研究结论:
最近在组织透明技术结合的3D成像方面的进展极大地增进了对各个医学领域中人类疾病的理解,包括神经学和肾脏学。在本研究中,我们旨在使用我们的新型3D成像系统评估Hx和SuHx小鼠模型中的肺血管重塑,以探索PH病理的潜在机制,这些机制在严重程度上有所不同。在Hx模型中,观察到明显扩展到外周肺组织的血管生成反应,而更严重的SuHx模型显示较少的血管生成,血管生成与PGC-1α表达的临时增加相关。与Hx-PH和SuHx模型相比,CabHx小鼠模型也抑制了血管生成反应并恶化了PH。PGC-1α在转录水平和转录后水平都受到调控。PGC-1α的转录调控主要由环磷酸腺苷响应元素结合蛋白(CREB)、肌细胞增强因子2(MEF2)和FoxO1转录因子介导。SIRT1可以通过改变其乙酰化状态来改变PGC-1α的活性,而AMPK则调节PGC-1α的乙酰化状态和表达。在慢性晚期PH的患者和动物中,已报道了AMPK和PGC-1α的表达和活性降低。一致地,缺乏SMC特异性Creb或Foxo1、EC特异性Mef2c、Ampk或可诱导的全身性Sirt1的小鼠表现出PH的恶化。此外,一些研究表明,增加PGC-1α相关因子的表达和/或活性可以阻止PH的进展。激活FoxO、MEF2或AMPK可减轻小鼠模型中PH的进展。我们在Hx-PH小鼠中的发现支持了这些先前的结果,表明旨在增加PGC-1α激活的治疗可能减轻或预防PH的肺血管重塑。总之,我们的研究结果表明,肺内皮细胞PGC-1α介导了低氧小鼠的EC保护和血管生成。这些机制可能代表了开发用于预防和治疗PH的靶向治疗的潜在途径。
原始出处:
Fujiwara T, Takeda N, Hara H, Ishii S, Numata G, Tokiwa H, Katoh M, Maemura S, Suzuki T, Takiguchi H, Yanase T, Kubota Y, Nomura S, Hatano M, Ueda K, Harada M, Toko H, Takimoto E, Akazawa H, Morita H, Nishimura S, Komuro I. PGC-1α-mediated angiogenesis prevents pulmonary hypertension in mice. JCI Insight. 2023 Sep 8;8(17):e162632. doi: 10.1172/jci.insight.162632. PMID: 37681410.


