NBE:中国科学院梁兴杰/吴雁等开发新的水凝胶,抑制CAR-T细胞治疗期间的细胞因子释放综合征
时间:2023-09-13 20:00:43 热度:37.1℃ 作者:网络
嵌合抗原受体(CAR) T细胞的输注可以触发释放危及生命的超生理水平的促炎细胞因子。然而,关于这种细胞因子释放综合征(CRS)的时间和严重程度的不确定性需要仔细监测给予中和抗体所需的条件。
2023年9月11日,中国科学院纳米科学卓越创新中心梁兴杰、吴雁及Gong Ningqiang共同通讯在Nature Biomedical Engineering在线发表题为“Suppression of cytokine release syndrome during CAR-T-cell therapy via a subcutaneously injected interleukin-6-adsorbing hydrogel”的研究论文,该研究展示了一种温度敏感的水凝胶,结合了促炎细胞因子白细胞介素-6 (IL-6)的抗体,并在CAR-T细胞输注前皮下注射,可显著降低CRS期间IL-6的水平,同时保持治疗的抗肿瘤功效。
该研究发现,在免疫缺陷小鼠和移植了人造血干细胞的小鼠中,皮下吸附IL-6的水凝胶在很大程度上抑制了CAR-T细胞诱导的CRS,大大提高了动物的存活率,减轻了与游离IL-6抗体相比的发热、低血压和体重减轻。植入的水凝胶在冷却诱导的凝胶-溶胶转变后可以很容易地用注射器取出,可以使CRS的管理从监测转变为预防。

嵌合抗原受体(CAR)修饰的基因工程T细胞已经成为一种强大的临床策略,可以根除许多血液系统恶性肿瘤,特别是B细胞淋巴瘤。一些CAR-T细胞疗法已经被FDA和许多其他监管机构批准,其他疗法目前正在进行临床试验。尽管这种类型的疗法显示出令人印象深刻的抗肿瘤功效,但由细胞因子释放综合征(CRS)引起的危及生命的并发症为更广泛的应用带来了障碍。CRS的特点是细胞因子如IL-6和TNF-α水平急剧升高,从而诱发一系列症状,包括高热、体重减轻、器官衰竭甚至死亡。临床上已使用皮质类固醇等类固醇激素药物抑制CRS。然而,已经证明皮质类固醇不仅抑制CRS,而且还抑制CAR-T细胞活性和患者的免疫系统。
最近的一项研究报道,减少儿茶酚胺与房利钠肽抑制CRS。然而,当CRS不存在时,这种疗法可能会扰乱正常的细胞因子水平。越来越多的研究表明,某些免疫细胞,特别是巨噬细胞和单核细胞,参与了严重的CRS和神经毒性。这些细胞是包括IL-6在内的有毒细胞因子的主要来源。IL-6在CRS的产生、发展和管理中起着关键作用,是导致患者发生危及生命的毒性的主要原因。IL-6阻断抗体如siltuximab (IL-6抗体)和tocilizumab (IL-6受体抗体)在临床上被广泛用于治疗CRS。
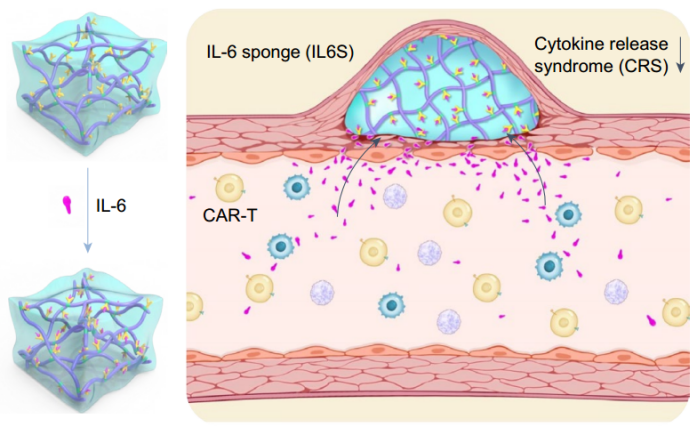
IL6S可预防CAR-T细胞诱导的细胞因子释放风暴及相关不良反应(图源自Nature Biomedical Engineering)
然而,目前的IL-6阻断策略面临以下挑战:(1)抗体容易从体内清除。(2)全身引入阻断抗体通常会引起一些不良毒性,如高尿酸血症、呼吸道感染和肝毒性。此外,许多临床研究表明tocilizumab不能控制迟发性神经毒性,甚至可能加重神经毒性。(3) 目前临床的CRS管理策略需要持续监测CAR-T细胞输注后的细胞因子和CRS相关症状。任何延迟给药IL-6R/IL-6阻断抗体都会导致严重的毒性,包括器官衰竭甚至患者死亡。美国移植与细胞治疗学会(ASTCT)定义了CRS分级系统并提供了干预指导。然而,相应的干预措施是根据已经出现的症状的严重程度而给予的。即使通过及时干预,当CRS被发现时,也可能已经对患者造成永久性损害。如果在CRS发病前给予IL-6R/IL-6阻断抗体,会影响正常的IL-6水平。到目前为止,很难准确预测患者是否以及何时会发展为CRS,以及其严重程度。
该研究提出了一种IL-6 sponge (IL6S),用于预防CAR-T细胞诱导的CRS。IL6S是由IL-6特异性抗体化学偶联到热敏水凝胶聚(N-异丙基丙烯酰胺-共甲基丙烯酸)制备的。IL6S可以在CAR-T细胞输注前给予,实时捕捉CRS过程中异常升高的IL-6。此外,IL6S治疗也存在CRS相关症状,包括高死亡率、体重减轻和低血压,但它并不影响CAR-T细胞的抗肿瘤功效。此外,在注射部位冰敷后,IL6S可以很容易地用注射器取出。这种sponge策略将CRS管理从传统的阻断缓解转变为有效的预防,因此具有更安全的CAR-T细胞治疗的潜力。综上所述,IL6S将CRS管理从传统的阻断缓解转变为有效的预防,因此可能最终适用于临床的CRS管理。
原文链接:
https://www.nature.com/articles/s41551-023-01084-4


