STTT:王福俤/闵军霞梳理靶向铁死亡药物研发大方向
时间:2023-09-24 08:17:03 热度:37.1℃ 作者:网络
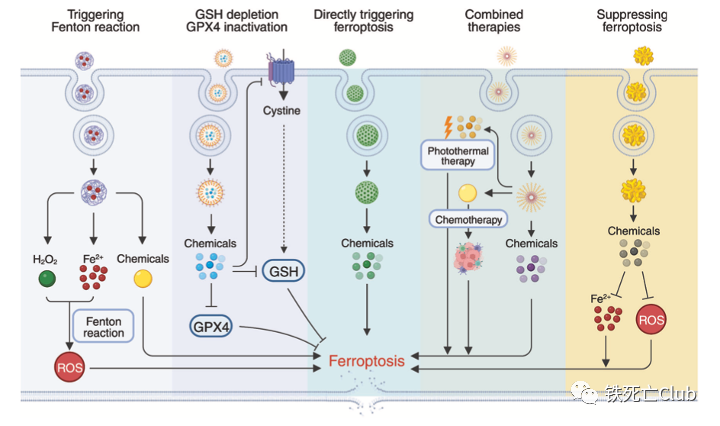
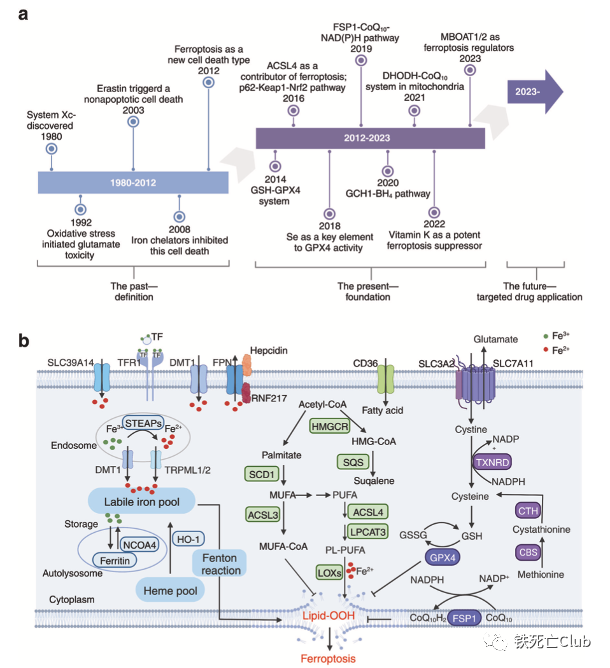
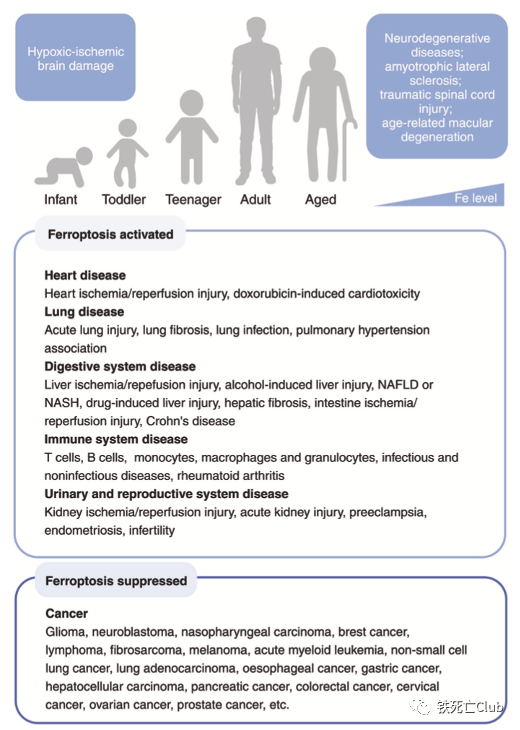
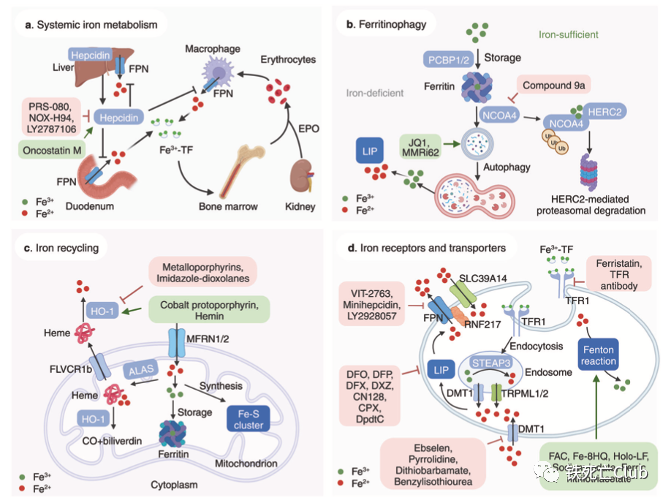
铁死亡(Ferroptosis)是于2012年被首次发现并命名的铁离子依赖的新型程序性细胞死亡方式[2],已成为生命科学、医学和化学等领域的全球科学热点,其在肿瘤、神经退行性疾病、组织器官损伤、免疫相关疾病等重大疾病的发生发展中发挥重要作用。铁死亡发生的关键特征包括铁离子稳态失衡介导的脂过氧化及细胞还原力的减弱,其调控网络复杂且精巧。靶向铁死亡调控网络开发小分子药物的研究已展现出不错的临床应用前景,有望成为棘手疾病治疗的强有力武器。 Part 1:铁死亡研究发展历程及其调控网络概述 经历了30多年相关研究的积累之后,铁死亡在2012年被正式命名,且在近10年成为全球的研究热点;铁死亡的分子机制被不断更新、丰满,成就了一张精妙的调控网络。 铁死亡研究的发展历程及主要调控通路 (文中Figure 1) 铁死亡的分子调控主要由三大部分组成:铁离子代谢,脂质过氧化代谢及细胞还原力调节。顾名思义,铁离子在铁死亡的调控中具有相当重要的意义。铁离子稳态的失衡可介导脂质过氧化物的积累,而脂质过氧化物正是铁死亡的“罪魁祸首“。细胞还原力,如谷胱甘肽,可帮助细胞清除脂质过氧化物而保护细胞免于铁死亡,因此细胞还原力与铁死亡“水火不容”。 Part 2:铁死亡在众多疾病发生发展中的作用 综述还系统性总结了近年来关于铁死亡与疾病的相关研究,跨越整个生命周期。其中王福俤/闵军霞教授团队也贡献很多研究成果,涉及铁死亡在心血管疾病及肝脏组织损伤中的作用发现[3-7]。 铁死亡与各类疾病的相关研究总结 (文中Figure 2) Part 3:靶向铁死亡调控网络的小分子药物研究进展 基于铁死亡在各类疾病中的重要作用,靶向铁死亡开发药物称为多种疾病治疗的新策略。作者们总结了这方面相关研究的最新进展,细分调控通路进行了全面阐述。 靶向铁离子稳态代谢:铁离子的代谢涉及全身多系统的协调运作,肠道的吸收,肝脏的储存动员,造血系统的消耗,脾脏的回收利用等等,因此靶向铁离子代谢调控通路具有较大的发挥空间。同时,多种铁离子螯合剂等已具有临床应用许可,对其的开发再利用是不错的选择。 靶向铁离子代谢调控通路调节铁死亡的小分子总结 (文中Figure 3) 靶向氧化还原代谢:强有力的还原力可保护细胞免受铁死亡的攻击;还原力的下降可使细胞处于铁死亡易感状态。通过调节细胞内还原力的产生,可达到使细胞发生铁死亡或者抵抗铁死亡的目的。 靶向细胞氧化还原代谢通路调节铁死亡的小分子总结 (文中Figure 4) 靶向脂质过氧化物产生调节铁死亡的小分子总结 (文中Figure 5) Part 4:纳米技术构建靶向铁死亡药物的研究总结 文中作者们所总结靶向铁死亡发生的小分子虽有较多理论结果支撑,但多数距进入临床应用还有很长的路要走。较差的药代动力学,靶向性,可能产生的副作用等都是阻碍这些小分子成药的绊脚石,因此利用纳米技术构建这些小分子的传递系统是小分子成药的有力助推器。文中作者们总结了目前应用纳米技术构建靶向铁死亡小分子药物的五大策略。 纳米技术构建小分子药物靶向铁死亡的五大策略 (文中Figure 6) Part 5:挑战与机遇 最后,作者们还提出了靶向铁死亡的小分子成药策略面临的挑战,并讨论了该领域当下的机遇。虽然目前研究发现的铁死亡调控机制可能只是冰山一角,但过去十年取得的令人欣喜的进展,奠定了靶向铁死亡开发小分子药物的疾病治疗策略的坚实基础。 该综述论文第一作者为孙淑敏博士,姜剑伟博士,及沈洁博士;通讯作者为浙江大学闵军霞教授和王福俤教授。相关研究工作受到国家自然科学基金、科技部国家重点研发计划的资助。 【论文作者简介】 王福俤 教授 国家杰青,国家万人计划学者,科技部中青年领军人才,国务院政府特殊津贴专家,国家百千万人才工程“有突出贡献中青年专家”,中国科学院百人计划学者,全球前2%顶尖科学家,中国生物物理学会生物微量元素分会创始会长。先后在Nature、Nature Genetics、Nature Medicine、Nature Reviews Cardiology、Blood、Cell Research、Circulation Research、Hepatology和PNAS等优秀学术期刊发表190余篇论文,论文他引13300余次。 闵军霞 教授 浙江大学转化医学研究院/浙江大学医学院附属第一医院双聘教授、博士生导师。浙江省特聘专家。团队以基因敲除小鼠模型、肿瘤移植瘤模型及临床大数据多组学技术开展铁死亡与重大疾病、肿瘤转化医学及人类长寿机制等为主要研究方向,在Nature Medicine、Circulation Research、Advanced Science、Blood、Hepatology和PNAS等国际著名期刊发表105余篇研究论文。 孙淑敏 博士后 现为浙江大学医学院/附属第一医院博士后,在博士及博士后阶段主要围绕微量元素在细胞命运决定中的功能和机制展开研究,以第一作者在国际杂志期刊上发表相关研究论文多篇。 参考文献 1.Sun, et al., Targeting ferroptosis opens new avenues for the development of novel therapeutics. Signal Transduct Target Ther, 2023. 8: 372. 2.Dixon, S.J., et al., Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell, 2012. 149(5): p. 1060-72. 3.Fang, X., et al., The molecular and metabolic landscape of iron and ferroptosis in cardiovascular disease. Nat Rev Cardiol, 2023. 20(1): p. 7-23. 4.Fang, X., et al., Loss of cardiac ferritin H facilitates cardiomyopathy via Slc7a11-mediated ferroptosis. Circ Res, 2020. 127(4): p. 486-501. 5.Fang, X., et al., Ferroptosis as a target for protection against cardiomyopathy. Proc Natl Acad Sci U S A, 2019. 116(7): p. 2672-2680. 6.Fang, X., et al., Malic enzyme 1 as a novel anti-ferroptotic regulator in hepatic ischemia/reperfusion injury. Adv Sci (Weinh), 2023. 10(13): p. e2205436. 7.Yu, Y., et al., Hepatic transferrin plays a role in systemic iron homeostasis and liver ferroptosis. Blood, 2020. 136(6): p. 726-739.
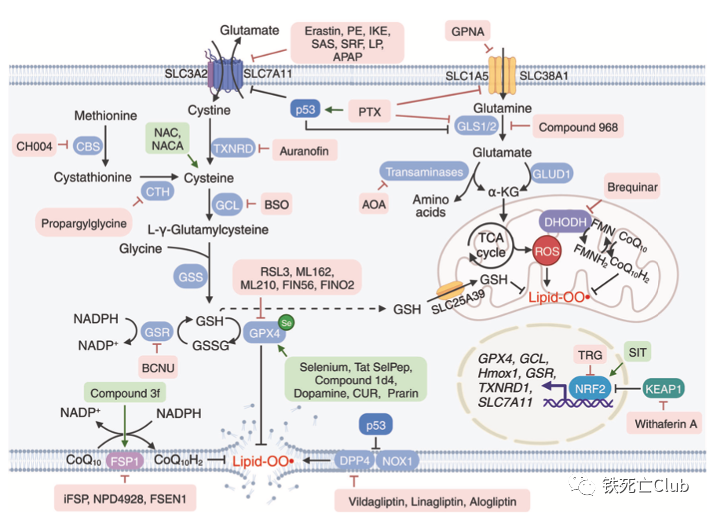
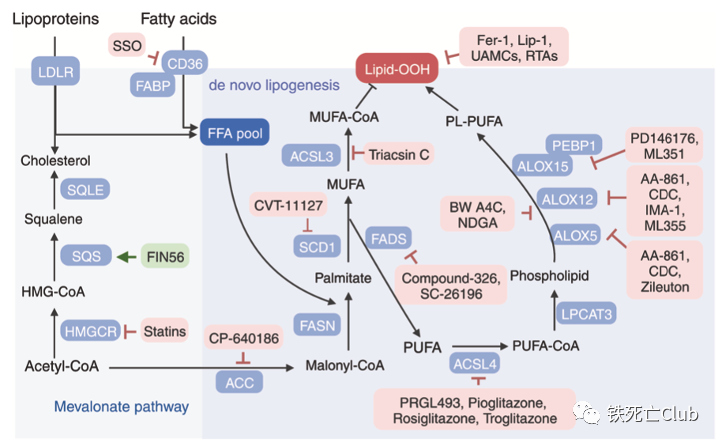
靶向脂质代谢:脂质过氧化物在细胞质膜和器膜中的堆积是铁死亡发生的驱动者,调节这些过氧化物的产生无异于是调控铁死亡的有力手段。作者们总结了从底物单一脂肪酸至脂质过氧化物生成的各项重要过程及可调控这些过程的小分子化合物。