令人烦恼的结节性痒疹,怎么办?
时间:2023-09-26 11:17:31 热度:37.1℃ 作者:网络
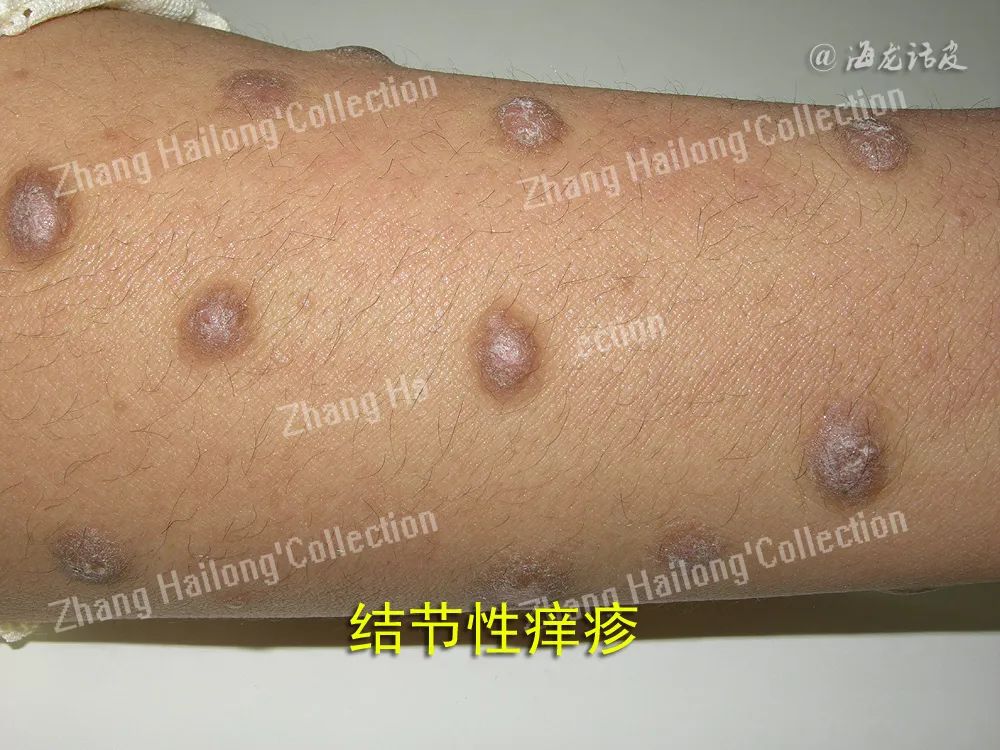
结节性痒疹(prurigo nodularis,PN),是一种慢性瘙痒性、炎症性皮肤疾病,临床表现为对称分布的角化过度性丘疹和结节,伴有剧烈瘙痒,瘙痒引起搔抓而使本病变得愈加严重。PN有较特征性的正角化过度表现。长期顽固性瘙痒给患者心理带来严重的影响,并极大降低患者的生活质量。目前该病病因不明,皮肤疾病、系统性疾病、神经或精神/心理因素等均可诱发PN发生。
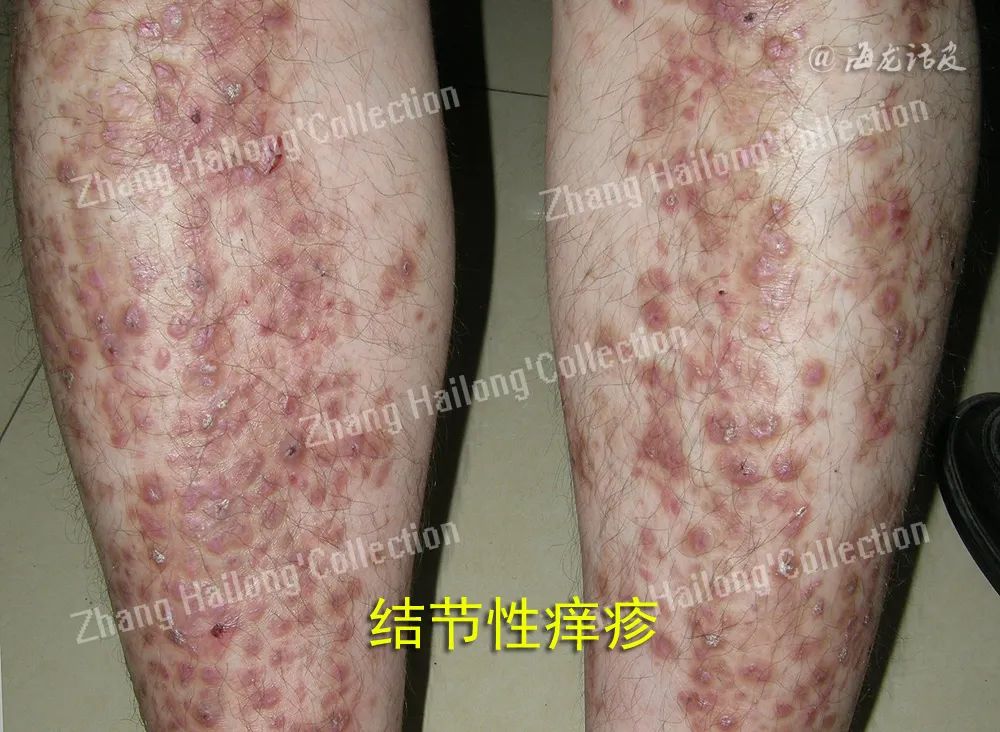
深刻认识该病的发病机制是获取有效治疗手段的前提。近年来,研究发现P物质(substance P,SP)、白细胞介素(interleukin,IL)-31、IL-4和IL-13等免疫炎症因子、肿瘤抑制素M(oncostatin M,OSM)β受体及μ/κ阿片受体(μ/κ opioid receptor,MOR/KOR)等在PN发病中作用显著,是PN潜在的治疗作用靶点。
一 结节性痒疹病因
PN与皮肤疾病、内脏疾病、神经性疾病、心理性疾病等多种疾病相关。有研究指出46.3%的PN患者存在特应性体质或罹患特应性皮炎,即特应性皮炎结节痒疹型。另外,有研究指出,PN与Th2型炎症反应有关,PN患者的IL-4和IL-31等2型炎症相关细胞因子表达上调。
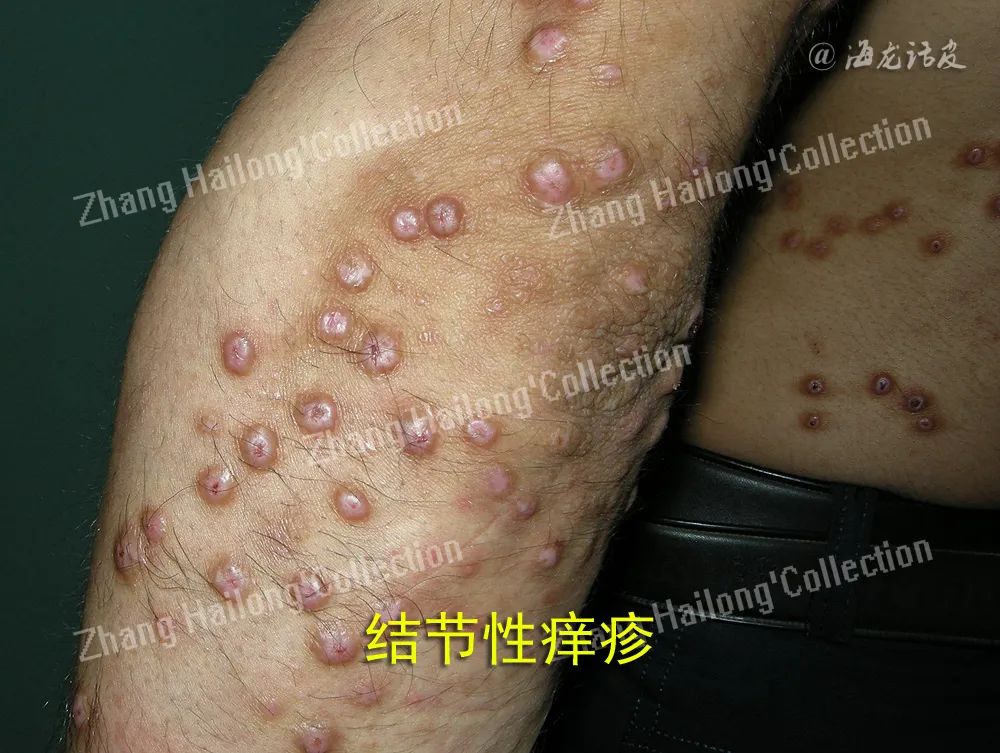
绝大多数PN患者可与多种疾病并存,如湿疹、银屑病、蕈样肉芽肿、皮肤分支杆菌感染等其他皮肤病;HIV感染、HCV感染、胃幽门螺杆菌感染等感染性疾病;糖尿病、甲状腺疾病等代谢疾病;肝病、肾病等脏器疾病;淋巴瘤、癌症等肿瘤性疾病;情绪压力、心理障碍、焦虑乃至抑郁等神经精神性疾病,但仍然有13%的患者找不到任何诱因。剧烈瘙痒-搔抓循环是导致PN成为慢性、反复性皮肤病的主要因素。
二 结节性痒疹发病机制
以往曾认为黑素细胞是唯一参与黄褐斑病程进展的细胞。目前已证实,成纤维细胞、皮脂腺细胞、角质形成细胞、血管内皮细胞、肥大细胞等也起到一定作用,涉及色素合成增加与转运障碍、基底膜破坏、血管增生和血液瘀滞、炎症反应、皮肤屏障受损、 光老化等生物学过程。
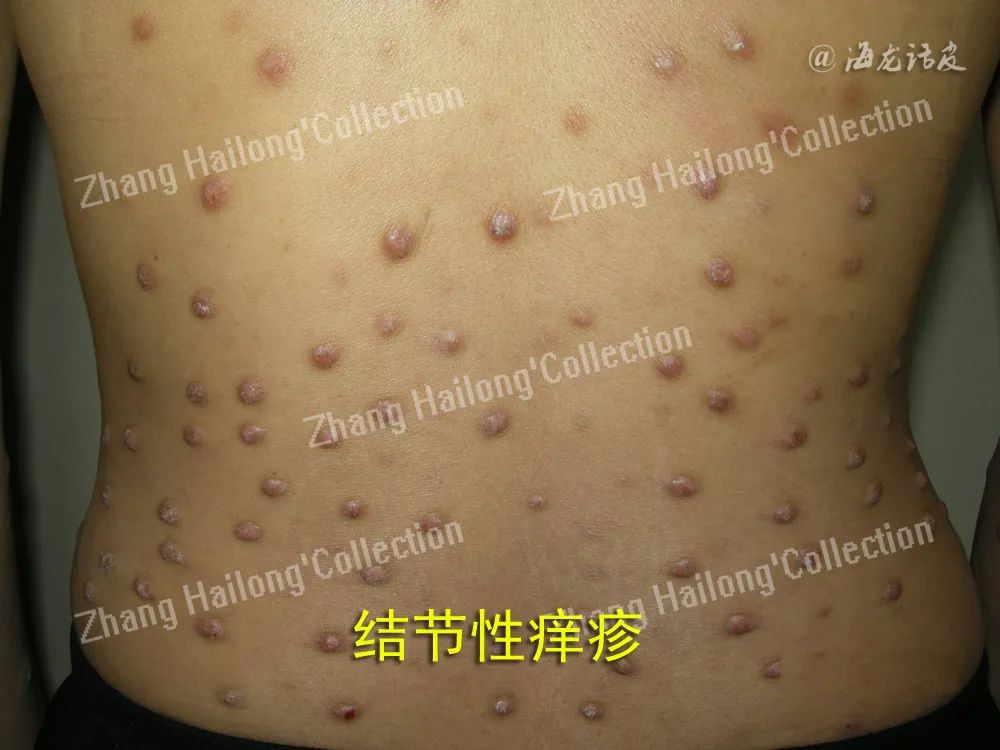
1、上皮细胞应激反应:
皮肤中的角质形成细胞(上皮细胞)、免疫细胞、感觉神经元均参与皮肤正常生理和炎症免疫过程。在PN患者表皮中可观察到表皮过度角化,假性上皮瘤样增生,不规则棘层肥厚及颗粒层肥厚等病理改变,提示角质形成细胞可能参与PN的发生与发展,但目前尚不清楚上述病理改变是原发性改变还是继发于瘙痒-搔抓的反应。反复的内源性或外源性的刺激诱发瘙痒-搔抓循环,使皮肤屏障遭到破坏且出现细胞损伤。受干燥、遗传缺陷和反复抓挠等影响,角质形成细胞释放多种危险信号和警报素,包括上皮源性细胞因子IL-1α、胸腺基质淋巴细胞生成素(thymic stromal lympho-poietin,TSLP)、IL-25、IL-33、组织蛋白酶等。
来源于上皮细胞的细胞因子可以直接或间接驱动上皮细胞应激反应,激活瘙痒感受器而引发瘙痒;以TSLP和IL-33的作用最为显著,作用于肥大细胞、2型固有淋巴细胞(group 2 innate lymphoid cells,ILC2)及Th2细胞,从而促进真皮的炎症反应。此外,炎症因子IL-17、IL-22及神经生长因子(nerve growth factor,NGF)等可能促进了角质形成细胞的增殖,p75NTR下调可能抑制角质形成细胞凋亡,一定程度上促进了PN中的的假性上皮瘤样增生、不规则棘层肥厚及颗粒层肥厚等病理改变。
表皮增生角化是PN的主要临床及病理特征。其发生与瘙痒搔抓的机械刺激反应和后述的真皮炎症刺激反应有关。这些刺激反应通过诱导多种炎症因子释放及其相关信号通路活化(如NGF上调促进角质形成细胞增殖,P75神经营养素受体下调抑制角质形成细胞凋亡),导致表皮细胞增殖和凋亡抑制,并表现出相应的病理表现。
2、真皮炎症反应:
T细胞、ILC2、肥大细胞、嗜酸性粒细胞等参与了PN的真皮炎症反应。ILC2和Th2细胞是IL-4、IL-13等2型炎症相关细胞因子的主要来源,通过促进嗜碱性粒细胞和嗜酸性粒细胞的募集、免疫球蛋白E(immunoglobulin E,IgE)同型转换等促进皮肤的炎症反应,IL-4、IL-13还能降低感觉神经元的瘙痒阈值,促进神经元对无害刺激的过度感受。Th2细胞产生的IL-31可在小鼠模型中诱发严重瘙痒,在具有特应性背景的PN患者皮肤活检显示IL-31mRNA的表达量比健康人皮肤增加了50倍。IL-31是调节PN的重要细胞因子和潜在治疗靶点。
除此之外,Th2细胞因子IL-4和IL-13通过刺激和激活转化生长因子β(transforming growth factor β,TGF-β)/SMAD信号传导通路而促进真皮纤维化。TGF-β/SMAD信号传导通路是促进细胞外基质(extracellular matrix,ECM)生成和组织重塑的主要途径,通过诱导α-平滑肌肌动蛋白(α-SMA)、I型胶原和基质金属蛋白酶组织抑制剂(tissue inhibitors of metalloproteinases,TIMPs)转录、促进胶原合成增加、抑制基质金属蛋白酶(matrix metalloproteinases,MMPs)活性等来诱导真皮纤维细胞活化。
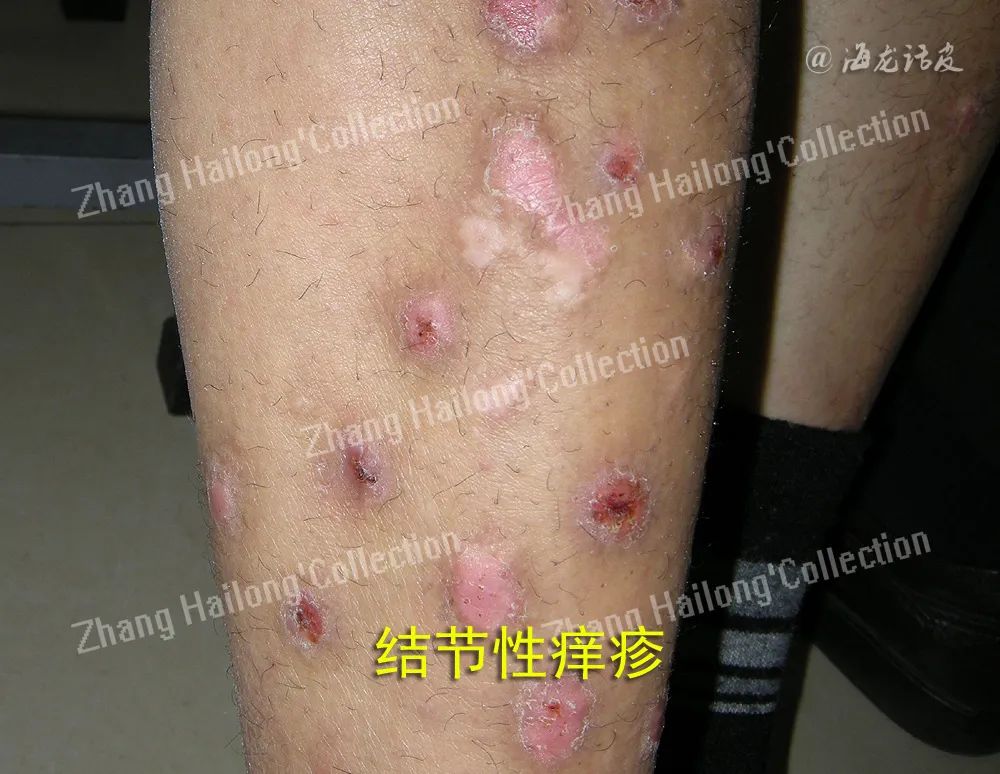
研究发现IL-17和IL-22mRNA在PN皮损处表达升高。IL-17为促炎细胞因子,主要由Th17细胞分泌,参与多种炎症反应及对抗细胞外细菌和真菌等免疫反应,诱导趋化因子分泌聚集中心粒细胞,通过正反馈环促进局部组织炎症。IL-17A以及多种细胞因子通过p38MAPK信号通路诱导角质形成细胞表达内皮素-1(endothelin-1,ET-1)等,参与炎症反应、细胞生长和细胞分化。IL-22在真皮炎症反应中辅助IL-17,通过激活角质形成细胞释放TNF-α和趋化因子,使免疫细胞到达局部组织而加重炎症。
PN的组织病理中可见淋巴细胞、肥大细胞、嗜酸性粒细胞等多种细胞的浸润,均参与PN的真皮炎症反应。PN的真皮炎症细胞中Th2细胞是IL-4、IL-13、IL-31等细胞因子的主要来源,可以诱导炎症反应和瘙痒;Th17细胞可以通过分泌IL-17和IL-22诱导局部炎症反应和细胞增殖。肥大细胞和嗜酸性粒细胞可通过释放组胺诱导瘙痒,并进一步通过类胰蛋白酶、前列腺素、NGF诱导和毒性的颗粒蛋白加重炎症反应过程。这些细胞及其产生的多种细胞因子和介质交互作用,促进了PN的病理组织形态及瘙痒症状的产生。
3、神经源性炎症和瘙痒的敏化:
表皮内和真皮神经纤维在PN的形成中起重要作用。PN 患者皮肤神经纤维密度发生改变,其中真皮神经纤维密度升高而表皮神经纤维密度下降。PN患者同时伴随NGF受体表达的升高。致痒信号分子可使感觉神经元慢性活化,介导皮肤神经源性炎症的多种神经肽增加。在失调的几种神经肽中,感觉神经末梢释放的P物质(substance p, SP)和降钙素基因相关肽(calcitonin gene related peptide,CGRP)与PN的发病有关。
SP是一种由感觉神经元分泌的神经递质,与皮肤和中枢神经系统中的神经激肽-1(neurokinin-1,NK-1)受体结合。皮肤中SP阳性神经纤维数量增加,SP表达量增加。SP能有效结合肥大细胞上神经激肽-1导致组胺释放,同时激活NF-κB通路,促进前列腺素E2、IL-1、TNF的产生和超氧离子释放,引发瘙痒、水肿和炎症;SP是通过使血管扩张、炎症细胞聚集、释放NGF等促进角质形成细胞的生长和分化。CGRP是另一种与SP机制相似的神经 肽,在PN中上调,可通过神经纤维分泌到皮肤组织中,通过调节嗜酸性粒细胞和肥大细胞引起神经源性炎症。CGRP还可影响内啡肽水平,导致μ和κ阿片受体表达失调,导致PN瘙痒。
长期的神经源性炎症使初级传入神经纤维(C-fibers)释放神经肽增加,从而增加了神经纤维的敏感性,而最终导致瘙痒发生。瘙痒有独立于疼痛的信号传导通路,通过瘙痒特异性受体胃泌素释放肽受体(gastrin-releasing peptide receptor,GRPR)来传递瘙痒信号。化学物质、机械刺激、温度变化、炎症因子、神经肽等瘙痒介质刺激外周瘙痒受体,促使瞬时受体电位(transient receptor potential,TRP)V1和A1等离子 通道开放,使神经元细胞膜去极化,引发动作电位并将瘙痒信号向脊髓和大脑传递而产生瘙痒。
PN真皮中IL-4 和IL-13等2型炎症因子能直接作用于感觉神经元,降低瘙痒阈值,增加感觉神经元对致痒因子的敏化性,使瘙痒感觉持续反复存在。PN患者的临床表现为剧烈瘙痒性的丘疹结节, 病理改变可见真皮神经纤维密度升高而表皮神经纤维密度下降,提示皮肤神经参与PN的发展。皮肤神经源性炎症介导神经肽释放SP和CGRP增加,使真皮血管扩张和炎细胞聚集。细胞因子IL-4和IL-13能直接作用于感觉神经元,降低瘙痒阈值,增加感觉神经元对致痒因子的敏化性,进而诱导瘙痒-搔抓循环持续加重。
三 治疗进展
目前,PN的治疗包括局部治疗、光疗、全身治疗以及新型疗法,最佳治疗方案应基于患者年龄、共病、疾病严重程度和治疗副作用情况而制定个性化治疗计划。
1、传统疗法:
局部治疗:
PN的一线局部治疗包括麻醉剂外用或皮损内注射及局部使用糖皮质激素。曲安奈德或复方倍他米松注射液皮损内注射可有效缓解瘙痒和缩小PN病变;麻醉剂皮损内注射,可以缓解轻度PN患者的瘙痒。另外,非处方的1%普拉莫辛洗剂、利多卡因喷雾剂和复合表面麻醉剂乳膏、其他非甾体外用药物也外用于PN的治疗。戊酸倍 他米松0.1%胶带有助于减轻PN患者的瘙痒和消减结节。
系统治疗:
PN患者有时需要系统治疗,尤其对局部治疗不耐受或效果不佳者。系统PN治疗的选择包括抗组胺药物、免疫抑制剂、抗癫痫类药物、神经激肽-1(NK-1)受体拮抗剂、沙利度胺、Mu阿片受体(Mu opioid receptor,MOR)拮抗剂等。虽然PN是一种非组胺介导为主的瘙痒,但第二代抗组胺药,如左西替利嗪、阿伐斯汀、依匹斯汀、奥洛他定、苯磺贝他斯汀等,除抗组胺作用外,还具有抗其他炎症因子的作用,是临床最常用的系统用药,但其治疗价值仍有待高质量的循证证据说明。包括甲氨蝶呤和环孢素在内的系统免疫抑制剂是治疗泛发顽固PN的常用药物。甲氨蝶呤对瘙痒症状缓解明显,但有一定的不良反应和副作用。
环孢素是钙调磷酸酶抑制剂的一种,通过抑制IL-2生成来抑制瘙痒。虽然这些药物对部分患者有效,但因为通常需要更高剂量来降低瘙痒强度,其镇静嗜睡不良反应明显,往往导致患者停止应用。另一类在针对瘙痒的神经发病机制方面显示出一定疗效的药物是NK-1受体拮抗剂,可通过阻断SP来减少瘙痒。该类药物中的代表—阿瑞匹坦 (aprepitant),已被FDA批准用于化疗相关的恶心和呕吐,应用于治疗慢性瘙痒症时,剂量可能因潜在疾病而异,一般处方为每天80mg。
沙利度胺是另一种神经活性药物,最先被美国FDA批准用于麻风结节性红斑,推荐剂量每天服用100~300mg,也可用于难治性PN患者。其作用机制主要是通过中枢神经系统镇静、拮 抗TNF-α及抑制神经生长因子等作用发挥止痒效果。然而,由于其已知的神经毒性和致畸作用,包括增加周围神经病变和出生缺陷的风险,因此临床需要极其谨慎地使用。
2、物理疗法:
紫外线疗法通过其抗炎作用,应用于包括PN在内的许多瘙痒性皮肤疾病。然而,PN作为一种难治性疾病,其治疗选择可能受到共病、药物与其他药物相互作用的限制。在可供选择的紫外光疗法中,每周2~3次的窄波紫外线B光疗(narrow band-ultraviolet B,NB-UVB)被认为是PN患者的一线疗法。紫外线A光疗(ultraviolet A,UVA)、补骨脂素加紫外线A光疗(psoralen-UVA,PUVA)和B波紫外线对PN均有一定疗效。
此外,改良的Goeckerman方案对缓解瘙痒有效。然而,由于Goeckerman方案包括每日宽波紫外线B光疗,然后每天在封闭条件下应用粗煤焦油和局部糖皮质皮质4h。因此,应谨慎使用,以尽量减少致癌不良反应。联合光疗法和局部治疗仅对少数PN患者有效。
3、新型靶向治疗:
PN瘙痒发病机制的新潜在靶点包括IL-31受体、IL-4受体α和肿瘤抑制素M(OSM)β受体。尼莫利珠单抗 (nemolizumab)是一种抗IL-31受体A的人源化抗体。度普利尤单抗(dupilumab)是IL-4 受体α的全人源单克隆抗体,已经被FDA批准用于治疗特 应性皮炎。鉴于其对IL-4Rα通路的特异性和对瘙痒特异性神经通路的抑制作用,度普利尤单抗也被用于PN治疗,并于2022年9月获FDA批准。OSMβ受体是另一个针对PN瘙痒的新靶点。作为一种类似于IL-6细胞因子家族的促炎症信号分子,OSM由活化的单核细胞、淋巴细胞、巨噬细胞,中性粒细胞产生,具有多种生物学活性,包括刺激纤维母细胞合成胶原。Vixarelimab是一种全人源单克隆抗体,以OSMβ受体为靶向,阻断OSM和IL-31两种与瘙痒、炎症和纤维化密切相关的细胞因子。
PN的治疗较困难,对于结节性皮损数量较少的患者,可以考虑局部外用超强效糖皮质激素或者病灶内注射糖皮质激素。对于广泛病变和顽固患者,通常首先考虑NBUVB联合外用皮质类固醇和口服抗组胺药,上述治疗无效的患者可考虑传统系统治疗包括免疫抑制剂、抗癫痫类药物、NK-1受体拮抗剂、MOR拮抗剂等,治疗过程中也需要注意药物的相关不良反应。新型靶向治疗通过阻断IL-31受体A、IL-4受体α和OSMβ受体等在PN发病中的关键靶点来缓解和控制PN患者的剧烈瘙痒症状,为临床上增加了治疗选择,为满足患者多样化和个性化的治疗提供可能。
四 小结
目前在PN的临床治疗中,局部治疗、光疗、系统治疗的应用均能获得一定的治疗效果,但仍然存在治疗效果不显著或不良反应较大等弊端。随着PN新兴疗法的问世,为PN患者带来新的曙光。临床医生了解PN的发病机制,掌握新的治疗方法,对于PN患者的临床诊断和治疗管理至关重要。
参考文献:
1. 张丽,夏立新,安倩等.结节性痒疹发病机制和治疗[J].中华临床免疫和变态反应杂志, 2023,17(2):162-168.
2.张寒梅,冯素英.结节性痒疹治疗进展[J].中国麻风皮肤病杂志,2019,35: 500-504
3.中国医师协会皮肤科分会变态反应性疾病专业委员会.慢性瘙痒管理指南 (2018版)[J].中华皮肤科杂志,2018,51: 481-485.
4.Pereira MP,Zeidler C,Wallengren J,et al. Chronic nodular prurigo: a European cross-pal study of patient perspectives on therapeutic goals and satisfaction[J].Acta Derm-Venereol,2020,101: 1-7.
5.Weigelt N,Metze D,Ständer S. Prurigo nodularis: systematic analysis of 58 histological criteria in 136 patients[J]. J Cutan.Pathol,2010,37: 578-586.


