好文推荐 | 面肌纤维颤搐的临床特点和A型肉毒毒素治疗
时间:2023-10-20 20:36:13 热度:37.1℃ 作者:网络
摘 要
目的 探讨面肌纤维颤搐(facial myokymia,FM)的临床特点,并观察A型肉毒毒素治疗该病症的疗效,以期对该罕见病症的治疗提供临床借鉴。方法 本文回顾性分析2018年3月-2023年3月于北京协和医院神经科运动障碍门诊就诊且诊断为面肌纤维颤搐或面肌蠕动的17例患者的临床资料,并随访A型肉毒毒素治疗疗效。结果 17例面肌纤维颤搐患者中女性12例,男性5例;平均起病年龄(31.4±9.3)岁,病程1.5个月~22年不等;17例均为单侧起病;3例面肌纤维颤搐分别与外伤、极度疲劳相关,余无明显诱因;首发症状部位为下眼睑,颞肌,咬肌;6例进展至同侧下面部肌肉,1例累及对侧下眼睑;6例伴疼痛;9例有功能影响;12例分别因寒冷、紧张、激动或强光刺激加重;1例头部MRI:右侧岛叶异常信号,考虑先天发育所致(灰质异位?),1例头部MRI:脑内多发缺血灶。7例病程中服用卡马西平、奥卡西平、苯妥英钠、巴氯芬及尼麦角林症状可缓解;4例无疗效;6例未用药;10例BTX-A注射治疗,平均起效时间(5±2.7)d,平均达最佳疗效(8.5±4.9)d,平均改善率(78.5±15.8)%,平均维持时间(7.1±2.9)月;患者注射BTX-A后焦虑情绪及疼痛均缓解;5例规律接受BTX-A注射治疗,平均维持时间(6.3±3.4)月,平均改善率(85±13.7)%。结论 面肌纤维颤搐为罕见病症,缺乏有效治疗共识,A型肉毒毒素注射是一种安全、有效的治疗方法,多种局灶性肌张力障碍的一线治疗手段,基于文献中少数病例报道以及我们的临床研究经验,推荐局部注射A型肉毒毒素对症治疗。
面肌纤维颤搐(facial myokymia,FM)又称面肌蠕动、面肌颤搐,是一种罕见的运动障碍表现。该病最早由Bernhardt于1902年首次提出,随后在1961年Oppenheim和1928年Kino报道的多发性硬化症患者中,发现面部肌肉持续性颤搐呈波浪状起伏,命名为面肌纤维颤搐,术语沿用至今。临床表现为面部肌纤维持续或发作性、不自主、波浪样起伏,涉及单个或多个面部肌肉,单侧面肌受累多见,“worm-like”蠕虫样表现生动描述该病特征。临床医生对该病症关注较少,且易与其他几种面部运动障碍,例如面肌痉挛、面瘫后面肌联带动作、面部抽搐、面部肌张力障碍相混淆,需注意鉴别。面肌纤维颤搐可影响尤其女性患者的社会交往和工作,时常处于焦虑状态,迫切希望缓解该局部症状,A型肉毒毒素(botulinum toxin A,BTX-A)已广泛用于局灶性运动障碍疾病治疗,症状改善显著。目前国内外对该病研究较少,本研究总结北京协和医院神经科运动障碍门诊17例FM患者的临床资料,并对10例注射A型肉毒毒素患者进行疗效评价,以提高医师对本病的认识和理解,并期望对治疗该病症提供借鉴。
1 资料与方法
1.1 研究对象
本文回顾2018年3月-2023年3月于北京协和医院神经科运动障碍门诊:临床检查中,患者异常面部运动呈重复和波浪起伏,运动障碍组专家评估后诊断为面肌纤维颤搐或面肌蠕动的17例患者。本研究为回顾性队列研究,并获得北京协和医院中心伦理委员会批准(批件号:JS-2211),所有患者均签署知情同意书。
1.2 研究方法
1.2.1 临床资料收集
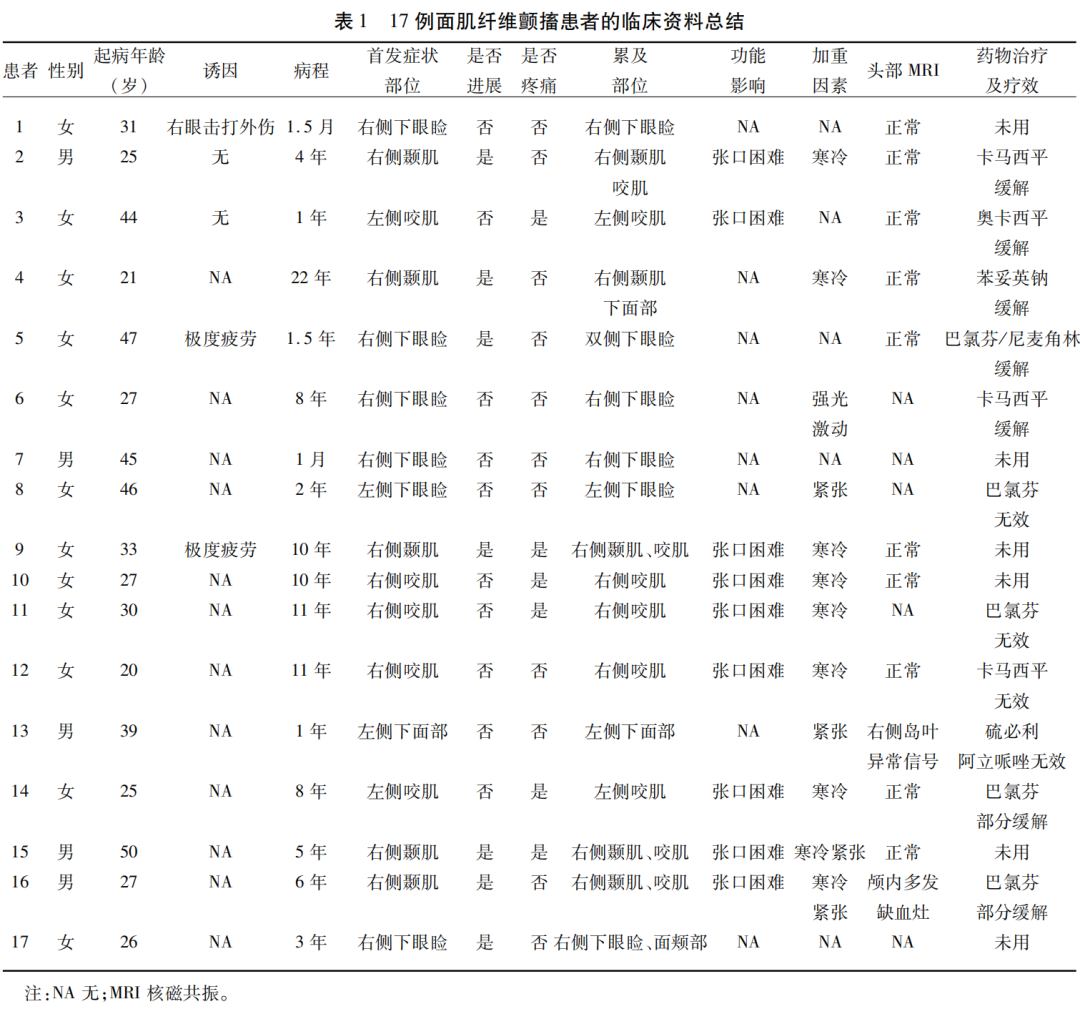
性别、起病年龄、病程、首发部位、诱因、是否进展,疼痛、累及部位、功能影响、加重因素、头部MRI、药物治疗及疗效(见表1)。
1.2.2 A型肉毒毒素治疗
美国BOTOX® 100 U/支或我国卫生部兰州生物制品研究所A型肉毒毒素(CBTX-A)100 U/支。注射部位和剂量遵循个体化治疗原则,根据病变累及部位、严重程度确定。徒手注射面部责任肌(眼轮匝肌、颞肌、颧大肌、翼内肌、翼外肌和咬肌等);一般治疗原则:1.25 U~5 U每点,单个靶肌肉总剂量10 U~50 U不等;症状复发再次注射,时间间隔应大于3个月;所有患者在A型肉毒毒素治疗前签署书面知情同意书。
1.2.3 肉毒毒素治疗随访与疗效评价
剂量、起效时间、高峰(达最佳疗效时间)、改善率、维持时间、疼痛/情绪、不良反应、注射次数/疗效;采用改良全球临床改善量表(GCI)患者自评:0=无效,1=轻度改善(10%~30%),2=中度改善(40%~60%),3=严重程度和功能显著改善(70%~100%),通过电话随访患者。
2 结果
2.1 一般资料
17例面肌纤维颤搐患者中女性12例,男性5例;平均起病年龄(31.4±9.3)岁,病程1.5个月~22年不等(见表1)。
2.2 临床特点
17例均为单侧起病,发作性症状,每次持续几十秒~数分钟,可自行缓解,一日内发作数十次;3例面肌纤维颤搐分别与外伤、极度疲劳相关,余无明显诱因;首发症状部位为下眼睑,颞肌,咬肌;6例进展至同侧下面部肌肉,1例累及对侧下眼睑;6例伴疼痛;9例有功能影响;12例分别因寒冷、紧张、激动或强光刺激可加重;1例头部MRI:右侧岛叶异常信号,考虑先天发育所致(灰质异位?),另1例头部MRI:脑内多发缺血灶(见表1)。
2.3 药物治疗
7例病程中服用卡马西平,奥卡西平,苯妥英钠,巴氯芬及尼麦角林症状可部分缓解;4例无疗效;6例未用药(见表1)。
2.4 BTX-A注射治疗随访
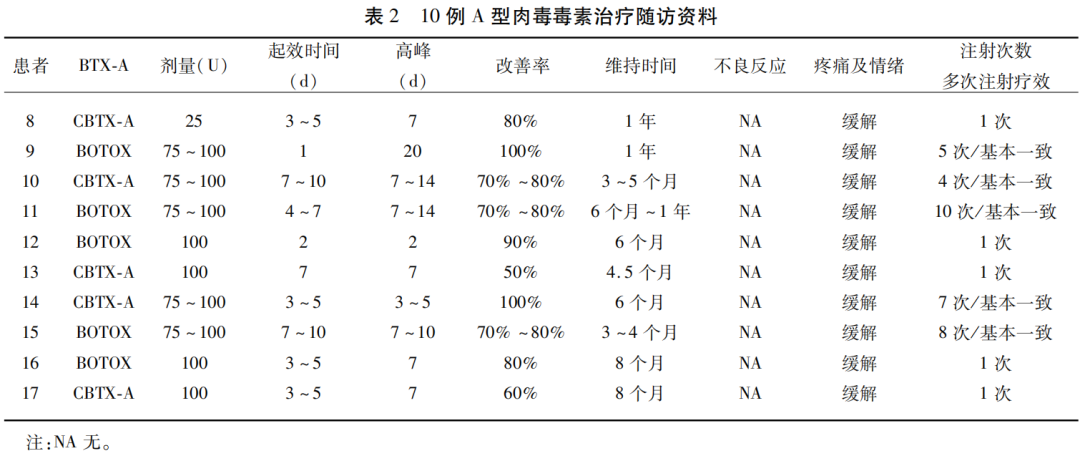
10例BTX-A治疗电话随访:注射BOTOX®或CBTX-A,单次注射剂量25 U~100 U不等,平均起效时间(5±2.7) d,平均达最佳疗效(8.5±4.9)d,平均改善率(78.5±15.8)%,平均维持时间(7.1±2.9)月;患者注射BTX-A后焦虑情绪及疼痛均缓解;5例规律接受BTX-A注射治疗,平均维持时间(6.3±3.4)月,平均报告症状改善(85±13.7)%,每次改善率大致相同,未产生BTX-A疗效减退的情况;无BTX-A注射不良反应(见表2)。
3 讨论
面肌纤维颤搐是一种罕见病症,特征为面肌纤维快速波浪状起伏似蠕动,目前尚未明确其病因和致病机制,无有关患病率和发病率的流行病学调查报道。既往病例报道表明,FM发作是其他病变的表现,如多发性硬化症、脑干占位、格林-巴利综合征、电压门控钾通道(VGKC) 自身抗体及ADCY5基因缺陷等。脑干颅神经运动核控制头面部肌肉运动,周围神经系统传导神经冲动,面神经核是面部肌肉运动重要控制中心,负责面部表情和运动的调节和协调。1974年Sethi等提出皮质脑干束病变累及脑干面神经核周围或面神经走行,导致面神经运动支传导阻滞可能是FM的发病机制。面神经支配眼睑肌纤维颤搐最常见,通常是自限性颤搐,病例报道与颅脑病变相关:4例多发性硬化,2例颅内脑肿瘤,1例三叉神经鞘瘤(眨眼反射通路)。三叉神经运动支支配的肌纤维颤搐既往报道与脑干肿瘤、三叉神经痛相关,2003年Mancias等报道1例12岁女孩,上呼吸道感染后出现异常下颌运动,EMG示左侧咬肌,颞肌肌颤搐,头部MRI无异常;2022年Arpan等首次报道了1例慢性炎性脱髓鞘性多发性神经根神经病(CIDP)伴系统性红斑狼疮(SLE)-Sjögren重叠综合征的24岁女性,双侧三叉神经运动支支配的咬肌和颞肌纤维颤搐。本研究报道10例三叉神经支配的咬肌和颞肌肌颤搐目前仅有单侧表现。影响颅神经核及颅神经走行的病变,可导致其支配的肌肉出现肌纤维颤搐,单个颅神经支配肌肉孤立出现或多个颅神经支配肌肉同时出现。本研究报道10例FM患者头部MRI虽未见脱髓鞘,占位等特异性征象,但不能完全排除颅神经核的核上性去神经支配,或是否与其走行神经纤维病变相关。与以往的研究结论一致,女性和寒冷是面肌纤维颤搐的易感和加重因素,寒冷刺激会引起神经兴奋性的改变,导致神经肌肉传递过程中的神经冲动出现紊乱,此外,寒冷刺激还会引起肌肉和血管收缩,从而影响面部肌肉的正常运动。紧张也可引起神经兴奋性的改变,导致面部肌肉过度收缩,加重面部运动障碍的症状。目前尚不清楚女性易感原因,一项心因性面部运动障碍研究结果表明,91.8%为女性患者,考虑女性可能更容易受到精神压力和情绪波动的影响,导致神经肌肉系统的功能紊乱。
2018年Collazo等回顾1996年-2015年梅奥诊所确诊为多发性硬化出现FM 28例患者,未描述面肌颤搐部位,研究结果表明经皮质类固醇、卡马西平、巴氯芬治疗症状可得到缓解,本研究7例服用卡马西平、奥卡西平、苯妥英钠、巴氯芬/尼麦角林症状缓解。2000年Sedano等报告了 2 例多发性硬化伴单侧持续性FM 1个月,在接受BTX-A注射后症状完全消失。2012年Habek等报告1例多发性硬化合并FM女性患者经甲泼尼松龙静脉注射治疗无效,后分别在上下眼睑、脸颊、下颌各注射2.5 U BTX,症状在10 d内完全缓解。本研究10例患者4例因担心药物治疗可能产生的副作用,未使用药物治疗,4例服用马卡西平、巴氯芬、硫必利及阿立哌唑无明显疗效,2例服用巴氯芬部分缓解,选择BXT-A局部注射治疗,1.25 U或5 U每点,下眼睑、颧大肌、颞肌、咬肌以及下面部其它肌肉,根据症状累及肌肉单次注射25 U~100 U不等,报告10例症状均有改善,平均起效时间(5±2.7)d,平均达最佳疗效(8.5±4.9)d,平均改善率(78.5±15.8)%,平均维持时间(7.1±2.9)月,7例张口困难完全消失,5例疼痛症状缓解。BTX-A已成功用于治疗各种局灶性肌张力障碍,疗效显著、副作用少,以往病例报道及本研究结果均显示对BTX-A注射的良好疗效。在FM的治疗中,BTX-A通过作用于神经肌肉接头处,抑制乙酰胆碱的释放,阻断神经肌肉传导,松弛肌肉,从而达到减轻或消除面部肌肉运动障碍的效果,治疗剂量通常不会影响远隔肌肉的功能。BTX-A 的镇痛作用在1985 年Tsui等对治疗颈肌张力障碍的研究中首次报道,最初仅认为疼痛缓解与肌肉过度收缩或颤搐症状改善相关,随后大量的临床及实验研究充分揭示BTX-A可通过抑制外周神经递质或炎症介质的释放缓解疼痛。BTX-A作用可逆,一旦BTX-A被完全代谢,疗效也会随即消退。因此,BTX-A注射通常需要重复进行,本研究5例患者多次BTX-A注射治疗,平均维持时间(6.3±3.4)月,平均报告症状改善(85±13.7)%,每次改善率大致相同;最长病程11年,反复注射达10次,尚未出现BTX-A疗效下降及失效的情况。与以往报道一致,本研究BTX-A治疗10例患者焦虑抑郁情绪得到改善,BTX-A改善情绪的机制目前尚不清楚,研究者提出一些假说和可能的机制,一方面认为可以通过减少面部肌肉张力,缓解患者的面部症状、身体紧张感和疼痛感,减少社交尴尬,从而减轻焦虑抑郁症状;另一方面认为BTX-A使面部肌肉松弛,从而减少三叉神经对脑干和杏仁核的感觉输入。BTX-A显著改善各种局灶性面部运动功能障碍,是一种安全有效的治疗方法,应始终予以考虑,尤其是当FM持续存在且患者无法耐受皮质类固醇、卡马西平及巴氯芬等药物治疗时。BTX-A靶肌肉注射,因维持效果各不相同,根据临床实际情况重复注射,间隔周期至少3个月。本研究局限性在于样本量较少,未深究病因学相关证据;缺少单次注射节点对规律注射BTX-A患者进行整体评估,其结论存在一定偏差。
由于文献中很少报道FM,因此缺乏治疗共识,肉毒毒素注射是一种安全、有效的治疗方法,是多种局灶性肌张力障碍的一线治疗手段,基于文献中少数病例报道以及我们的临床研究经验,推荐使用A型肉毒毒素进行局部注射治疗。如有明确病因,一方面应积极治疗原发病,另一方面可通过注射肉毒毒素治疗缓解FM局部症状,减轻患者心理负担,改善抑郁、焦虑情绪。此外,除药物治疗以及肉毒毒素注射治疗,尚未见文献报道关于FM确切手术治疗的证据,提示临床医师应注意与如面肌痉挛等其他面部运动障碍类型相鉴别,以期做好最佳临床决策。
参考文献
[1]Gutmann L. AAEM minimonograph #37:facial and limb myokymia[J]. Muscle Nerve,1991,14(11):1043-1049.
[2]Oppenheim H. Neue beitrage zur klinik der multiplen sklerose[J]. Jahresber Neurol Psychiatr,1916,20:14-18.
[3]Kino F. Muskelwogen(myokymie) als Frühsymptom der multiplen sklerose[J]. Dtsch Z Für Nervenheilkunde,1928,104(1-2):31-41.
[4]Swinnen BEKS,Koelman JHTM,van Rootselaar AF. Post-irradiation facial neuromyotonia/myokymia:a hemifacial spasm mimic[J]. Tremor Other Hyperkinet Mov,2021,11:36.
[5]Kollewe K,Mohammadi B,Dengler R,et al. Hemifacial spasm and reinnervation synkinesias:long-term treatment with either botox or dysport[J]. J Neural Transm,2010,117(6):759-763.
[6]Radü EW,Skorpil V,Kaeser HE. Facial myokymia[J]. Eur Neurol,1975,13(6):499-512.
[7]Andermann F,Cosgrove JBR,Lloyd-Smith DL,et al. Facial myokymia in multiple sclerosis[J]. Brain,1961,84(1):31-44.
[8]Gutmann L,Tellers JG,Vernino S. Persistent facial myokymia associated with K(+) channel antibodies[J]. Neurology,2001,57(9):1707-1708.
[9]Fernandez M,Raskind W,Wolff J,et al. Familial dyskinesia and facial myokymia(FDFM):a novel movement disorder[J]. Ann Neurol,2001,49(4):486-492.
[10]Chen YZ,Friedman JR,Chen DH,et al. Gain-of-functionADCY5 mutations in familial dyskinesia with facial myokymia[J]. Ann Neurol,2014,75(4):542-549.
[11]Chen YZ,Matsushita MM,Robertson P,et al. Autosomal dominant familial dyskinesia and facial myokymia:single exome sequencing identifies a mutation in adenylyl cyclase 5[J]. Arch Neurol,2012,69(5):630-635.
[12]Sethi PK,Smith Bernard H,Kalyanaraman K. Facial myokymia:a clinicopathological study[J]. J Neurol Neurosurg Psychiatry,1974,37(6):745-749.
[13]Jacobs L,Kaba S,Pullicino P. The lesion causing continuous facial myokymia in multiple sclerosis[J]. Arch Neurol,1994,51(11):1115-1119.
[14]Blunt SB,Khalil NM,Perkin GD. Facial myokymia in multiple system atrophy[J]. Mov Disord,1997,12(2):235-238.
[15]Barmettler A,Dinkin MJ,Lelli GJ. Eyelid myokymia:not always benign[J]. Orbit,2011,30(6):289-290.
[16]Kitaguchi Y,Sabundayo MS,Kakizaki H. Eyelid myokymia with concomitant cerebral tumour:a case report[J]. Neuro-Ophthalmology,2018,42(3):150-152.
[17]Ito E,Sugita R,Saito R. Eyelid myokymia caused by a trigeminal schwannoma as determined by the trigeminal-evoked blink reflex[J]. Clin Case Rep,2023,11(3):e7086.
[18]Kaeser HE,Skorpil V. Myokymia involving the muscles innervated by the Vth,VIth,VIIth,IXth,Xth,XIth and XIIth cranial nerves with brain stem tumor[J]. Eur Neurol,1976,14(6):408-412.
[19]Mancias P,Butler IJ. Trigeminal myokymia in a young girl[J]. J Child Neurol,2003,18(8):572-574.
[20]Dutta A,Gupta S,Ray BK. Bilateral trigeminal myokymia in chronic inflammatory demyelinating polyneuropathy with systemic lupus erythematosus-sj gren overlap syndrome[J]. JAMA Neurol,2022,79(1):80-81.
[21]Chardoub A,Patel BC. Eyelid Myokymia[M]. StatPearls Publishing LLC,2022.
[22]Castellani JW,Tipton MJ. Cold stress effects on exposure tolerance and exercise performance[J]. Compr Physiol,2015,6(1):443-469.
[23]Fasano A,Valadas A,Bhatia KP,et al. Psychogenic facial movement disorders:clinical features and associated conditions[J]. Mov Disord,2012,27(12):1544-1551.
[24]Marin Collazo IV,Tobin WO. Facial myokymia and hemifacial spasm in multiple sclerosis[J]. Neurol,2018,23(1):1-6.
[25]Sedano MJ,Trejo JM,Macarrón JL,et al. Continuous facial myokymia in multiple sclerosis:treatment with botulinum toxin[J]. Eur Neurol,2000,43(3):137-140.
[26]Habek M,Adamec I,Gabeli T,et al. Treatment of facial myokymia in multiple sclerosis with botulinum toxin[J]. Acta Neurol Belg,2012,112(4):423-424.
[27]Pirazzini M,Rossetto O,Eleopra R,et al. Botulinum neurotoxins:biology,pharmacology,and toxicology[J]. Pharmacol Rev,2017,69(2):200-235.
[28]Tsui JK,Eisen A,Mak E,et al. A pilot study on the use of botulinum toxin in spasmodic torticollis[J]. Can J Neurol Sci,1985,12(4):314-316.
[29]Matak I,Lackovi Z. Botulinum toxin A,brain and pain[J]. Prog Neurobiol,2014,119-120:39-59.
[30]Wollmer MA,Magid M,Kruger THC,et al. Treatment of depression with botulinum toxin[J]. Toxins,2022,14(6):383.



