Sci Adv:DNA纳米球+电阻抗检测,新型核酸检测方法实现多种临床病原体的快速分析
时间:2023-10-31 14:30:43 热度:37.1℃ 作者:网络
快速准确地检测核酸是病原体鉴定的关键。近几年的SARS-CoV-2大流行促进了针对病毒核酸或蛋白质诊断方法的复兴。其中,基于核酸的方法通常更容易开发,具有更高的灵敏度和固有的灵活性。逆转录定量聚合酶链式反应(RT-qPCR)是核酸检测的金标准,已被广泛应用于诊断新型冠状病毒。此外,为了补充RT-qPCR,研究人员已经开发了几种其他基于核酸的方法,例如环介导等温扩增(LAMP)。LAMP后的DNA检测可以通过多种策略实现,包括凝胶电泳和荧光和比色法,但这些方法的应用仍有不足,例如易产生假阳性。
通过检测阻抗变化对DNA扩增进行电化学检测是荧光和比色技术的无标记替代方法。研究人员已经在微流控芯片中使用基于阻抗的检测成功定量了不同浓度和长度的DNA,但无法区分不同的DNA或RNA靶序列。此外,这种方法需要使用微珠,增加了成本和复杂性。因此,需要一种基于无标签阻抗的新检测方法,可利用基于电检测的许多优点(例如快速、准确、便宜、可扩展等)来检测特定的目标序列。
近日,美国斯坦福大学的研究人员在Science Advances上发表文章,提出了一种结合one-pot等温生成DNA纳米球和电阻抗检测的新方法。研究团队通过改进RT-LAMP反应,使扩增的DNA自组装成纳米球,可以利用电阻抗变化来检测,而不需要微珠。在简单的微流体通道中,自组装DNA纳米球经过两个检测电极的驱动流动在阻抗信号中产生量化的尖峰。为了证明该方法的适用性,研究团队将其应用于SARS-CoV-2的检测,检测到的尖峰数量与扩增DNA数量相对应。此外,该方法还可用于多种DNA和RNA致病序列的检测,包括HIV、流感、结核分枝杆菌和β-内酰胺酶。

01 自组装DNA纳米球的阻抗检测
为了简化基于阻抗的DNA检测,研究团队首先必须开发一种能够在one-pot扩增反应中生成DNA纳米球的分子方法,并且不需要外部成核剂。受滚环扩增(RCA)方法的启发,研究团队改进了LAMP反应,使扩增的DNA自核成纳米球。在标准LAMP放大过程中,会产生一系列不同长度的串联产物。研究团队认为,可以使用与扩增子中共同区域互补的寡核苷酸将它们“钉”在一起(压缩寡核苷酸),形成DNA纳米球。此外,这些低聚物可能已经存在于LAMP反应中,从而使DNA纳米球的产生与等温DNA扩增平行(图1)。总的来说,对于给定的目标序列,one-pot扩增反应包含标准的六个目标特异性LAMP引物和两个额外的压实寡核苷酸。将该方法应用于SARS-CoV-2 RNA的检测,能够生成自组装紧凑的DNA纳米球,直径从1到2μm,并可以在荧光显微镜下观察到(图1B、C)。同时,研究团队通过微流控装置中的阻抗检测检测率了这些DNA纳米球(图1D、E)。
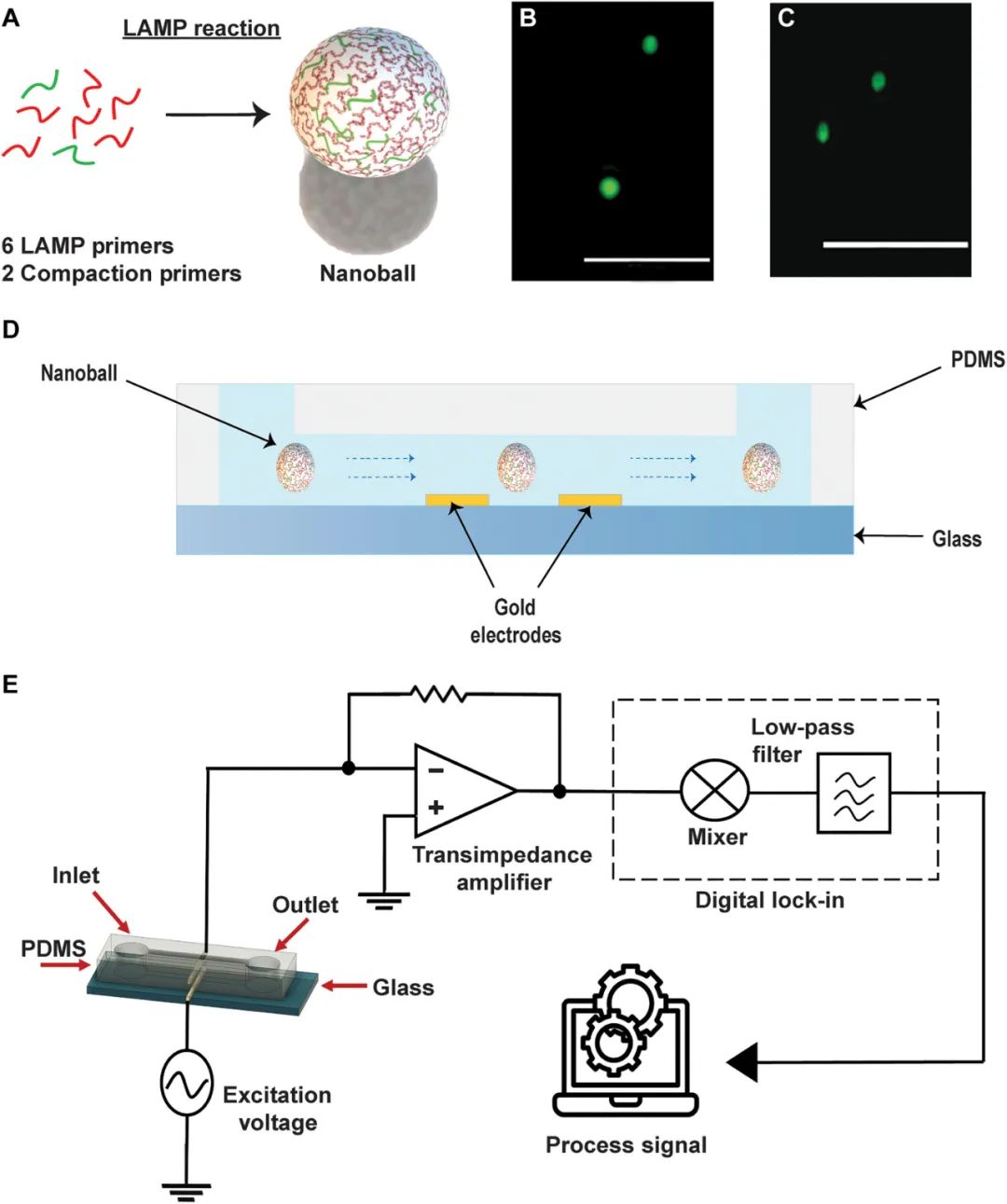
图1.DNA纳米球的阻抗检测。
最初的RT-LAMP压缩实验显示形成了许多不同的规则球状结构,其大小与1μm珠相当(图1C)。研究团队分析了相对于LF和LB引物不同的压实寡核苷酸浓度(压缩寡聚物与扩增寡聚物的比例为1∶1或9∶1)。结果显示,使用更高比例的压紧寡聚物(9:1)产生了更高的平均检测DNA纳米球数(10分钟内>100)(图2B),因此,后续试验采用了这一比例。
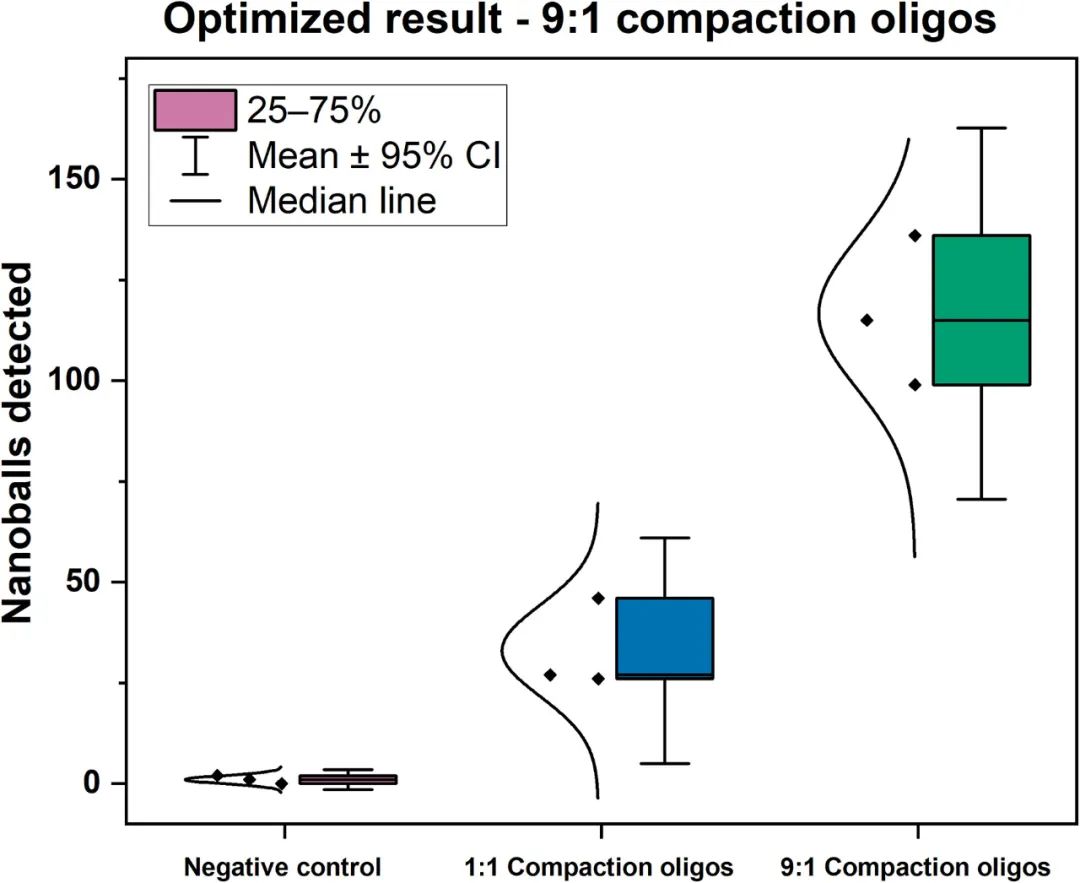
图2.压缩寡聚物所需比例的优化。
02 DNA纳米球阻抗检测的检测极限
经过DNA纳米球阻抗检测的优化,研究团队探索了该方法的检出限(LOD)。研究人员以合成RNA为模板,在RT-LAMP压缩反应中进行了稀释系列实验,使用阻抗微流体系统检测纳米球持续10分钟(图3)。数据显示,即使是最低浓度的合成RNA(10拷贝RNA)也很容易与阴性对照区分开。研究人员还分析了缩短电检测时间对LOD的影响。在不同的时间间隔(5分钟、3分钟、60秒和30秒),该研究团队使用优化的配置(压缩寡核苷酸,两次重复,比例为9:1)分析了10分钟检测的数据,发现即使在30秒,检测到的纳米球数量分布与初始合成RNA的浓度密切相关,并且在阴性对照组之间表现出统计学上的显著差异。
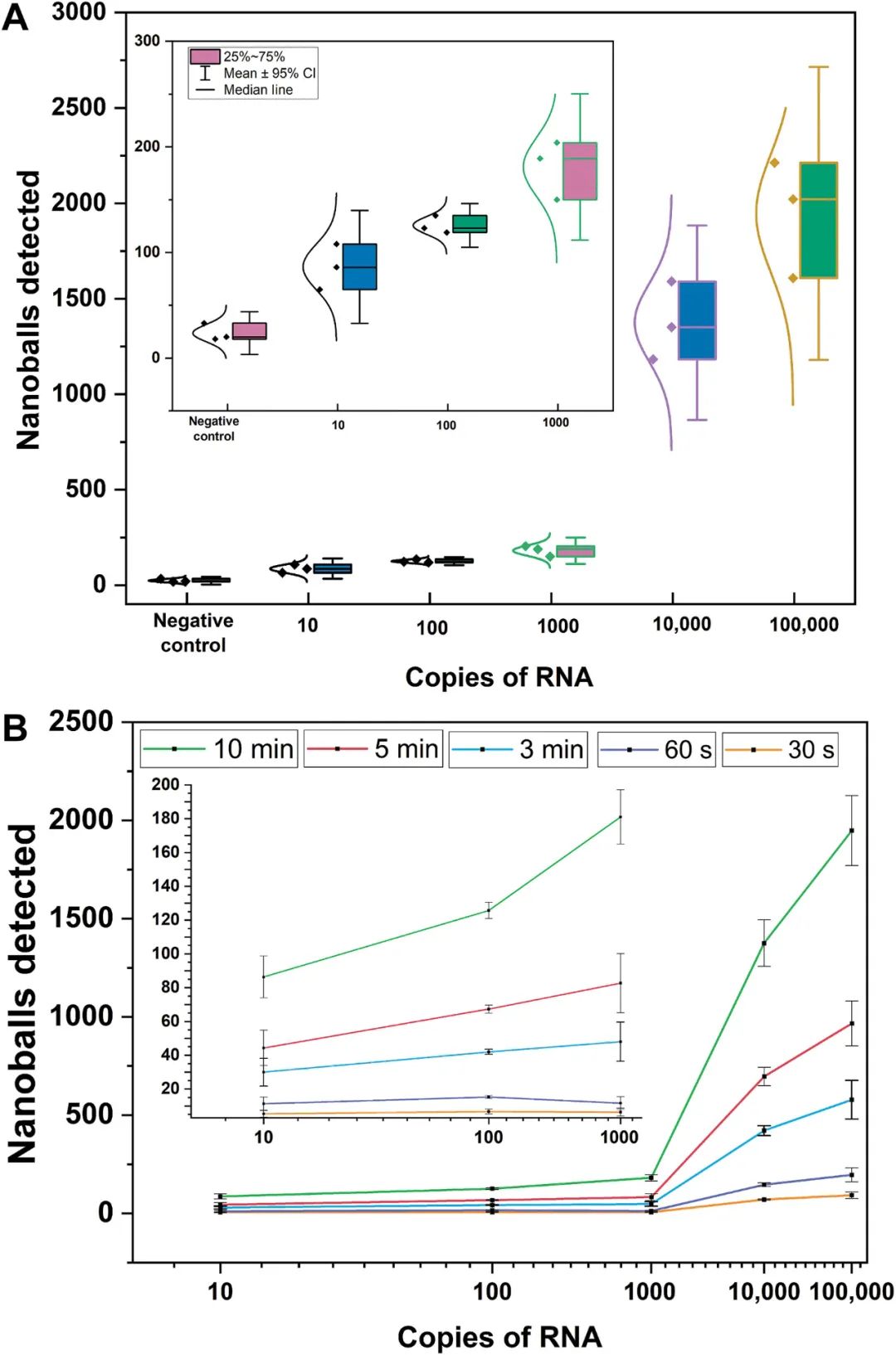
图3.检测限分析。
03 三重压缩寡核苷酸提高检测能力
为了进一步提高系统的DNA检测能力,研究人员推测,通过增加DNA纳米球的大小或改变其电特性可能会增加信噪比,从而提高检测能力。为了增加DNA纳米球的大小,研究团队推测在压缩寡核苷酸中添加一个额外的共同序列拷贝,可能会增强LAMP扩增子压缩和形成纳米球的能力。最终,研究团队以标准9:1比例进行三重压缩寡核苷酸,大大增加了检测到的平均DNA纳米球数量,将使用两重压缩寡核苷酸的约2000个增加到近3000个(图4)。
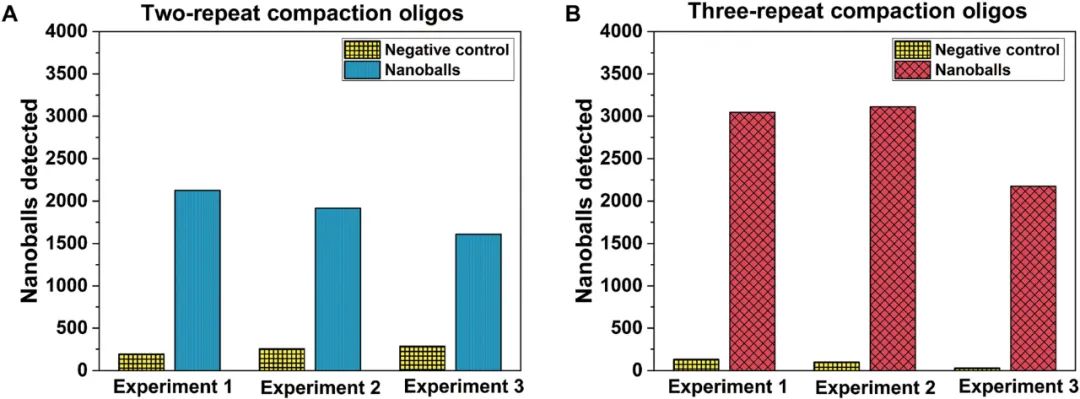
图4.DNA纳米球检测实验方案的优化。
04 临床样本新冠病毒检测
为了验证该方法的适用性,研究团队将其应用于临床诊断的上呼吸道拭子样本中的SARS-COV-2检测。研究团队使用RT-PCR临床诊断为COVID-19的热灭活上呼吸道样本剩余等分(29份)和阴性样本,随机选择了5个不同病毒载量的样本,通过RT-qPCR检测:低病毒载量(Ct 26-27),中病毒载量(Ct 22-24)和高病毒载量(Ct 17-20)。此外,还分析了5份经临床RT-qPCR检测为COVID-19阴性的样本。结果显示该方法在Ct值(27到17)范围内检测到1000到2000个DNA纳米球,证明了基于阻抗的检测在非提取的热灭活样本中检测临床相关病毒水平的能力,并且样本中的病毒载量与检测到的DNA纳米球数量之间存在很强的关系。(图4)

图5.检测COVID-19患者临床样本和多个病原体序列。
此外,研究团队设计了针对目标区域的三重压缩寡核苷酸,用于诊断对公共卫生构成威胁的病原体,包括结核分枝杆菌、艾滋病毒、甲型流感/H1N1病毒等,成功检测到DNA纳米球,所有目标显示检测到接近1000个峰,与阴性对照显著不同,证明了将任何LAMP反应与基于阻抗的检测相结合的“LAMP压缩”策略相适应的便利性。
综上所述,该研究团队开发了一种简化的one-pot等温扩增核酸,可以通过廉价和简单的电检测系统检测扩增产生的DNA纳米球。研究团队展示了多种DNA和RNA致病序列的检测,包括HIV、流感、结核分枝杆菌和β-内酰胺酶等多种病毒和细菌,为一种新的、简单的基于阻抗的多病原体POC核酸检测系统铺平了道路。
参考资料:
MUHAMMAD TAYYAB, DONAL BARRETT, GIJS VAN RIEL, et al. Digital assay for rapid electronic quantification of clinical pathogens using DNA nanoballs. SCIENCE ADVANCES, 2023. DOI: 10.1126/sciadv.adi4997
https://doi.org/10.1126/sciadv.adi4997


