南开大学齐迹、孔德领《自然·通讯》:集成NIR-II光声成像的聚合物纳米平台,协同治疗血栓!
时间:2023-10-31 14:43:59 热度:37.1℃ 作者:网络
血管中闭塞血栓的形成是许多危及生命的心血管疾病的罪魁祸首,这些疾病是全世界发病和死亡的主要原因。在此,南开大学齐迹&孔德领/中国医学科学院生物医学工程研究所李稳开发了一种聚合物纳米平台,集成了基于长波第二近红外(NIR-II)光声成像的血栓检测和抗血栓活性。设计并合成了一种在NIR-II区域具有强吸收和分子运动的半导体均聚物,可增强光热转换和光声信号。该研究用热敏一氧化氮供体掺杂均聚物来配制纳米平台,在该纳米平台上对纤维蛋白特异性配体进行功能化以确保选择性血栓靶向。结果发现,NIR-II光声纳米探针具有强大的NIR-II光捕获能力、明亮的光声信号和活跃的血栓积累能力,能够灵敏地、选择性地描绘血栓。此外,通过整合血栓局部光热效应和按需一氧化氮释放,纳米平台在NIR-II光触发下的颈动脉血栓形成模型和下肢动脉血栓形成模型中还表现出快速有效的血凝块清除活性,几乎完全恢复血流。该纳米平台为诊断和治疗由各种血栓性疾病引起的危及生命的疾病提供了一种多功能方法。该研究以题为“Near-infrared-II photoacoustic imaging and photo-triggered synergistic treatment of thrombosis via fibrin-specific homopolymer nanoparticles”的论文发表在《Nature Communications》上。

该研究开发了一种治疗诊断纳米平台,该平台集成了基于长波NIR-II PA成像的敏感血栓诊断和出色的抗血栓活性(图1)。设计并合成了一种具有扭曲主链结构的半导体均聚物,它具有优异的NIR-II光捕获能力和剧烈的分子运动,有助于提高光热转换和PA信号。该聚合物被配制成纳米颗粒(NPs),其上纤维蛋白特异性肽被功能化以确保选择性血栓靶向。强大的NIR-II吸收和卓越的光热转换能力可以放大PA诊断信号以进行高灵敏度的血栓检测和监测,并诱导局部热疗以非侵入性溶解纤维蛋白凝块。此外,将热敏NO供体N,N'-二仲丁基-N,N'-二亚硝基-1,4-苯二胺(BNN6)加载到聚合物基质中,可以触发NO的原位生成由NIR-II光照射引起的高温。血栓局部光热效应和受控NO释放的结合不仅发挥了有效的溶栓特性,而且还促进NPs深入渗透到血栓中,从而提高抗血栓效果。同时,NO还可以通过抑制血小板活化和聚集来防止血栓复发。纳米探针不仅在阻塞血管中显示高对比度的NIR-II PA信号,而且还显着加速颈动脉血栓形成模型和下肢动脉血栓形成模型中的血栓根除,与游离抗血栓药物相比,显着改善治疗效果。该纳米平台具有良好的体内生物安全性,出血并发症的风险较低,并且没有可检测到的血管损伤。

图1|纤维蛋白特异性纳米探针用于NIR-II PA成像和光触发协同治疗血栓形成的示意图
【PTIIG的设计、合成和表征】
在此,该研究通过合理的分子设计开发了高性能NIR-II聚合物PA探针。给电子单元和吸电子单元交替共轭生成共聚物的供体-受体(D-A)方法代表了一种广泛使用的调节半导体聚合物(SP)带隙和实现NIR-II吸收的策略。然而,D-A共聚物中D和A部分的静电引力通常会导致强烈的分子间相互作用,从而严重限制分子在聚集状态下的运动。由于分子运动在放大PA信号中起着重要作用,由一个结构单元组成的均聚物将是一种替代选择,因为它们可以有效地避免由于电子排斥效应而导致的分子间相互作用。在这项工作中,设计并合成了一种具有强NIR-II吸收和剧烈分子运动的超小带隙半导体均聚物。二溴噻吩异靛蓝(TIIG)单体通过Stille交叉偶联反应与六甲基二锡聚合,形成PTIIG均聚物。PTIIG表现出良好的加工性能,因为它可以很容易地溶解在四氢呋喃、氯仿和甲苯等常见溶剂中。此外,PTIIG是一种高吸光性的NIR-II聚合物,在PA和光热应用中具有巨大的潜力。还发现SP NPs的激发态能量主要集中在热失活过程中,有利于光热和PA应用。在确认了SP NPs优异的NIR-II光捕获能力和光热效应后,该研究试图构建一个负载NO供体的纳米平台,用于同时进行血栓成像和治疗。制备了BNN6,一种温度敏感的NO供体,并将其掺杂到PTIIG 基质中形成B@SP NPs,预计可以从中按需释放NO由NIR-II光引起的局部温升触发。为了赋予NPs血栓归巢能力,将纤维蛋白特异性肽Cys-Arg-Glu-Lys-Ala (CREKA)与DSPE-PEG2000-Mal缀合以获得DSPEPEG2000-CREKA,其通过将疏水性DSPE部分插入聚合物基质中,进一步装饰到NPs上,制备了B@SP-C NPs。在B@SP–C NPs的制造之后,研究了NIR-II光触发的NO释放行为。结果表明,NIR II光激活纳米系统可以实现时空控制的NO输送,这可能会大大提高NO气体介导的溶栓的安全性和效率。
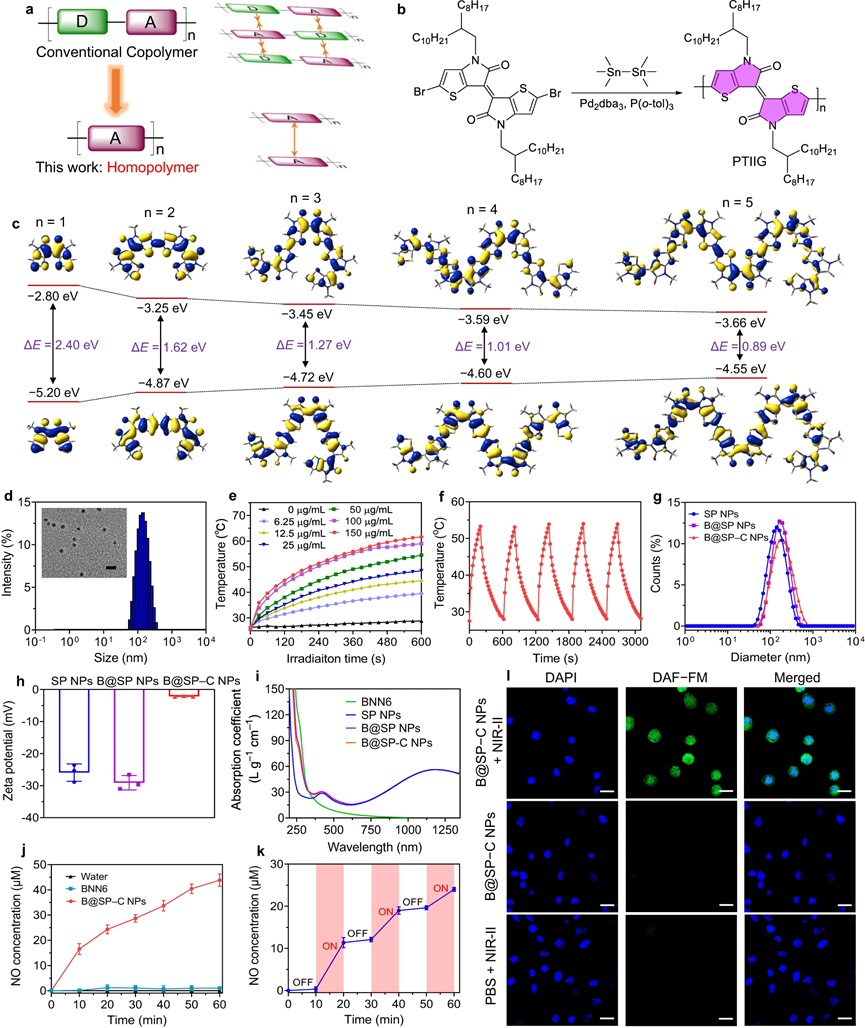
图2| PTIIG聚合物和NPs的表征
【光触发NO释放和PA特性】
随后,探索了B@SP–C NPs在血栓治疗诊断方面的潜力。结果表明,B@SP−C NPs不仅可以实现高灵敏度的PA成像,而且具有良好的稳定性,适合长期PA诊断。
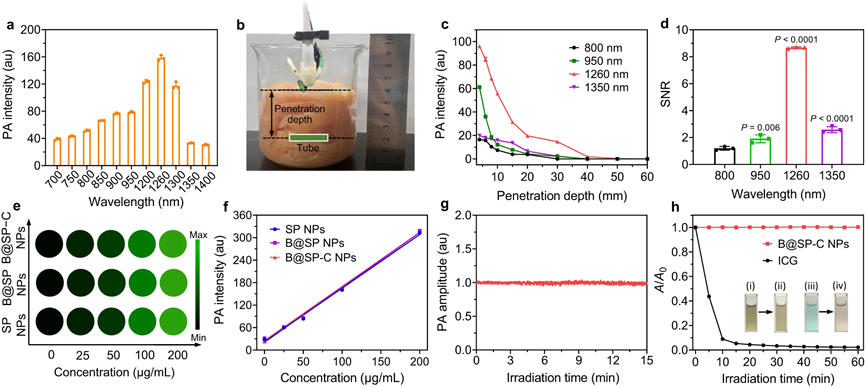
图3|体外PA特性的研究
【体外血栓靶向和溶栓能力】
受B@SP−C NPs优异的光热性能和受控NO释放行为的启发,该研究进一步探索了其溶栓能力。首先,证明了其具有良好的血液相容性。为了开始溶栓测试,在离体血凝块中检查了 B@SP−C NPs对血栓的靶向特异性。通过将新鲜小鼠血液与凝血酶混合来制备人造血凝块,验证了光热对血栓溶解的作用。值得注意的是,B@SP−C NPs+NIR-II光组也表现出远强于临床溶栓药物UK的溶栓能力。强效溶栓作用,使血凝块逐步降解成许多小块。
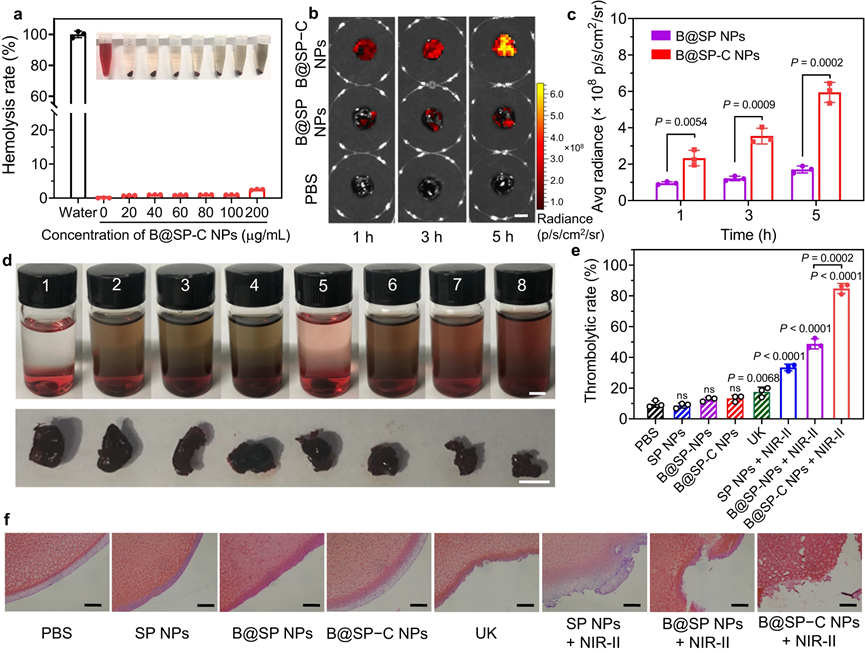
图4|体外血栓靶向和溶栓能力
【血栓的体内靶向和NIR-II PA成像】
然后,该研究测试了B@SP−C NPs在活体小鼠中用于血栓治疗诊断的可行性。治疗药物的全身循环时间对治疗结果有显着影响,特别是对于位于血管的病变。特别是,我们期望PEG化和CREKA肽修饰不仅可以延长NPs在血液中的循环时间,而且可以促进NPs的血栓特异性积累。为了证实我们的假设,研究了不同纳米颗粒制剂的体内循环曲线。发现B@SP−C NPs的延长循环特性可归因于PEG化良好的胶体稳定性和隐形效应,这将使NPs在血栓部位更容易积聚并维持治疗效果。大多数B@SP−C NPs在静脉注射后48小时从血液中清除,还发现B@SP−C NPs在7天后可以通过胆道途径几乎完全从小鼠体内排出。
为了弄清楚B@SP−C NPs卓越的血栓靶向能力背后的机制,在注射 B@SP−C NPs前5分钟给予游离CREKA,以占据纤维蛋白结合位点,从而在血栓中发现荧光信号显着减少,表明 B@SP−C NPs与血栓的结合是通过靶向纤维蛋白的CREKA配体介导的。此外,对于未受伤的对照颈动脉,注射B@SP−C NPs只产生非常弱的背景荧光,并且信号随着时间的推移而减弱,因为B@SP−C NPs与未受伤的血管几乎没有亲和力并因此很快从血液中清除。
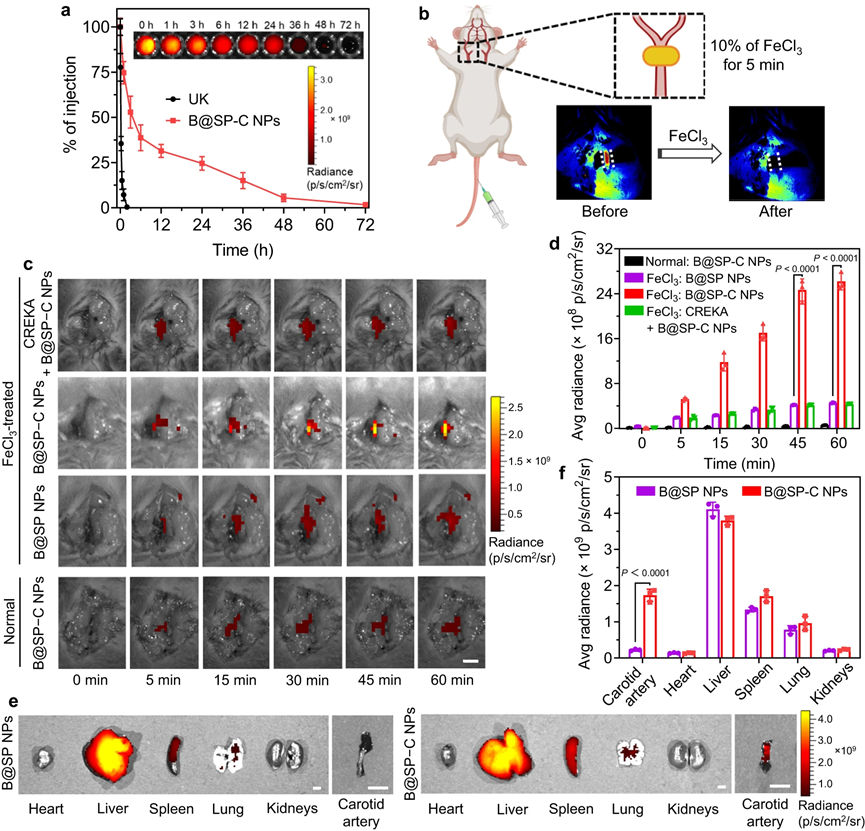
图5 |体内血栓靶向能力
受到B@SP–C NPs优异的血栓靶向能力的鼓舞,该研究接下来对血栓进行了体内NIR-II PA 成像。结果表明,B@SP−C NPs能够准确、灵敏地减轻体内血栓,这源于其优异的NIR-II PA效率和足够的血栓靶向特性。

图6|血栓的体内NIR-II PA成像
接下来,研究了B@SP−C NPs作为一种有前途的纳米药物用于阻塞性血栓形成治疗的潜力。尽管这些纳米颗粒具有相当的光热转换能力,但B@SP−C NPs组由于其良好的血栓靶向能力,在血栓部位表现出最高的温升。然后,研究了位点特异性光热效应是否可以增强溶栓活性。可以看出,对于负载BNN6的B@SP NPs + NIR-II光组,与SP NPs + NIR-II相比,实现了更有效的血栓清除。此外,NIR-II光热溶栓和NO释放的结合可以产生更好的抗血栓性能。更有趣的是,由于出色的血栓归巢能力,B@SP−C NPs在激光照射下可显着改善和快速溶栓,导致血液灌注在20分钟内恢复约85%,并表现出最高的溶栓活性。

图7 |颈动脉血栓模型中的体内溶栓评估

图8 |溶栓治疗的多普勒超声和组织学评估
除颈动脉血栓形成外,还进一步发展了下肢动脉血栓形成模型。结果表明,在NIR-II激光照射下,兼具血栓结合特性和多模式治疗效果的B@SP−C NPs明显表现出最快、最有效的血栓溶解,血流几乎完全恢复。这些数据表明B@SP−C NPs在多种血栓模型中有效逆转血栓栓塞的巨大潜力。当然,B@SP−C NPs具有良好的体内生物相容性,且B@SP−C NPs介导的局部光激活血栓治疗不仅具有高效的抗血栓功效,而且具有可忽略不计的出血副作用。
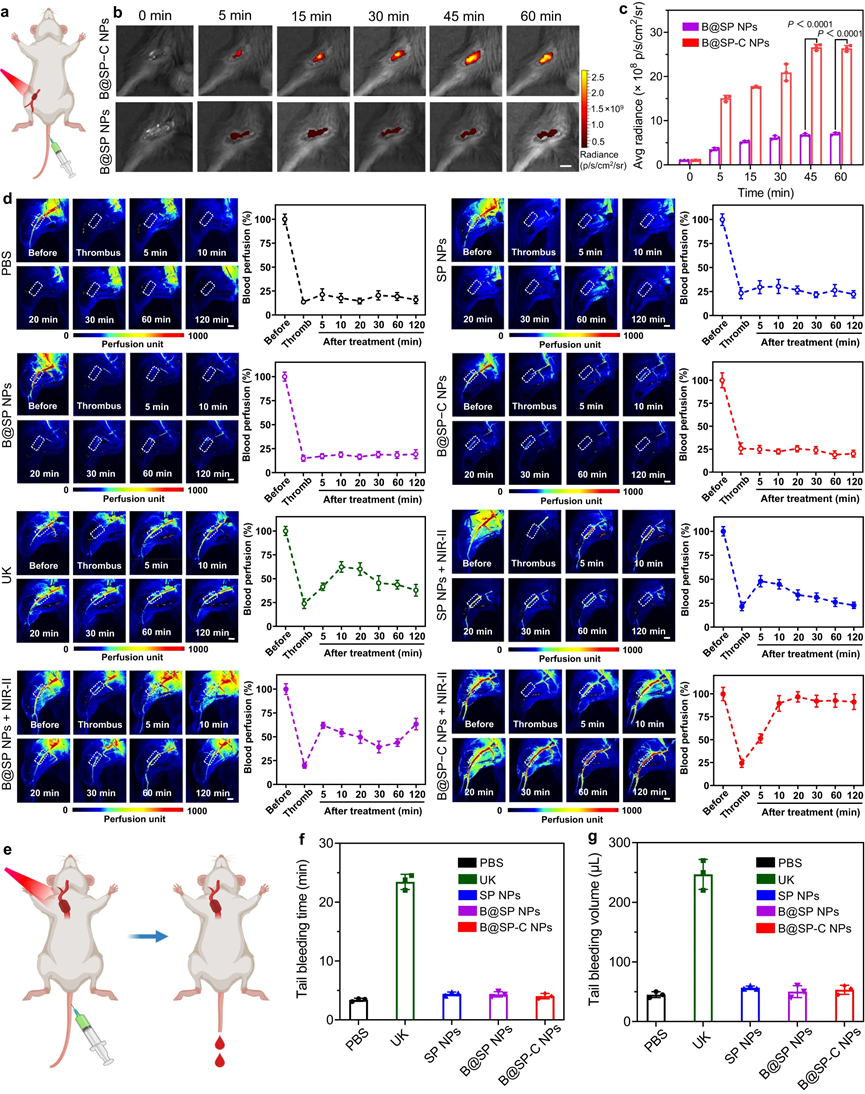
图9|下肢动脉血栓形成模型体内溶栓的评价及出血性副作用
【小结】
该研究开发了一种先进的治疗诊断纳米平台,该平台集成了基于长波NIR-II PA成像的精确血栓检测和卓越的抗血栓活性。设计并合成了一种具有强长波长NIR-II吸收和强烈分子运动的半导体均聚物,可增强光热和PA信号。为了最大限度地提高血栓成像和治疗的准确性,聚合物纳米探针上装饰有纤维蛋白特异性配体,用于血栓靶向。NIR-II PA纳米平台具有优异的NIR-II光捕获能力、明亮的PA信号、强组织穿透力和活性血栓积聚能力等特点,能够以超高的信噪比灵敏、选择性地勾画血栓。除了精确诊断血栓外,B@SP−C NPs还可以用作光激活剂,用于无创溶解血栓。血栓局部光热效应和按需释放一氧化氮的结合不仅可以有效溶解血栓,还可以促进NPs渗透到血栓中,从而提高抗血栓效果。有趣的是,该研究发现纳米制剂在FeCl3诱导的颈动脉血栓形成模型和下肢动脉血栓形成模型中均表现出快速有效的血凝块清除活性,血流几乎完全恢复,与游离UK和单次光热溶栓。同时,该纳米平台还被验证具有良好的体内生物相容性和较低的出血副作用风险,代表了一种安全的溶栓治疗方法。因此,通过将精确的NIR-II PA成像和多模式协同溶栓治疗整合到一个实体中,这里开发的多功能纳米平台有望改善血栓诊断和治疗的现状。
原文链接:
https://www.nature.com/articles/s41467-023-42691-8


