J Clin Oncol:德曲妥珠单抗治疗HER2突变的转移非小细胞肺癌,ORR达50%,对脑转移,疾病控制率高达92.9%!
时间:2023-11-04 08:43:28 热度:37.1℃ 作者:网络
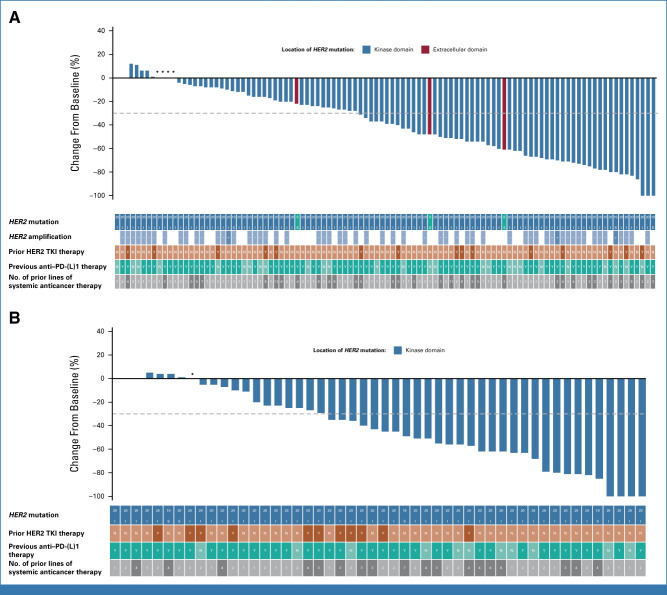
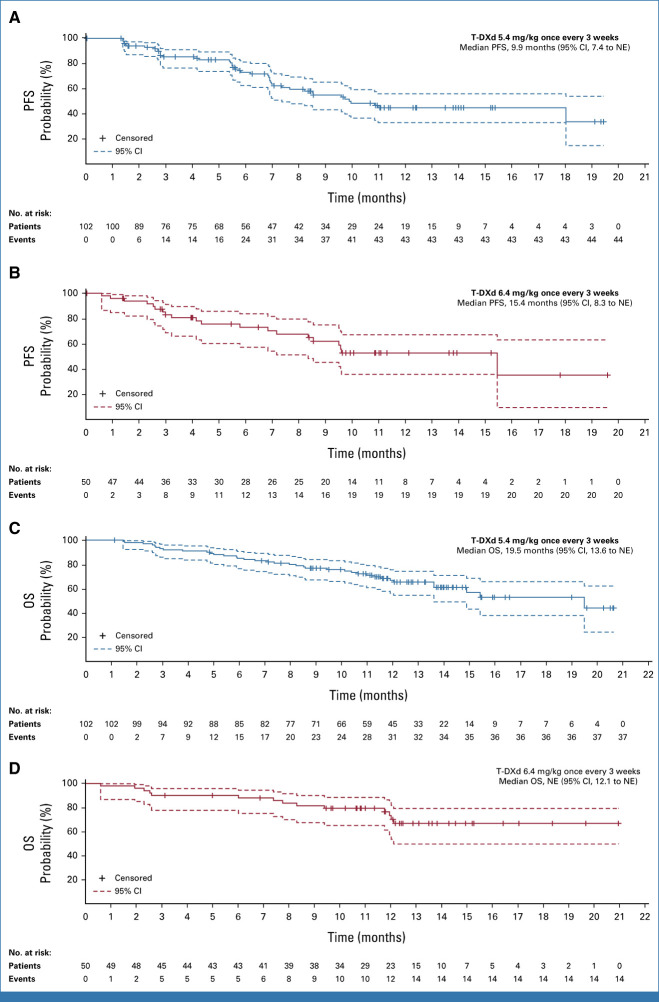
2022年1月 The New England Journal of Medicine 发表了DESTINY-Lung01研究[3]结果,德曲妥珠单抗6.4mg/kg治疗HER2突变经治NSCLC患者的确认的客观缓解率(cORR)为55%(95%CI:44%-65%),中位无进展生存期(PFS)为8.2个月(95%CI:6.0-11.9个月),中位总生存期(OS)为17.8个月(95%CI:13.8-22.1个月)。并且,在2022年ESMO大会上,DESTINY-Lung01研究[4]再次更新了德曲妥珠单抗治疗HER2突变NSCLC患者数据(n=91),cORR为54.9%(95%CI:44.2%-65.4%),中位PFS为8.2个月(95%CI:6.0-11.9个月),中位OS为18.6个月(95%CI:13.8-25.8个月),疗效与既往报道基本一致,显示出德曲妥珠单抗在经治HER2突变转移性NSCLC患者中的强大且持久的抗肿瘤活性。 DESTINY-Lung02 是一项随机、多中心、盲法、2 队列 II 期研究(ClinicalTrials.gov 标识符:NCT04644237),在北美、亚洲、欧洲和澳大利亚的 47 个地点进行,评估 T-DXd 5.4 的有效性和安全性 mg/kg 和 6.4 mg/kg,对于既往接受过治疗的 HER2m mNSCLC 患者每 3 周一次。 年满 18 岁或以上的患者符合资格; 患有已知的激活 HER2 突变的 mNSCLC(数据补充,表 A1 [仅在线]),由经过认证的当地实验室评估从档案或新鲜肿瘤组织样本中记录; 既往在转移性/局部晚期接受过 ≥1 种治疗(铂类化疗); 不适合治疗性手术或放射治疗; 且根据 RECIST 版本 1.1 (RECIST v1.1),通过盲法独立中央审查 (BICR) 具有 ≥1 个可测量病变。 符合条件的患者按 2:1 随机分配至 T-DXd 5.4 mg/kg,每 3 周一次,或 6.4 mg/kg,每 3 周一次。 随机分配按先前接受过抗 PD-(L)1 治疗的患者进行分层。 所有患者、研究者、现场工作人员(药剂师和其他认为现场操作需要维持盲法的工作人员除外)、中央影像阅读器和 ILD 裁决委员会均对剂量水平不知情。 每3周静脉注射一次T-DXd 5.4 mg/kg或6.4 mg/kg。 主要研究终点是通过盲态独立中心审查(BICR)的cORR,次要研究终点包括研究者评估的cORR、缓解持续时间(DoR)、疾病控制率(DCR)、PFS、OS以及安全性。 结果显示,在每 3 周一次的 T-DXd 5.4 mg/kg 组中,通过 BICR 确认的 ORR 为 49.0%(95% CI,39.0 至 59.1;50 名患者;DCO,2022 年 12 月 23 日),其中 1 名患者 (1.0%) 和 49 名患者 (48.0%) 分别达到 CR 和 PR。 在每 3 周一次 6.4 mg/kg 的 T-DXd 治疗组中,确认 ORR 为 56.0%(95% CI,41.3 至 70.0;28 名患者),其中 2 名 (4.0%) 和 26 名患者 (52.0%) 实现 CR 和 PR。 无论先前全身抗癌治疗的数量或类型以及基线 CNS 转移情况如何,在各个治疗组中都观察到了反应。在两种剂量下,患者的肿瘤大小较基线有所减小,随着时间的推移而持续。 中位DoR为16.8个月(95%CI,6.4至不可估计[NE]),中位时间 T-DXd 5.4 mg/kg 至初始缓解 (TTIR) 为 1.8 个月(范围 1.2-7.0)。T-DXd 6.4 mg/kg 时,中位 DoR 为 NE(95% CI,8.3 至 NE),并且 TTIR 中位数为 1.6 个月(范围,1.2-11.2;表表2).2)。 T-DXd 5.4 mg/kg 时,12 个月时保持缓解的估计应答者比例为 54.4%(95% CI,37.6 至 68.5);T-DXd 6.4 mg/kg 时,应答者维持应答的比例为 64.1%(95% CI,38.2 至 81.4) 公斤。 研究者评估的 ORR 和 DCR 与 BICR 评估一致。 在安全性方面,两剂量的安全性事件与德曲妥珠单抗既往的临床试验一致。两组最常见≥3级不良事件包括中性粒细胞减少(18.8%和36.0%)和贫血(10.9%及16.0%)。两组确诊为药物相关性间质性肺病(ILD)/肺炎的发生率分别为12.9%(13/101例)和28.0%(14/50例),且主要为1/2级(图4)。相比6.4mg/kg组,5.4mg/kg组观察到更优的安全性和更低的ILD发生率。 DESTINY-Lung02研究此次主要分析结果的更新,提示德曲妥珠单抗5.4mg/kg和6.4mg/kg剂量疗效均能满足临床需求,且安全性可控,其中较低剂量的5.4mg/kg安全性更优,提示德曲妥珠单抗已成为HER2突变NSCLC有效的靶向疗法,为临床提供更多治疗选择,也进一步证实了HER2突变是NSCLC的一个有效靶点,临床需要关注HER2突变的检测。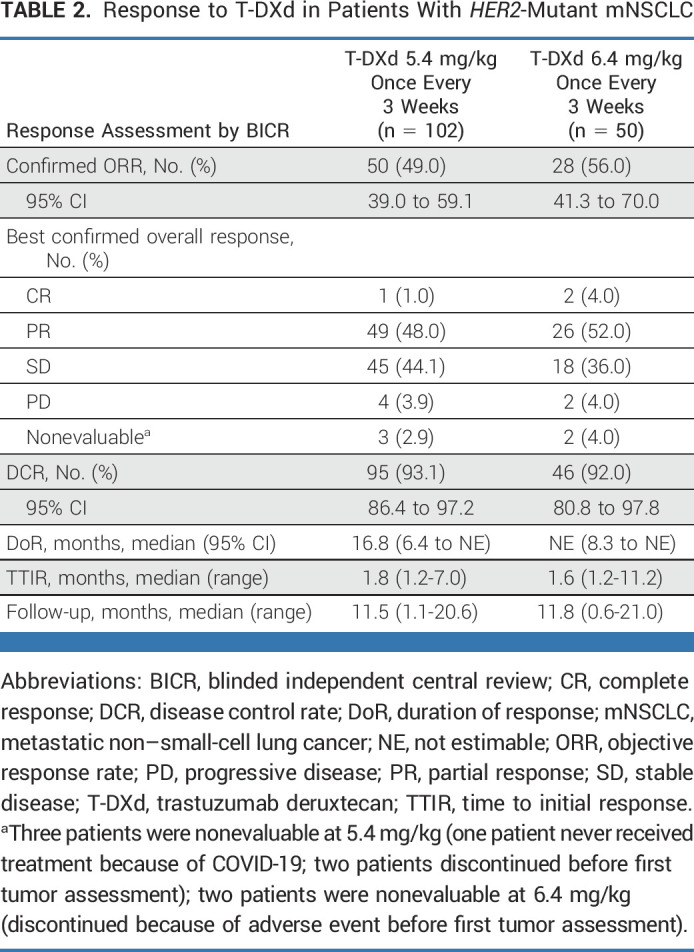
进一步在ESMO大会上,来自2期DESTINY-Lung01和DESTINY-Lung02临床试验的探索性分析的汇总结果显示,T-DXd(也叫DS-8201)在经过或未经过治疗的HER2基因突变的非小细胞肺癌脑转移患者中,引发了良好的颅内治疗反应。
因此,T-DXd在该研究中的脑转移控制率高达92.9%。此外,患者一旦治疗有效,则平均有效时长可达9.5个月。
2022年8月,美国食品药品监督管理局(FDA)批准了T-DXd用于治疗具有HER2突变的不可切除或转移性非小细胞肺癌成年患者,并且这些患者先前接受过全身药物治疗。
原始出处:
Goto K, Goto Y, Kubo T, Ninomiya K, Kim SW, Planchard D, Ahn MJ, Smit EF, de Langen AJ, Pérol M, Pons-Tostivint E, Novello S, Hayashi H, Shimizu J, Kim DW, Kuo CH, Yang JC, Pereira K, Cheng FC, Taguchi A, Cheng Y, Feng W, Tsuchihashi Z, Jänne PA.Trastuzumab Deruxtecan in Patients With HER2-Mutant Metastatic Non-Small-Cell Lung Cancer: Primary Results From the Randomized, Phase II DESTINY-Lung02 Trial.J Clin Oncol. 2023 Nov 1;41(31):4852-4863. doi: 10.1200/JCO.23.01361.
P. Janne, Y. Goto, T. Kubo, et al. Trastuzumab Deruxtecan in Patients with HER2-Mutant Metastatic Non-Small Cell Lung Cancer: Primary Results of DESTINY-Lung02. 2023 WCLC. MA13.10.
Li BT, Smit EF, Goto Y, et al. Trastuzumab Deruxtecan in HER2-Mutant Non-Small-Cell Lung Cancer. N Engl J Med. 2022;386(3):241-251. doi:10.1056/NEJMoa2112431


