Nature子刊:CAR-T治疗血液肿瘤的耐药机制及克服策略
时间:2023-11-05 17:54:54 热度:37.1℃ 作者:网络
CAR-T耐药机制
嵌合抗原受体 (CAR)-T 细胞疗法最近成为治疗化疗难治性或复发性血癌患者的有力治疗方法,包括急性淋巴细胞白血病、弥漫性大B 细胞淋巴瘤、滤泡性淋巴瘤、套细胞淋巴瘤和多发性骨髓瘤。尽管如此,大多数患者还是会对 CAR-T 细胞疗法产生耐药性。
《Nature Reviews Drug Discovery》近日发表综述,作者通过分析 CAR-T 细胞功能障碍、肿瘤固有耐药性和免疫抑制性肿瘤微环境,总结了 CAR-T 细胞免疫治疗的耐药机制;还讨论了目前克服多种耐药机制的研究策略,包括 CAR 设计的优化、体内 T 细胞功能和持久性的改善、免疫抑制性肿瘤微环境的调节和协同组合策略。
先前发布了上篇Nature子刊:CAR-T治疗血液肿瘤的耐药机制及克服策略(上篇),主要是CAR-T细胞功能障碍导致的CAR-T耐药及克服AR-T细胞功能障碍的策略,下篇聚焦于肿瘤固有耐药及克服抗原阴性逃逸策略、免疫抑制性肿瘤微环境及克服策略和展望。

目前已经确定了CAR-T 细胞免疫治疗的耐药多种机制 (图1),即 CAR-T 细胞功能障碍(图2),肿瘤固有耐药机制 (图3)和免疫抑制性肿瘤微环境 (TME)(图4)。必须深入研究这些机制,以制定更有效的策略,实现患者的持久缓解。
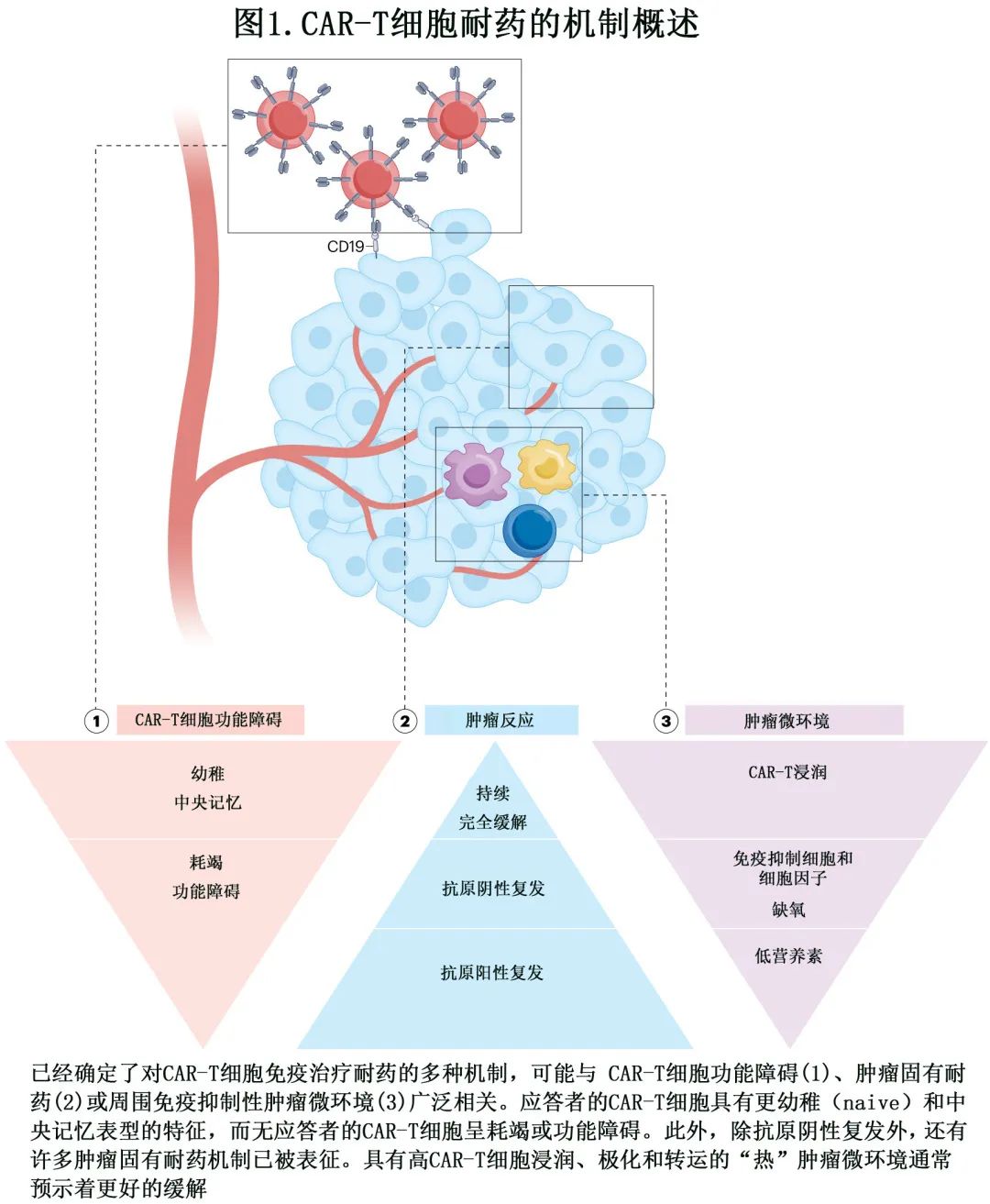
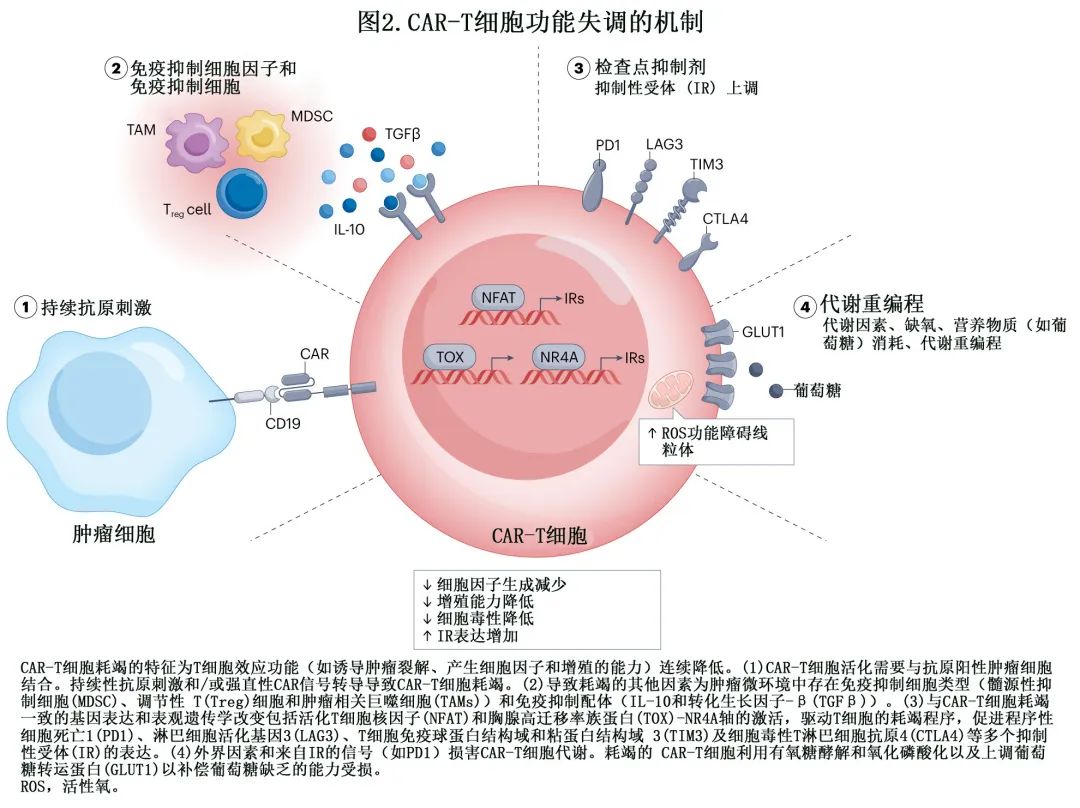
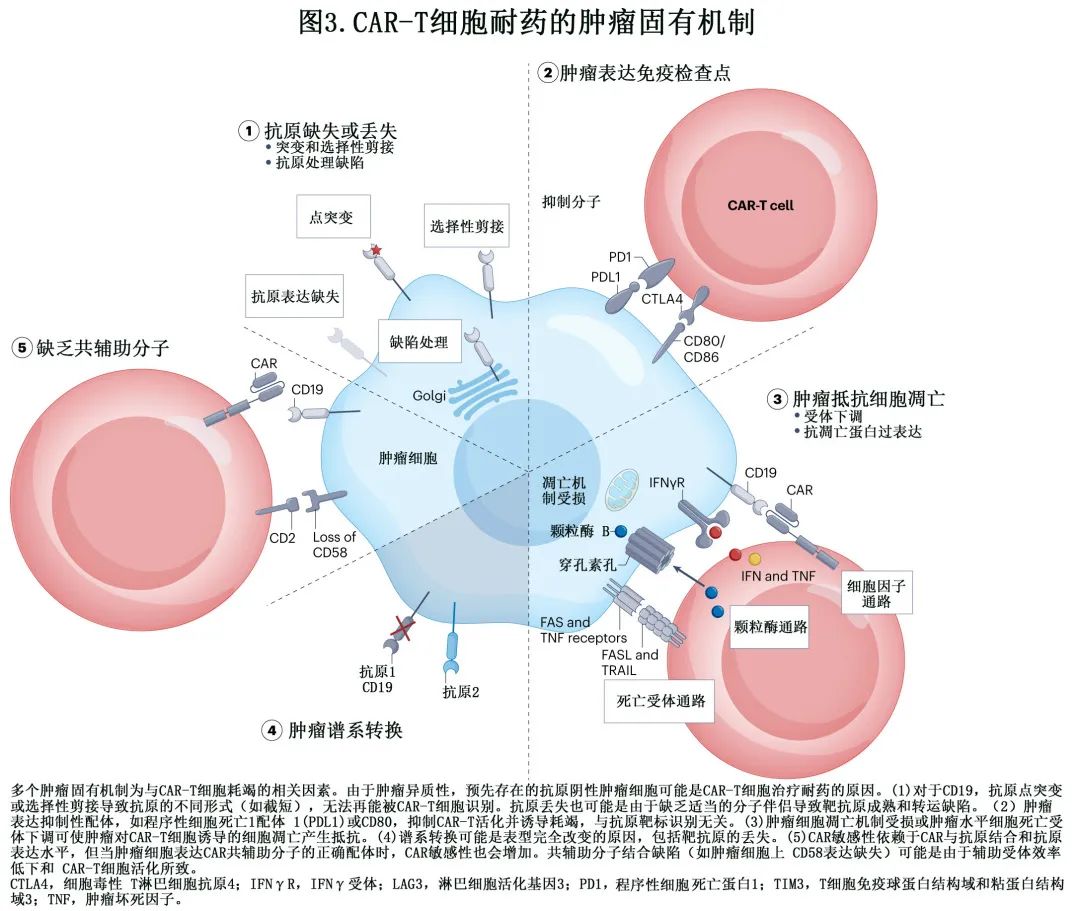
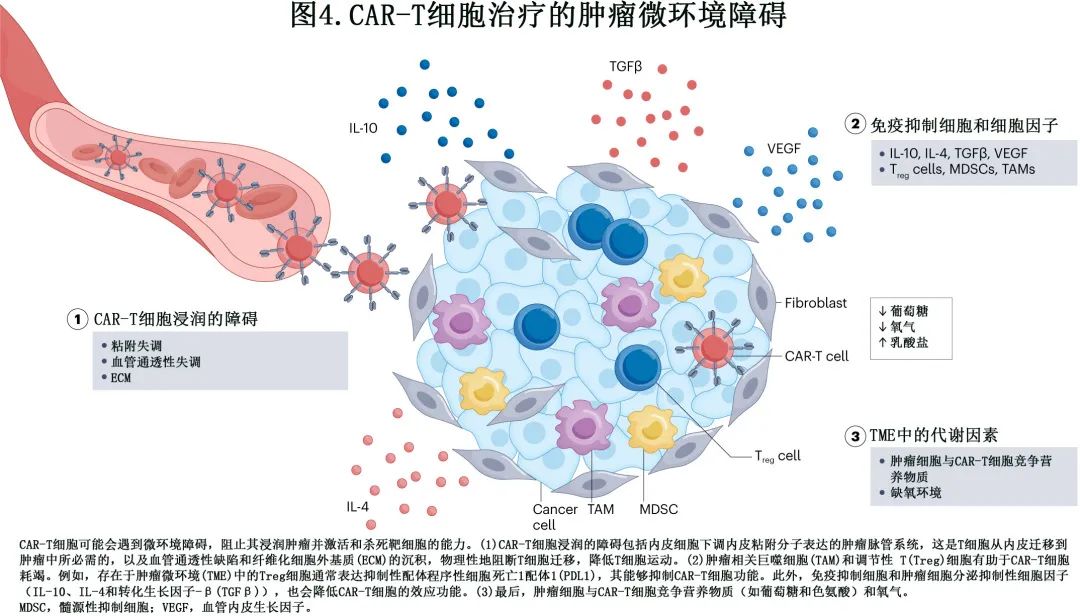
肿瘤固有耐药
抗原逃逸
自第二代 CAR-T 细胞的早期临床试验以来已观察到抗原阴性逃逸。关于 CD19 丢失(loss)发生率的广泛数据已发表,并且出现了更多关于 BCMA 和 CD22 丢失的数据。抗原丢失可能是多种机制的结果,包括谱系转换、选择性剪接、移码或基因缺失、抗原的异常处理或转运或表位掩蔽。改变后的克隆很可能是预先存在的克隆,在 CAR-T 细胞的强选择压力下具有生存优势。
CD19。肿瘤细胞上 CD19 蛋白的表达丢失可作为 CD19 靶向治疗的免疫逃逸机制。主要在 B-ALL 患者中报道CD19 CAR-T 细胞治疗后抗原阴性复发,最近的一些数据也证实了其在 NHL 病例中的作用;在 B-ALL 和 NHL 之间以及儿童和成人病例之间,CAR-T细胞治疗后 CD19 丢失的发生率不同。
儿科试验的数据显示18-24%的初始完全缓解病例(55例患者中的13例)发生 CD19-复发;在 axi-cel 和 tisa-cel 患者中,在 B-ALL 中有9-25%和 DLBCL 中有27-35%观察到 CD19 逃逸。较长的 CAR-T 细胞持久性通常与总体复发风险降低相关,但抗原丢失率增加(作为复发机制)。当抗 CD19 CAR-T 细胞治疗用作 B-ALL 病例的“allo-HSCT桥接治疗”时,接受移植的患者均未出现抗原逃逸复发,而不适合移植的病例中观察到抗原阴性B-ALL。在 NHL方面,联合分析axi-cel 的I 期和 II 期研究,通过免疫组织化学 (IHC)测定,11例缓解后进展的患者中有3例 (27%) 出现 CD19 丢失。Spiegel等人的研究评价了 NHL 患者对 CD19 CAR-T 细胞治疗的耐药性及其与复发时低水平 CD19 或 CD19 丢失的相关性,使用半定量 IHC H 评分测量接受 axi-cel 治疗的患者基线和疾病进展时的 CD19 表达。在配对治疗前和治疗后 H 评分的患者中,表达 CD19 的患者中60%(9/15例)在复发时CD19 表达丢失;但治疗前 CD19 表达的半定量 IHC 测量未识别有复发风险的患者。在 ZUMA-2 研究中,Michael Wang(王鲁华)等报告了60例套细胞淋巴瘤患者中23%复发,只有1例 (7%) 检测不到CD19。在滤泡性淋巴瘤的 ZUMA-5 研究中,无患者在疾病进展时出现 CD19 表达丢失。总体而言,当肿瘤来自更不成熟的 B 细胞时,CD19丢失似乎更频繁。
CD19 丢失可通过多种机制发生,包括基因改变,如 CD19 基因突变或缺失,或导致 CD19 基因表达沉默的表观遗传修饰。费城儿童医院的 Sotillo等首次描述了 CD19 CAR-T 细胞治疗后复发的 B-ALL 儿科病例中的 CD19 突变和剪接变异体,该研究比较了 CD19 CAR-T 细胞治疗前后的4个样本,在复发性白血病中检测到涉及外显子2(Δexon 2) 或外显子5-6跳跃的 CD19 剪接变异体。最近使用不同算法的分析也强调了内含子2的保留,可导致转录本的无意义介导的衰变或截短的 CD19 蛋白。Fischer 及其同事也报道了涉及Δexon2变异体的剪接变异体,也证实了疾病诊断时存在选择性 CD19 剪接异构体。Δexon2变体无法正确折叠并转运到细胞表面,并被内质网保留,在选择性 CD19 CAR-T 细胞压力下,携带这些变异体的细胞可以进化为显性克隆。此外单细胞 RNA 测序证实,CAR-T细胞治疗前可存在 CD19-B-ALL 细胞。
对纳入儿童和年轻成人患者的两项 II 期 CD19 CAR-T 细胞研究入组时和临床复发时采集的标本进行分析,结果显示分析的17例患者中有12例出现 CD19-复发。单细胞 RNA 测序在所有12例标本中均鉴别出 CD19 外显子2-5的移码突变,它是预测缺乏膜锚定的截短蛋白。在最近的一份报告中,3例 CD19 CAR-T 治疗后 CD19-复发的 DLBCL 患者携带 CD19 外显子3的突变,证实CD19的第一个外显子可能是突变热点。Braig 等人观察到4例经 CD19-CD3 双特异性 T 细胞衔接器 (BiTE)贝林妥欧单抗治疗后发生 CD19-复发的 B-ALL 患者中有1例 CD19 无突变,表达全长 CD19mRNA 但不表达CD81(CD81 与内质网中的 CD19 结合,对 CD19 向细胞表面的转运至关重要)。因此,CD19-免疫逃逸是由于内质网和(或)高尔基体中缺乏 CD81 表达,随后 CD19 的转运和(或)成熟缺陷所致。此外,高尔基驻留的膜内蛋白酶信号肽肽酶样 3(SPPL3) 在恶性 B 细胞中的表达最近被确定为 CAR-T 细胞治疗耐药的强效调节因子。SPPL3 的丢失可导致 CD19 高糖基化,抑制 CAR-T 细胞效应功能和细胞毒性,而 SPPL3 的过表达可诱导 CD19 蛋白丢失,从而抵抗 CAR-T 细胞。
另一种表现为抗原丢失的机制是谱系转换,特别是在起源于高度不成熟细胞的肿瘤,如前 B 细胞 ALL 或混合谱系重排白血病。该现象最初在化疗后复发的 B-ALL 儿童患者中报道,最近也在 CD19 CAR-T 细胞治疗后或贝林妥欧单抗治疗后观察到。抗 CD19 CAR-T 细胞治疗对表达 CD19 的 B-ALL 白血病施加选择压力,导致表达不同谱系标记物(从淋巴样原始细胞到髓样原始细胞)的肿瘤生长,包括靶抗原 CD19 丢失。Gardner 等人发现7例组蛋白-赖氨酸 N-甲基转移酶 2A(KMT2A) 重排的 B-ALL 患者中有2例在CD19 CAR-T 细胞治疗后复发时发生急性髓系白血病。Jacoby 等人报道相似结果,其中1例接受 CD19 CAR-T 细胞治疗的 KMT2A 重排 ALL 婴儿显示原始细胞初始清除后疾病复发,表达CD34、CD11b和CD33(均为髓系标志物)。
TME 也可能在谱系决定中发挥作用,表明致癌驱动因子与环境线索的结合有助于施压谱系转换。最后,Ruella及其同事56描述了1例 CD19 CAR-T 细胞治疗后9个月复发的 ALL 儿科患者的表位掩蔽。尽管通过流式细胞术最初似乎是CD19-,但对白血病原始细胞的更深入分析显示,CD19实际上表达,但与白血病原始细胞中异常表达的 CD19 CAR 顺式结合。CAR 在白血病原始细胞中的异常表达是由于生产过程中单个白血病细胞的意外转导所致。
CD22。CD22 是一种细胞表面分子,与 CD19 一样,B系细胞广泛而独特地表达CD22。CD22的下调似乎是CD22 CAR-T 细胞治疗后逃逸的主要机制,可能与 CD22 CAR-T 的疗效相对较低和 CD22 内在化的趋势有关。已在儿童和成人复发或难治性 (R/R)B-ALL患者及 CD19 CAR-T 细胞治疗失败的成人 NHL 患者中研究了 CD22 CAR-T 细胞。在一项单机构 I 期剂量递增研究中,3例 LBCL 患者和6例 ALL 患者在既往中位6线治疗后(包括既往 CD19 CAR-T 细胞治疗)接受 CD22 CAR-T 细胞治疗,所有 LBCL 患者均获得完全缓解,中位随访时间为8.4个月;所有ALL患者均获得完全缓解,中位随访时间为5.1个月。LBCL 队列最近更新报道,36例患者(中位随访15.7个月)的客观和完全缓解率分别为72%和53%。Shah 等人在58例R/R CD22+恶性肿瘤患者中开展了一项单中心、I期研究,包括56例 B-ALL 和1例DLBCL,87.9%的患者既往接受过 CD19 靶向治疗。完全缓解率为70%,中位总生存期为13.4个月 (95%CI为7.7–20.3 个月);在获得完全缓解的患者中,中位无复发生存期为6.0个月(95%CI为4.1-6.5个月)。值得注意的是,86.2%发生了CRS,但仅10%为≥3级。有趣的是,大约32.8%的患者表现出噬血细胞性淋巴组织细胞增多症(haemophagocytic lymphohistiocytosis)样表现,需要使用anakinra(靶向 IL-1 的细胞因子阻断)和大剂量类固醇。这项临床试验强调了抗原密度在 CD22 CAR-T 细胞应答中的重要性。在另一项研究中,21例儿童和成人接受 CD22 CAR-T 细胞治疗,包括17例既往接受过 CD19 靶向免疫治疗的患者,显示出剂量依赖性抗白血病活性,73%(11/15) 的患者获得完全缓解,包括所有 CD19low或 CD19-B-ALL 患者。在这项研究中,复发与 CD22 密度降低有关,而没有基因突变或 mRNA 水平的改变,表明存在 CD22 表达到细胞表面的转化后机制,较低的 CD22 蛋白水平可以使肿瘤细胞逃避 CD22 CAR-T 介导的杀伤。这是首次在体内和体外通过生成 CD22 表达水平可变的白血病细胞系证明 CD22 水平和 CAR-T 细胞介导的杀伤之间的直接相关性,并直接证明异基因移植模型中的肿瘤控制依赖于 CD22 的表面表达水平。CAR 分子不能与低水平抗原结合可能是由于内源性 TCR 和 CAR 之间的差异和/或免疫突触的差异。天然 TCR 进化为在低密度下识别抗原,并包含多个细胞内信号域;而CAR 分子通常仅包含编码TCRζ链的基因,在抗原识别过程中形成免疫突触,但免疫突触的组织与天然 TCR 有差异。一项 Ib 期研究结果显示,CD22 CAR-T 细胞具有良好的安全性特征,在18名成人和儿童中产生了较高的完全缓解率和无微小残留病,且与既往 CD19 CAR-T 细胞、贝林妥欧单抗或奥加伊妥珠单抗治疗无关。
BCMA。在接受BCMA CAR-T 细胞治疗的多发性骨髓瘤患者中记录了抗原逃逸,两项研究表明BCMA可能在复发时丢失或显著降低。Ali 等人报告8%(12例患者中的1例)的靶向治疗患者表现出 BCMA-活检。在另一个队列中,BCMA CAR-T 细胞治疗前和治疗后活检可评价的患者中67%(12/18) 显示骨髓瘤细胞的 BCMA 强度降低,包括9例无应答者中的4例。在 idecabtagene vicleucel 批准研究中,16例复发时骨髓样本可评价的患者中总计1例出现抗原丢失。在 CAR-T 细胞治疗后复发的患者中也报道了更多的 BCMA 下调或丢失孤立病例。然而总体而言,与抗 BCMA 治疗相关的抗原逃逸似乎不如 CD19 CAR-T 细胞常见,可能是因为 BCMA 对浆细胞存活至关重要。
抗原阳性肿瘤逃逸
除 B-ALL 外,CAR-T细胞治疗后的大部分复发表现为持续存在靶抗原,且通常这些复发比抗原阴性复发更早发生,被认为与 CAR-T 细胞持久性或功能不佳有关。B-ALL 的最新数据显示,死亡受体信号分子(如 FAS 通路的组分)或细胞凋亡外源性通路的促凋亡介质的表达下降构成 CAR-T 细胞治疗原发性耐药的新机制。通过无偏倚的、全基因组CRISPR–Cas9功能缺失筛选,鉴定出 CAR-T 细胞功能的进行性损害最初是由具有死亡结构域 (FADD) 的 FAS 相关蛋白下调所驱动。总之,这些结果表明,死亡受体信号通路的破坏导致肿瘤杀伤作用降低和抗原持续暴露,反过来导致 CAR-T 细胞的整体转录组和表观遗传重编程,对其功能产生不利影响。使用来自两项临床试验的样本进一步验证了这一发现,其中无应答者的白血病细胞的死亡受体特征表达显著低于应答者。最近的一份报告进一步认为,DNA的高甲基化、干细胞样表型和固有的可塑性以及抗原呈递减少是 CAR-T 细胞治疗无应答的白血病细胞的特征。
更好地理解 T 细胞如何消除肿瘤对于解开耐药机制至关重要。一个研究小组利用CRISPR–Cas9筛选,发现FAS 的激活介导旁观者对抗原阴性肿瘤细胞的杀伤,从而增加抗原异质性肿瘤的清除。此外,在一项大型临床研究中,肿瘤细胞中的 FAS 表达能够预测接受 CAR-T 细胞 (NCT02348216) 治疗的患者的生存期,因此有助于进一步了解 CAR-T 细胞的反应。其他关注逃逸抗原阳性的临床研究见表2。
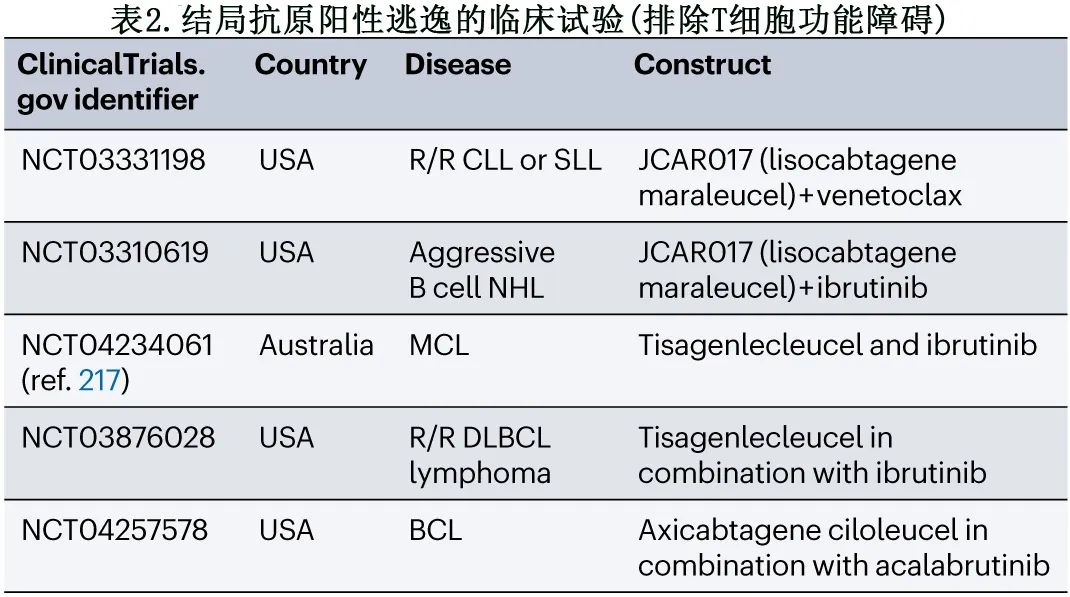
克服抗原阴性逃逸的策略
受体联合给药
目前正在开发克服抗原阴性逃逸的多种策略,包括新型 CAR-T 细胞设计和联合疗法,如两种 CAR-T 产品的联合给药、共转导(Co-transduction)或双顺反子(bicistronic)CAR载体或串联/环(Tandem/loop)CAR-T细胞。
两种CAR-T细胞产品联合给药。生成两种不同的靶向不同抗原的 CAR-T 细胞产物,一起或顺序给药。在最近的一项研究中,成人 R/R ALL 患者接受了两种自体 CAR-T 细胞产品(一种靶向CD19 [huCAR T19],另一种靶向CD22 [CAR T22-65s])。尽管既往接受过 CD19 和/或 CD22 靶向免疫治疗,但所有可评估患者 (n=11) 均达到完全缓解且无微小残留病。类似的办法还有报道。该方法的局限性在于生产两种不同载体和两种不同产品的成本和精力以及相关的监管挑战。
共转导或双顺反子CAR载体。利用单个 T 细胞产物表达两个识别不同抗原的CAR,可通过不同的方法来实现。T 细胞可以用两种不同的载体共转导,创建具有混合群体的 T 细胞产物,其中部分细胞用一种或两种病毒载体转导。另一种策略是使用双顺反子载体,能够在同一 T 细胞上共表达两种不同的 CAR 分子。最近的一项研究中,通过使用的新型抗 CD22 CAR 结构CD19 和 CD22对 B-ALL 的双重靶向作用,可识别低 CD22 密度和缺乏紧张性信号的细胞;研究中的 CAR-T 细胞使用两种单独的载体共转导:抗CD22 CAR(9A8-41BBζ) 和抗CD19 CAR(CAT-41BBζ),获得的 CAR-T 细胞产物 (CAT/9A8) 在体内外消除了单阳性和双阳性靶细胞。目前正在 I 期临床研究 (NCT02443831) 中检测 CAT/9A8 CAR-T 细胞。此外,Cordoba等人在儿童和年轻成人 R/R B-ALL 患者中开展了一项 I 期研究以检测AUTO3(用编码两种 CAR 的双顺反子载体表达抗 CD19 和抗 CD22 CAR 的自体转导 T 细胞)(表3)。研究中15例接受治疗的患者中有13例对治疗有反应,无论疾病负荷、细胞遗传学风险因素或既往治疗线数如何,包括1例在清淋前有CD19-CD22+原始细胞的病例,强调了双靶向的重要性。然而仍需要优化该双靶向产品持久性的策略,因为9名患者最终复发,CAR-T细胞持久性低;持续性降低的原因尚不完全清楚,但在抗 CD19 和抗 CD22 混合输注产品或双重 CAR-T 细胞的其他研究中也有观察到。Roddie at al.在 R/R LBLC 中通过使用 AUTO3 CAR-T 细胞联合 PD1 阻断 (帕博利珠单抗) 评价了双靶向作用,并报告其安全且适用于门诊给药;54.4%获得完全缓解的患者获得了持久的缓解,同时伴随着 CAR-T 细胞的强烈扩增。然而,双靶向 CAR-T 疗法和帕博利珠单抗均未能预防相当数量患者的复发。Fousek 等人最近报道了 CD19/20/22 靶向 CAR-T 细胞,通过使用一个三顺反子转基因在单个 T 细胞上共表达单个 CAR 分子。CD19/20/22 CAR-T 细胞可杀死CD19 CAR-T 细胞治疗后复发患者的 CD19-原始细胞。这些三靶向 CAR-T 细胞与靶细胞形成密集的免疫突触,介导有效的溶细胞复合物形成,与 CD19 CAR-T 细胞一样有效地对抗原发性CD19+疾病。
串联/环CAR-T细胞。CAR-T 细胞产物含有一个受体分子,具有两个结合结构域,能够识别同源肿瘤细胞上的两个靶点。基于 CD19 靶向免疫治疗后 CD19 抗原丢失和 CD22 细胞表面表达减少导致复发的明确证据,Fry小组设计了双特异性抗CD19–CD22 CAR (CD19-22).BB.z-CAR),可同时靶向两种抗原,并保留了对 CD19 和 CD22 的双功能。该环CD19-CD22 CAR 在异基因移植模型中显示出有效杀伤CD19+CD22+、CD19+CD22-CD19-CD22+ B-ALL肿瘤的强大临床前数据。针对 R/R B-ALL(NCT03241940) 和R/R CD19+ DLBCL(NCT03233854) 儿童和成人患者以及R/R CD19+ CD22+ B细胞恶性肿瘤儿童和年轻成人患者 (NCT03448393),该双特异性CAR已进展至 I 期临床试验。Spiegel 等人在I 期临床试验 (NCT03233854)中使用CD19-22.BB.z-CAR 治疗成人 R/R B-ALL 或 LBCL 患者,结果50%的 B-ALL 患者和约30%的 LBCL 患者CD19-/low复发,但从未伴有 CD22 抗原丢失或低表达,提示对 CD22 抗原的选择压力低于单独靶向 CD22 时。联合使用时还需要进一步的研究来校准和调整不同的 CAR 效价。该构建体也已用于接受过多线既往治疗的B-ALL儿童和年轻成人的剂量递增 I 期临床试验,仅显示有限的 CAR-T 细胞扩增和细胞因子产生,需要进一步的构建体优化。靶向 CD19 和 CD20 的串联双特异性 CAR 目前正在 R/R B 细胞恶性肿瘤(NHL和CLL;NCT03019055)患者中进行I期试验,该产品无需低温生产和输注;2.5×106个细胞/kg 剂量非冻存输注 (n=12) 的总缓解率为100%(完全缓解为92%;部分缓解为8%)。正在进行多项临床试验来测试多靶点 CAR-T 细胞,以克服抗原丢失或下调(表3)。关于该研究的一个有趣的考虑在于,它显示 CD19 和 CD20 的初始表达水平与临床缓解之间无相关性;此外在接受抗 CD19 CAR-T 细胞治疗后进入研究的5例患者中,只有1例患者实现了充分的 CAR-T 细胞扩增和完全缓解,表明采用纯基于免疫疗法的再治疗仍有挑战性。研究长期随访继续进行(NCT03375619)。Ruella 等人观察到CD123 在复发性 CD19 B-ALL 疾病中表达后,还在 B-ALL 模型中检测了抗 IL-3 受体-α链 (CD123)CAR 和抗 CD19 CAR 的新型组合。抗 CD123 CAR-T 细胞靶向抗原阴性原始细胞,可与抗 CD19 CAR-T 细胞联合给药,防止抗原丢失复发。一种结合 CD19 介导和 CD123 介导的 T 细胞活化的新型串联 CAR 结构,可提供比单一抗原表达 CAR-T 细胞或合并 CAR-T 细胞更优的抗 B-ALL 体内活性。
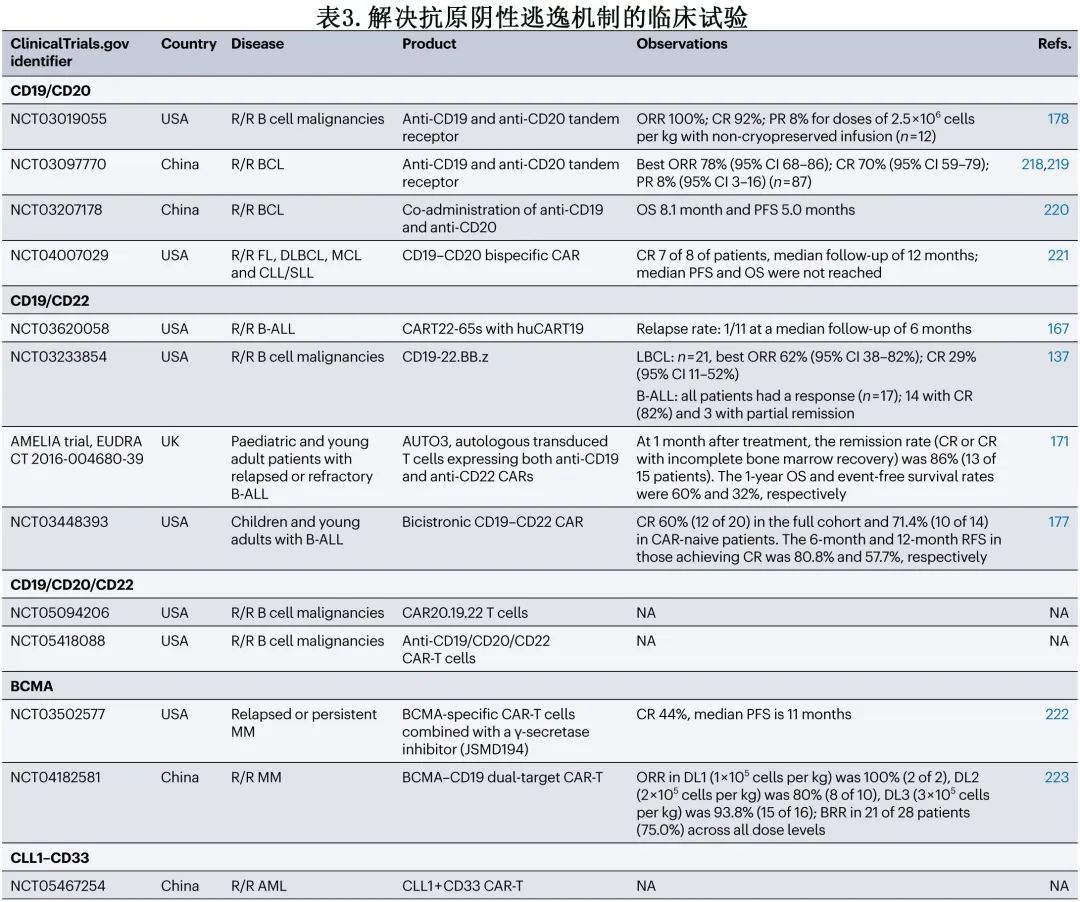
四代CAR-T细胞
第四代 CAR-T 细胞经过设计可分泌额外的分子(如细胞因子)以增强抗肿瘤活性。因此,除了直接的抗肿瘤攻击,它们还可引发 T 细胞消除靶位点的抗原阴性肿瘤细胞;这些 T 细胞也称为重定向通用细胞因子介导杀伤 T 细胞(T cells redirected for universal cytokine-mediated killing,TRUCK)。其中部分TRUCK可分泌 IL-12 或IL-18,它们改善的抗肿瘤作用已在异基因移植和同基因小鼠模型中得到证实。
另一种策略是设计分泌双特异性抗体的 CAR-T 细胞,它们可以靶向不同的肿瘤抗原,也可以募集 T 细胞到TME。因此,这两种策略的结合可以减少抗原逃逸和异质性,以及增加整体抗肿瘤活性和 CAR 持久性。对于胶质母细胞瘤的治疗,最近的一项研究通过评估双顺反子结构整合了这一想法,该结构表达 EGFRvIII (EGFR的一种突变形式,主要在胶质母细胞瘤中表达)特异性CAR和针对 EGFR 的双特异性 T 细胞衔接器,EGFR在胶质母细胞瘤中过表达。与 EGFRvIII CAR-T 细胞单药治疗相比,CAR和双特异性 T 细胞衔接器联合治疗可消除胶质母细胞瘤小鼠模型中的异质性肿瘤,具有良好的安全性特征。CAR-T 细胞和 BiTE 分别双重应用也可以成功,如一项病例研究报道,1例 CAR-T 细胞单药治疗后复发的 R/R B-ALL 患者接受贝林妥欧单抗治疗后,CD22 CAR-T细胞的 CAR-T 细胞扩增增加。
联合策略
将 CAR-T 细胞与维持肿瘤表面靶表达的治疗相结合,也是防止抗原下调的潜在策略。BCMA 通过γ-分泌酶从肿瘤细胞表面主动裂解,导致配体密度降低,因此药理学抑制γ-分泌酶可阻断 BCMA 裂解。在多发性骨髓瘤小鼠模型中测试γ-分泌酶抑制剂和 BCMA CAR-T 细胞的组合正面该策略是成功的。正在进行评估γ-分泌酶抑制联合 BCMA CAR-T 细胞治疗的研究(NCT03502577、NCT04714827和NCT04162353)
在抗原密度较低的情况下,另一种策略是修改 CAR 分子的设计,以调整 CAR-T 细胞活化的阈值。Majzner 等人探索了令人兴奋的策略,基于在 CAR 中包含额外的免疫受体酪氨酸活化基序 (ITAM),以提高对低抗原密度的识别。与 CD28 铰链跨膜区结合时该策略可进一步增强,证明 CAR 的精确设计可以调整抗原识别的阈值。
免疫抑制TME
TME 在肿瘤治疗反应方面具有至关重要的作用,因为它可以通过多种机制减弱输注的 CAR-T 细胞的有效性,包括物理屏障、可溶性因子和免疫抑制细胞。
TME免疫抑制的机制
TME 可以通过减少运输和诱导 T 细胞功能障碍,对有效的 CAR-T 细胞治疗带来挑战。接受 axi-cel 治疗的 DLBCL 中的免疫失调表明,对 CAR-T 细胞治疗的耐药性集中于循环单核 MDSC 和肿瘤 IFN 信号转导,导致 axi-cel 扩增不足以及免疫检查点配体表达升高。尽管IFNγ急性暴露增加免疫细胞的抗肿瘤功能,但慢性信号传导可导致免疫抑制,对治疗(如免疫检查点抑制剂治疗)产生耐药性。IFNγ对 TME 中 CD19 靶向 CAR-T 细胞的宿主免疫活化的重要性已在免疫活性小鼠淋巴瘤模型中得到证实。因此,IFNγ可能通过检查点抑制或细胞因子调节来降低 TME 中的免疫抑制,从而影响 CAR-T 细胞的有效性。然而最近的报道表明,IFNγ受体信号通路中的基因(IFNγ受体 1[IFNGR1]和 Janus 激酶 1[JAK1]和JAK2)丢失仅在实体瘤中对 CAR-T 细胞杀伤产生抗性,但不影响淋巴瘤或白血病细胞对 CAR-T 细胞的敏感性。此外,一项近期研究调查了 axi-cel 的作用机制,发现成功应用 CAR 的所有重要方面(疗效和患者生存期以及无毒性)均与治疗前和治疗后肿瘤免疫背景相关(该概念包括免疫系统各种参数的总结以及肿瘤内免疫细胞更精确的表征和定位)。该研究也证实了 TME作为一种强大的耐药机制的重要作用,与 T 细胞功能障碍和抗原逃逸同等重要。
重要的是,由于疾病本身以及淋巴结或骨髓等不同解剖部位的差异,目前获批的 CAR-T 细胞疗法靶向的不同疾病类型(主要是DLBCL、ALL和骨髓瘤)的 TME 可能不同。在 B 细胞 NHL 中,TME的免疫抑制环境可使 CAR-T 细胞无法充分攻击肿瘤。在一份报告中,达到完全缓解的患者肿瘤相关巨噬细胞 (TAM)、调节性 T(Treg) 细胞和MDSC水平降低,而趋化因子和 MDSC 在仅达到部分缓解的患者中过表达。还需要进行额外的研究,以更深入地了解 TME 对 CAR-T 细胞靶向血液恶性肿瘤的作用。
克服TME免疫抑制
通过各种策略改变和修饰TME,如直接靶向 TAMs 和其他免疫抑制因子,有可能提高 CAR-T 细胞治疗的临床疗效,实现更持久的缓解。TME 的免疫抑制影响可以通过不同的方式降低(表4)。上一节讨论的 TRUCK是一种潜在策略。此外可以掺入各种细胞因子,如IL-7(其选择性地扩增肿瘤重定向的细胞毒性 T 淋巴细胞,而不依赖于Treg细胞)或IL-15(其在抗原识别后增加 T 细胞扩增,并可同时增加肿瘤的细胞毒性);IL-12或 IL-18 的分泌也可诱导 TME 的促炎性重塑。
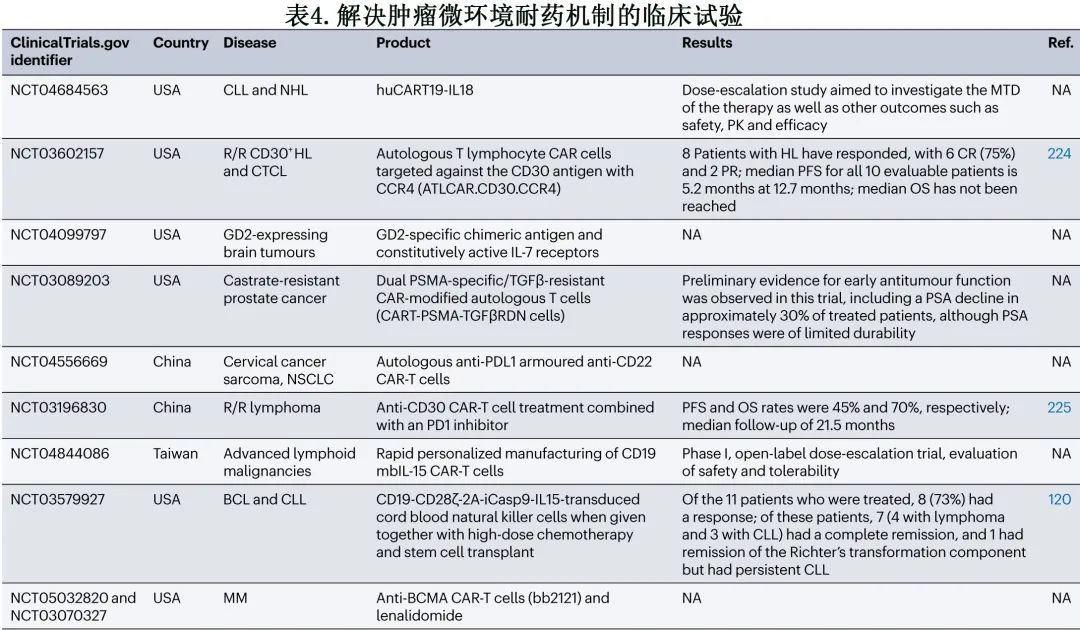
CAR-T 细胞还可以与 BiTE 结合,BiTE可以激活 Treg 细胞脱颗粒,通过穿孔素释放杀死靶细胞。另一种可能性是将合成酶武装的 NK 细胞与附着的无活性前体药物结合,编程为直接在肿瘤部位被激活,并导致对靶肿瘤的活性增加。TME 也可受到 CAR 共刺激信号域的影响。CD28 共刺激结构域通过 IL-2 分泌支持 Treg 细胞持续存在,但CD28内结构域的 LCC 结合部分的缺失可消除 IL-2 分泌,并显著减少肿瘤部位 Treg 细胞的数量;此外去除该结构域不会对 CAR-T 细胞功能或IFNγ分泌产生负面影响。避免 TME 免疫抑制性质的另一种潜在方法是使用 Toll 样受体激动剂,这些化合物可以增加白细胞(特别是细胞毒性 T 淋巴细胞和辅助性 T 细胞)募集到肿瘤部位,从而减少抑制性 TME 的影响。除了目前 CAR-T 细胞被批准的 B 细胞疾病外,难治性霍奇金淋巴瘤患者也可能从 CAR-T 细胞治疗中获益但缺乏 CD19 抗原,且TME具有非常强的免疫抑制性。此外,霍奇金淋巴瘤细胞在体外将巨噬细胞转化为TAM,TAM可严重限制 CAR-T 细胞增殖。然而抗 CD123 CAR-T 细胞可主动攻击TAMs及霍奇金肿瘤细胞,建立长期的免疫记忆。
Smith 等人发表了一项关于肠道菌群在 R/R B-ALL 和 LBCL 患者 CAR-T 细胞(包括 4-1BB 和 CD28 产品)中的临床作用的研究。CAR-T 细胞给药前4周内暴露于抗生素,如哌拉西林-他唑巴坦、亚胺培南和美罗培南与粪便微生物组多样性和总生存期降低相关。此外若在 CAR-T 细胞输注前给予抗生素时,则在淋巴瘤子队列中观察到免疫效应细胞相关的神经毒性综合征的发生率较高;而高频率的专性厌氧菌,如瘤胃球菌、拟杆菌、粪脂杆菌和 Akkermansia 与第100天的完全缓解相关。Stein-Thoeringer 等人在美国和德国接受axi-cel、tisa-cel或 liso-cel 输注的 NHL 患者队列中证实了这些数据。长双歧杆菌和肽聚糖生物合成与长期生存和对 CAR-T 细胞的反应高度相关,与人口统计学或临床变量无关。在 T 细胞单采时,毛螺菌属和嗜黏蛋白阿克曼氏菌与CD3+和CD4+ T细胞计数显著相关,而拟杆菌、布劳特氏菌属和 Faecalibacterium prausnitzii 对CD3+和CD8+ T细胞水平有负面影响。最后,作者强调,阿克曼菌属可能影响制造的 T 细胞产品更好的质量和性能。然而,两项研究均未报告肠道菌群的组成与 CRS 之间存在关联。
除了 TME 本身,其他宿主因素也可能影响 CAR-T 细胞治疗。最近的一项研究发现,肠道微生物组的变化与接受 CD19 CAR-T 细胞治疗 B 细胞恶性肿瘤的患者的临床预后相关。还需要进行进一步评价,以研究微生物组在 CAR 治疗耐药性方面的作用。
未来展望
近年来,CAR-T细胞改变了淋巴系统恶性肿瘤的治疗格局,在其他预后不良的患者中产生了前所未有的缓解率,并成功地走向了更早的治疗线。然而对 CAR-T 细胞的耐药性仍然是该疗法长期和深远治疗成功的关键障碍,因而是实验室和临床研究的重要领域。与大多数肿瘤治疗药物不同,CAR-T 细胞的潜在的耐药机制,除了适用于所有治疗药物的肿瘤相关因素(侵袭性疾病、靶点丢失和对细胞死亡途径的原发性耐药),还包括药物本身的失效(功能障碍、耗竭和缺乏持久性)和药物对其他宿主因子(TME、微生物组和既往治疗)的易感性。然而与小分子或基于蛋白质的生物制剂不同,CAR-T细胞提供了独特的机会来改造治疗药物,使克服多种潜在耐药机制的改进产品成为可能,无论是产品相关的还是肿瘤相关。因此,彻底了解 CAR-T 细胞如何杀死肿瘤细胞以及不同的耐药机制对于进一步开发下一代免疫治疗至关重要。正在开发的有前景的策略包括可靶向多种抗原的 CAR-T 细胞以减少抗原逃逸、释放蛋白质以获得额外抗肿瘤疗效的装甲CAR、优化 CAR 信号转导以提高临床疗效、CAR-T 联合小分子药物和利用基因工程来增强 CAR-T 细胞功能。
该领域的挑战包括开发能够概括原发性和继发性耐药的代表性临床前模型,无论它们是否与治疗药物、肿瘤或其他宿主因素相关。例如,目前的小鼠模型通常无法很好地代表TME,而如果可以代表,则必须在其他地方做出妥协,例如无法在同基因模型中检测人类 T 细胞或在人源化小鼠模型中使用异基因 T 细胞和/或肿瘤。此外,临床开发还提出了自己的挑战,如测试新的 CAR-T 细胞修饰所需的时间、财务和监管负担。另一个挑战包括解释小型临床试验的临床数据,其中其他关键因素通常存在显著差异,如生产工艺和患者人群。
最后,在考虑一种新疗法的效果时,还必须考虑到获得这种疗法是失败的潜在原因。的确,CAR-T细胞疗法是一种复杂的疗法,需要大量的专业知识、基础设施和成本,因此社会经济和地理因素在限制获得该治疗方面也具有重要作用。尽管政治改革和财富的公平分配肯定是减少获得 CAR-T 细胞不公平的关键因素,但科学发展也可能发挥重要作用,床旁制造、非病毒转导策略、短制造和现成产品都可以潜在地降低成本,并确保更大的机会获得这种挽救生命的疗法。
作者仍然乐观地认为,目前获批的 CAR-T 细胞的多种生物学局限性可以通过创造性的工程策略和联合疗法来克服,并且基于细胞的治疗方法具有独特的优势,能够在癌症患者中实现长期持久缓解。
参考文献
Ruella M, et al. Mechanisms of resistance to chimeric antigen receptor-T cells in haematological malignancies.Nat Rev Drug Discov . 2023 Oct 31. doi: 10.1038/s41573-023-00807-1.


