当帕金森病遇上体位性低血压(OH)!
时间:2023-11-18 21:26:41 热度:37.1℃ 作者:网络
论坛导读:帕金森病(Parkinson's disease,PD)是最常见的运动障碍疾病。患者除表现为特殊的运动症状外,PD也导致许多非运动性症状,如痴呆、慢性便秘、嗅觉减退、快速眼动期睡眠行为障碍、慢性疲劳、日间嗜睡、直立耐受不能等,在非运动性症状中最为突出的表现是血压的变化。直立性低血压(Orthostatic hypotension,OH)是帕金森病(PD)患者认知障碍的一个潜在可变危险因素,而且嗅觉减退和快速眼动睡眠行为障碍(RBD)与帕金森病的自主神经功能障碍密切相关。
直立性低血压(Orthostatic hypotension,OH)的特征是在站立或头向上倾斜的三分钟内,收缩压(SBP)下降超过20 mmHg或舒张压(DBP)下降超过10 mmHg。这种情况是由心血管自主反射受损引起的,特别是通过站立时去甲肾上腺素水平没有增加而检测到的交感神经激活减弱。此外,仰卧时的去甲肾上腺素值可以告知自主反射弓内的损伤水平。低去甲肾上腺素水平出现在外周或神经节后交感神经去神经,而中枢形式的自主神经衰竭,即多系统萎缩(multiple system atrophy,MSA)的患者出现正常或甚至高去甲肾上腺素水平,表明神经节前病变。
尽管有证据表明交感神经血管收缩受损,但我们先前报道了一种与站立时去甲肾上腺素水平过度升高相关的新的、独特的OH亚型称之为高肾上腺素能直立性低血压(hyperOH)。尽管与没有这种特征的OH相比,hyperOH患者的自主神经损害较轻,但长期结果和全因死亡率仍有待确定。此外,考虑到正常或增加的去甲肾上腺素通常与向神经退行性自主神经紊乱 (如MSA) 的现象转化相关。
PD的病理生理特征是脑内黑质多巴胺能神经元的丢失和路易小体的形成,此外,岛叶皮质、下丘脑、小脑、迷走神经背侧核、脊髓的中间外侧柱、交感神经节以及肠肌层和粘膜下层亦出现相似的病理变化。这些控制自主神经功能区域的病理变化,与单纯自主神经功能障碍的病理变化非常相似,可以使心血管反射弧对血压的调节变得紊乱,使支配心室肌的交感神经作用产生异常。PD血压异常包括体位性低血压(OH,大部分为神经源性OH(NOH)))、卧位高血压(SH)及餐后低血压(PPH),OH在临床中更为常见。因而,体位变化时患者血压不能得到及时有效的调节,导致了OH的发生。
另外,抗PD药物会诱发或加重OH,扰乱心血管的自主神经功能。几乎所有的多巴胺能药物均会扰乱直立位时机体对血压和心率的调节。一项研究发现33.1%的PD患者用药前有OH,50.8%的受试者在左旋多巴治疗期间有左旋多巴后急性OH(AOHPL)。对左旋多巴反应较好的PD患者在服用左旋多巴后可能有较低的平均动脉压(MAP)和较严重的收缩压下降。当运动机能恶化时,血压升高,反之亦然。有益反应是AOHPL的危险因素(OR = 1.624,P = 0.017)。可见AOHPL在PD患者中非常常见,建议有危险因素的PD患者应监测LCT期间的血流动力学变化,以避免口服左旋多巴后出现AOHPL。血压的波动是复杂的、多因素的,可能是PD和左旋多巴共同作用的结果。
最新一项研究分析了78例初发PD患者的皮质厚度、皮质下灰质体积和认知功能,这些患者接受了直立倾斜试验以诊断OH。采用蒙特卡罗校正的全脑分析显示,在OH患者中,嗅觉减退与扣带沟边缘分支的皮质厚度减少相关,该区域的皮质厚度仅与OH患者的认知功能相关。皮质下灰质体积分析表明,在OH患者中,重度RBD与左侧海马和双侧杏仁核体积减少相关。该研究得出的结论是即使在PD早期,OH也通过与RBD和嗅觉减退相互作用而影响灰质萎缩和认知功能障碍。OH可能会加重嗅觉减退或RBD引起的脑病变。
直立性低血压(OH)可以在早期帕金森病(PD)中观察到,并且它与更快速的疾病进展相关,且对患者认知有不利的影响。已经研究18F-FBB对PD伴OH (PD + OH)的临床意义,已被研究为估计脑灌注和淀粉样变性病的有用生物标志物,并且其早期摄取可以被解释为代谢活性的标志。在新发、早期和未用药的PD患者中,在PD No-OH和PD + OH患者之间观察到尾状核连接的不同亚临床模式。每个半球的尾状核与预先指定的认知相关区域相联系。BP不稳定性改变了模式化的相关性,但是这些改变并没有最终导致认知的组间差异。这一发现表明早期帕金森病固有的认知弹性。
一项研究发现未用药PD患者的疲劳进展和疲劳相关因素,并首次研究了未用药PD患者疲劳和OH之间的纵向联系。疲劳是一种常见的NMS,在未用药的PD中患病率为17.5%,它不是持续性的,但可以在病程中改变。OH和抑郁是未用药PD患者疲劳恶化的最相关预测因子。在平均23.3个月的随访期后,疲劳的发生率和平均PFS评分相似。与非疲劳组相比,疲劳组的OH患病率更高,自主神经症状、抑郁、焦虑和睡眠障碍加重。疲劳的进展与OH的存在和未用药PD的抑郁改变相关。相反,年龄、性别、疾病持续时间、焦虑和睡眠障碍与疲劳的进展没有显著关联。
多系统萎缩(MSA)和帕金森病(PD)在其早期阶段具有相似的临床表现。自主症状,如直立性低血压(OH)和排尿及勃起功能障碍,是MSA的主要标志。国际帕金森和运动障碍学会的研究将神经源性和症状性OH添加到前驱PD的标准中。OH可以说是自主神经衰竭最常见的症状。它对α-突触核蛋白病的残疾有个别的负面影响,反映了PD的“恶性”表型。根据血浆去甲肾上腺素水平、神经影像学检查和神经药理学检查的结果,伴有OH的PD患者心脏交感神经支配的丧失最为明显。相反,MSA患者有完整的心脏交感神经支配。
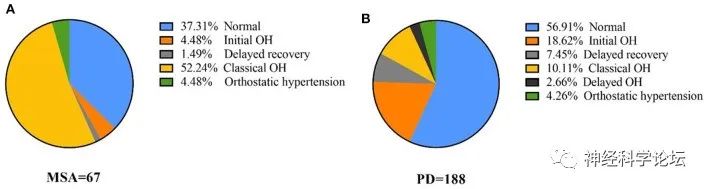
目前公认的是帕金森病的病变通常位于节后,而多发性硬化则位于节前。δ心率(HR)/δ收缩压(SBP)-3分钟比值0.492 bpm/mmHg被认为可以区分神经源性OH和非神经源性OH;然而,该指数在中枢和外周形式的自主神经功能障碍之间没有差异。
Front Neurol. 2023 Jan 26;14:1070943.
测量活动站立时的心率和SBP变化,这种方法在临床上应用更广泛。Fanciulli等人进一步研究了PD和MSA患者的神经原性直立性低血压(nOH ),并证明当倾斜试验设备不可用时,δHR/δSBP代表了一种有价值的nOH床旁筛查。连续逐搏无创血压监测分析主动站立试验可以识别OH及其变异,包括初始直立性低血压(IOH)、延迟恢复、经典直立性低血压(COH)、延迟直立性低血压(延迟OH)。虽然它们的病理生理学还没有被确定,但是主要的问题是所有变异的分布仍然未知。
PD患者由于疾病本身和抗帕金森病(PD)药物可能会扰乱自主神经功能,诱发或加重OH。因此,在对PD患者进行诊治的过程中,应认识到PD患者一些非运动症状,特别是OH存在的可能,及早进行诊治。同时对PD患者进行健康宣教,让患者认识到OH的危害并主动预防OH的发生,避免过大的血压波动,尽量减轻OH对身体的不良影响。
参考文献
Shiraishi T, et al. Interactive effect of orthostatic hypotension on gray matter atrophy associated with hyposmia and RBD in de novo Parkinson's disease. J Neurol. 2023 Dec;270(12):5924-5934. doi: 10.1007/s00415-023-11934-5.
Liu Z, et al. Acute effect of levodopa on orthostatic hypotension and its association with motor responsiveness in Parkinson's disease: Results of acute levodopa challenge test. Parkinsonism Relat Disord. 2023 Oct;115:105860. doi: 10.1016/j.parkreldis.2023.105860.
Yoo SW, et al. Caudate-anchored cognitive connectivity pursuant to orthostatic hypotension in early Parkinson's disease. Sci Rep. 2022 Dec 22;12(1):22161. doi: 10.1038/s41598-022-26811-w.
Zeng J, et al. The differences of orthostatic hypotension in patients with Parkinson's disease and multiple system atrophy. Front Neurol. 2023 Jan 26;14:1070943. doi: 10.3389/fneur.2023.1070943.
Ahn JH, et al. Orthostatic Hypotension Is a Predictor of Fatigue in Drug-Naïve Parkinson's Disease. Parkinsons Dis. 2023 Feb 8;2023:1700893. doi: 10.1155/2023/1700893.
Castro RA, et al. Long-Term Outcomes of Hyperadrenergic Orthostatic Hypotension. Res Sq [Preprint]. 2023 Sep 11:rs.3.rs-3318273. doi: 10.21203/rs.3.rs-3318273/v1.


