Eur Heart J 任发政/姜文剑/张宏家/郭慧媛教授合作揭示主动脉夹层的发病新机制
时间:2023-11-28 16:31:50 热度:37.1℃ 作者:网络
主动脉夹层(AD)是一种退行性主动脉重塑疾病,其特点是在没有有效药物治疗的情况下死亡率极高。在AD发生的过程中,位于血管中层的平滑肌细胞(SMCs)由收缩表型向合成表型发生转换。然而,负责这种表型转换以及在AD不同疾病时间阶段的潜在病理机制,目前仍不清楚。
2023年11月22日,中国农业大学任发政院士/郭慧媛教授团队和首都医科大学附属北京安贞医院张宏家/姜文剑教授团队合作在European Heart Journal发表了题为“The activator protein-1 complex governs a vascular degenerative transcriptional programme in smooth muscle cells to trigger aortic disp and rupture” 的论文,绘制了AD进展过程中人升主动脉的细胞图谱,揭示了转录因子AP-1调控平滑肌表型转换和AD发病进程的作用机制。

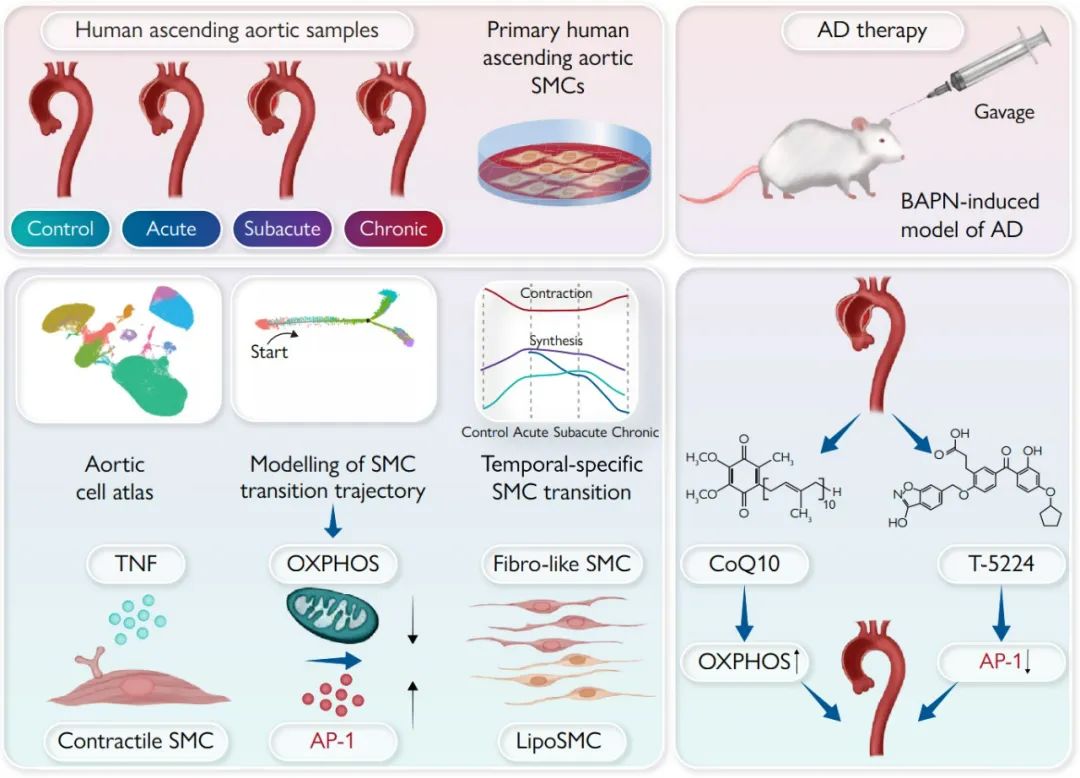
首先,作者对9例接受升主动脉置换术的STAAD患者(4例为急性AD,3例为亚急性AD,2例为慢性AD)和5例接受心脏移植的对照者(3例供体和2例受体)的升主动脉进行单细胞RNA测序,细胞簇的全局、疾病或血管特异性分布由均匀流形近似和投影(UMAP)表示。将UMAP分为对照组和AD组来进行细胞分布比较,最终确定了合成型SMC是AD中的一个新兴集群。通过将合成型SMC与所有主动脉细胞的比例进行比较,作者进一步证实了该集群在AD中的增加。
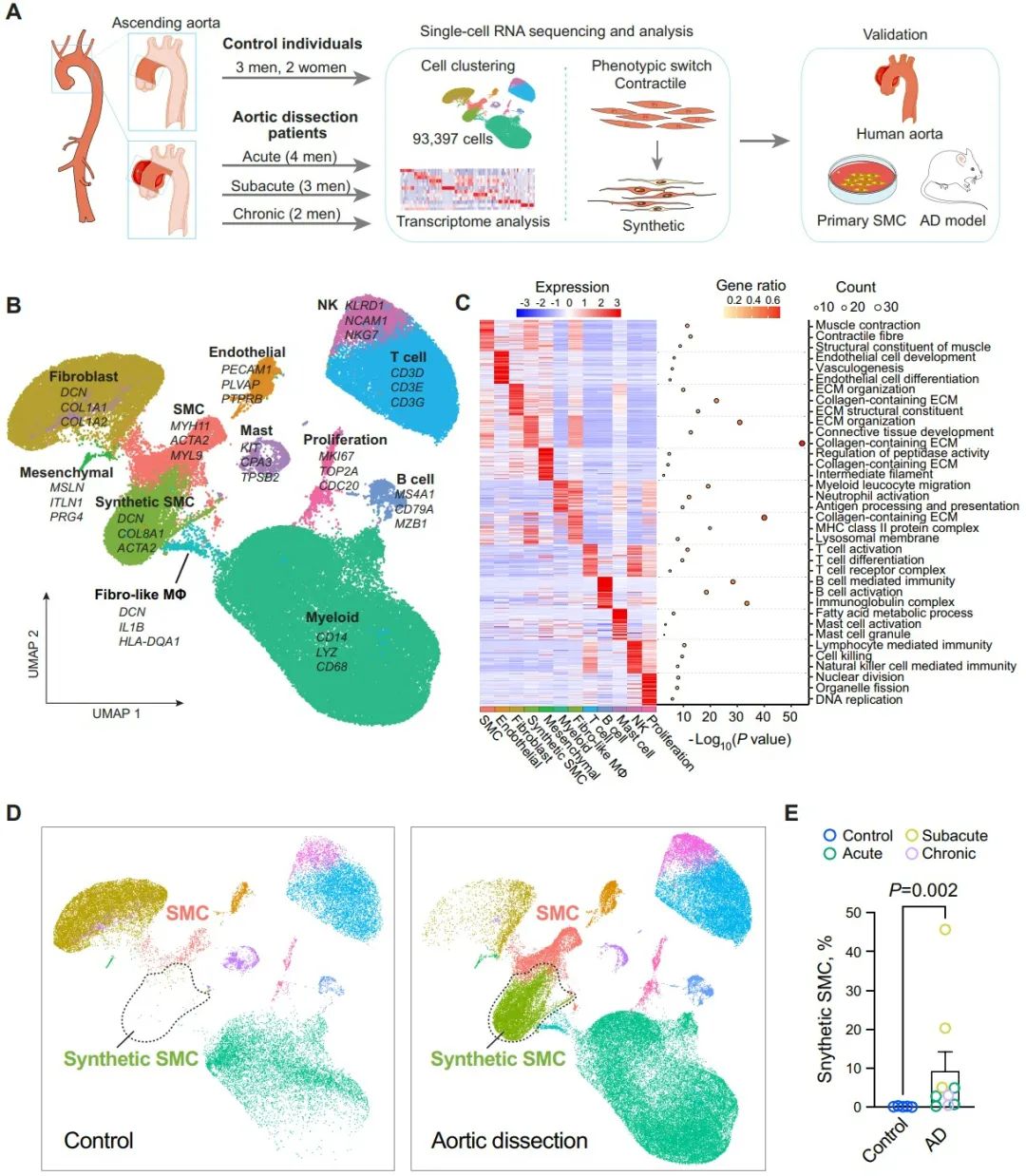
随后,作者通过绘制差异表达的转录因子图谱发现AP-1的多个亚基(包括FOS、FOSB、JUN、JUNB和JUND)在合成型SMC中表达升高,并在AD组织中得到验证。染色质免疫沉淀(ChIP)分析显示,JUN可以结合在COL5A1、COL1A1、COL1A2和ApoE的启动子区。利用AP-1激活剂TPA处理细胞显著上调合成型SMC基因,同时下调收缩型标记基因;而AP-1抑制剂T-5224则出现相反的效果,这都表明AP-1的升高和激活促进了AD中合成型SMC的增加。
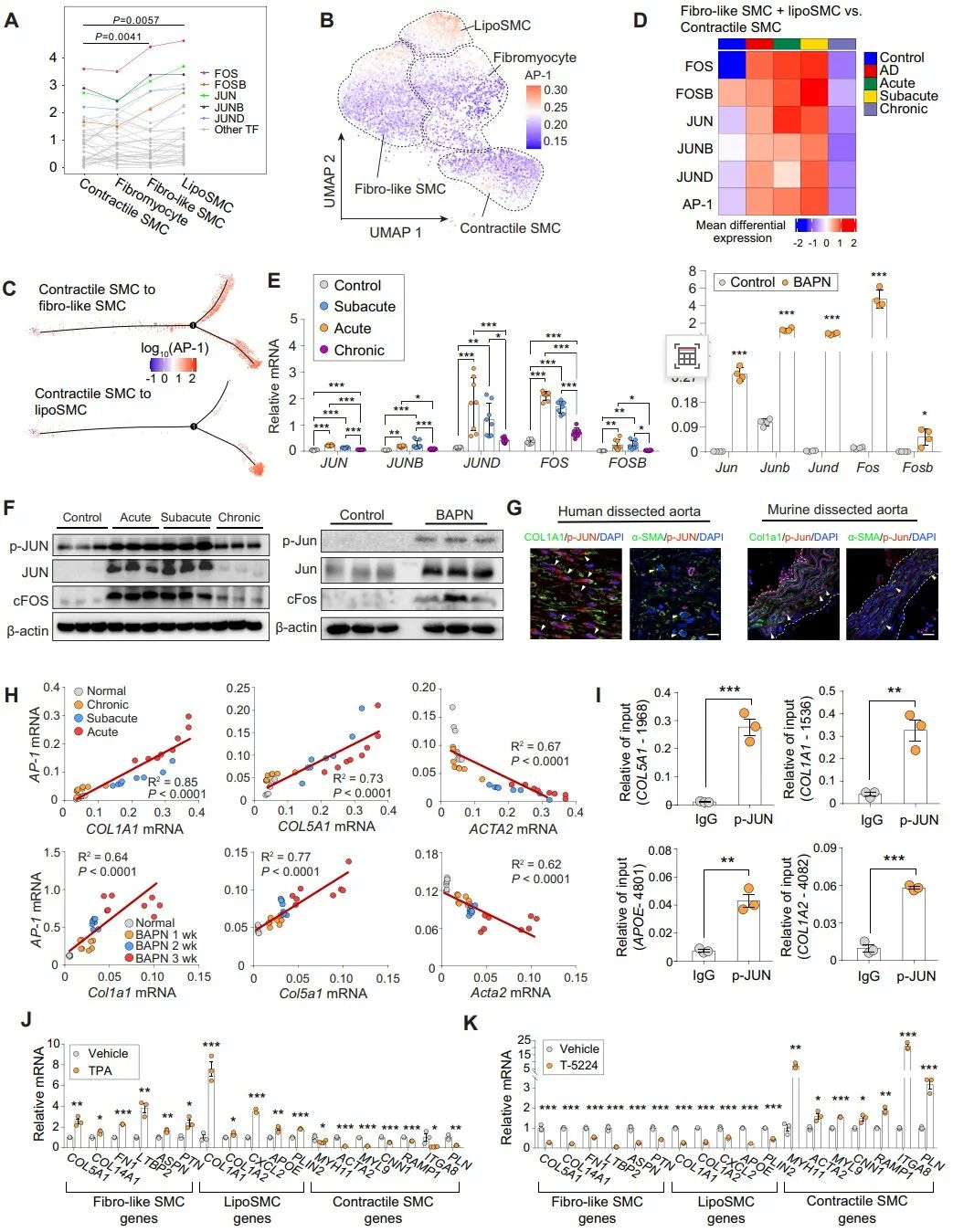
接下来,作者探索了促进AP-1介导的表型转换的上游调节因子。差异表达基因和通路分析显示,与纤维样和脂性SMC相比,收缩型SMC中ATP代谢过程和OXPHOS富集,提示OXPHOS可能负调控合成型SMC的增加。为了验证这一点,作者利用线粒体复合物1特异性抑制剂鱼藤酮处理原代aoSMC细胞,发现其可以显著提高AP-1的表达、磷酸化和核转位。相反,添加辅酶Q10 (CoQ10,一种必需的OXPHOS辅因子)则显示出相反的效果,进一步证实了受损的OXPOS对AP-1激活的必需性。ChIP结果显示,JUN与合成型基因启动子区的结合被鱼藤酮增强,而被辅酶Q10减弱。这些结果都表明OXPHOS的抑制作用于AP-1的上游,促进合成型平滑肌细胞扩增。
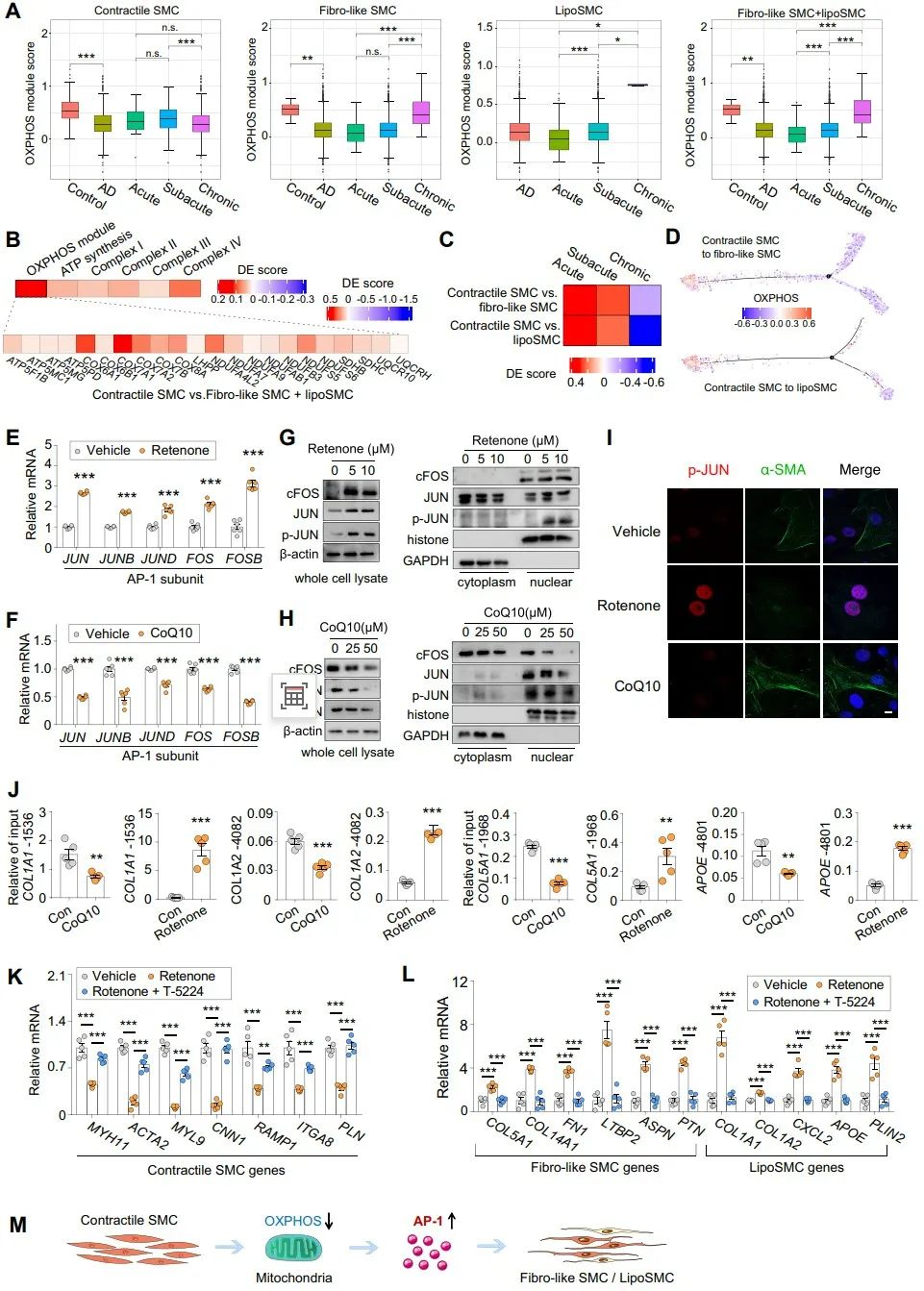
进一步,作者探索了触发OXPHOS–AP-1介导的表型转换的细胞外信号。通过使用CellPhoneDB分析免疫群体(表达TNF配体)与收缩型SMC(表达TNF受体)的TNF配体-受体相互作用,作者发现在急性和亚急性AD中TNF信号的优先相互作用。利用TNF-α处理aoSMC,发现其降低了ATP水平、膜电位和烟酰胺腺嘌呤二核苷酸(NAD+)/烟酰胺腺嘌呤二核苷酸氢(NADH),而辅酶Q10恢复了这些作用。一致地,TNF-α介导的收缩型基因下调和合成型标记物的升高通过与辅酶Q10或AP-1抑制剂共处理而受到抑制。最后,作者通过在小鼠中使用经典的BAPN诱导的TAD模型,进一步确定了该信号通路在体内胸主动脉夹层(TAD)进展中的作用。
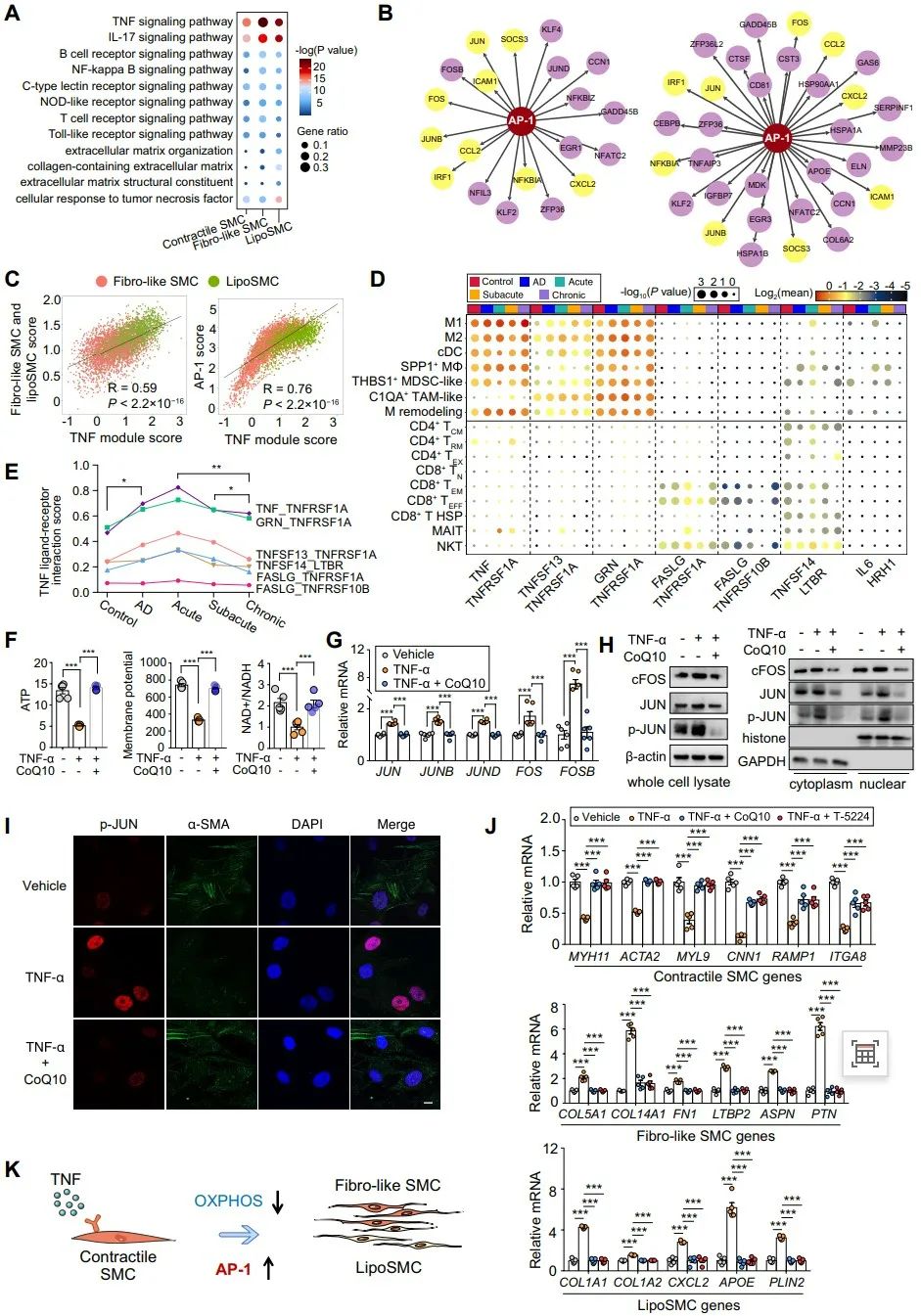
综上所述,TNF信号可以通过抑制OXPHOS和随后的AP-1激活,来促进合成型SMC的增加。同时发现,通过靶向AP-1可以抑制平滑肌细胞的表型转换,从而缓解BAPN诱导的小鼠胸主动脉夹层。
本研究是由中国农业大学和首都医科大学附属北京安贞医院合作完成。中国农业大学的罗永挺教授、罗俊杰教授、安鹏教授、赵文婷博士和首都医科大学附属北京安贞医院的赵远斐副研究员为本文的共同第一作者。中国农业大学任发政院士、郭慧媛教授以及首都医科大学附属北京安贞医院院长张宏家教授、心外科姜文剑教授为本文的共同通讯作者。
原文链接:
https://doi.org/10.1093/eurheartj/ehad534


