【论著】| CDK4/6抑制剂不良反应评估:基于FAERS数据库的真实世界研究
时间:2023-12-03 13:37:03 热度:37.1℃ 作者:网络
[摘要] 背景与目的:细胞周期蛋白依赖性激酶4和6(cyclin-dependent kinase 4/6,CDK4/6)抑制剂的开发和批准是激素受体阳性转移性乳腺癌治疗的一个重要里程碑。这类药物疗效相似,但不良事件(adverse events,AE)各有不同,直接影响临床用药选择。目前关于CDK4/6抑制剂的安全性在真实世界中的系统研究尚不全面。而本研究则通过对美国食品药品管理局(Food And Drug Administration,FDA)不良事件报告系统(FDA Adverse Event Reporting System,FAERS)进行信号挖掘,比较CDK4/6抑制剂AE的差异,发现未知AE信息,旨在为临床治疗方案的选择和AE监测提供参考依据。方法:提取FAERS数据库中2014年第一季度至2023年第一季度的所有数据,去除重复报告后,对将“palbociclib(哌柏西利)”、 “abemaciclib(阿贝西利)”和“ribociclib(瑞波西利)”列为“首要怀疑”的报告,通过比例失衡测量法进行数据分析。本研究采用报告比值比(reporting odds ratio,ROR)法和MHRA法识别信号,阳性信号需要同时满足:报告数≥3、ROR的95%置信区间的下限>1、比例报告比值比(proportional reporting ratios,PRR)>2、χ2>4的标准。结果:研究选出85 562条与CDK4/6抑制剂相关的AE报告。哌柏西利在血液学和淋巴系统AE中信号最强(白细胞减少症ROR=20.01)。在胃肠道系统和肝肾系统中,哌柏西利的AE信号较其他药物低(腹泻ROR=1.95,γ-谷氨酰转移酶升高ROR=0.36,血肌酐升高ROR=1.01)。阿贝西利在胃肠道系统信号最强(腹泻ROR=13.54);在肝肾系统也表现出较强的AE信号(γ-谷氨酰转移酶升高ROR=2.58,血肌酐升高ROR=7.74);在血液和淋巴系统AE信号较其他药物低(白细胞减少ROR=5.34)。瑞波西利在血液和淋巴系统中的AE信号强度低于哌柏西利(白细胞减少症ROR=7.55);但在肝肾系统AE中,瑞波西利的γ-谷氨酰转移酶升高信号强度最高(ROR=4.05)。另外,在罕见严重的肝脏AE中,阿贝西利肝衰竭(ROR=3.50)和药物诱导的肝损伤(ROR=4.68)信号最强。研究还发现多形性红斑(ROR=3.06)是阿贝西利新的AE信号。结论:CDK4/6抑制剂安全性的特点各不相同。对FAERS数据库的分析揭示哌柏西利和瑞波西利有血液和淋巴系统毒性、阿贝西利存在胃肠道毒性和肝毒性。研究同时发现阿贝西利严重AE为多形性红斑。结果提示,治疗期间医疗人员需要依据患者生理状态和药物AE的特点进行个体化用药选择和AE监测。
[关键词] CDK4/6抑制剂;不良事件;FAERS;真实世界;比例失衡法;药物警戒
[Abstract] Background and purpose: The development and approval of inhibitors of cyclin-dependent kinase 4/6 (CDK4/6) is an essential milestone in treating hormone receptor-positive metastatic breast cancer. The efficacy of these drugs is similar, but the adverse events (AE) are different, directly affecting the physician's choice of drug. There is no systematic study on the safety of CDK4/6 inhibitors in the real world. In this study, we compared the differences in AE of CDK4/6 inhibitors through signal mining in the FDA Adverse Event Reporting System (FAERS) and identified unknown AE signals to provide a reference for the clinical choice of treatment and monitoring AE. Methods: All data in the FAERS database were extracted from the first quarter of 2004 to the first quarter of 2023. After removing duplicates, data were analyzed by the disproportionality method for reports ranking palbociclib, abemaciclib, or ribociclib as the primary suspect. Signals were identified using the reporting odds ratio (ROR) and MHRA methods. Positive signals were required to meet the following criteria: the number of reports ≥3, the lower limit of the 95% confidence interval of the ROR >1, proportional reporting ratios (PRR) >2, and the χ2 >4. Results: A total of 85 562 reports of AE associated with CDK4/6 inhibitors were identified. The highest signal intensity of palbociclib was observed in hematologic and lymphatic AE (leukopenia ROR=20.01). Palbociclib had lower AE signals in the gastrointestinal, hepatic, and renal systems than the other drugs (diarrhea ROR=1.95, gamma-glutamyltransferase increased ROR=0.36, blood creatinine increased ROR=1.01). Abemaciclib had the strongest signal in the gastrointestinal system (diarrhea ROR=13.54); it also showed a strong AE signal in the hepatic and renal systems (gamma-glutamyltransferase increased ROR=2.58, blood creatinine increased ROR=7.74) and a lower AE signal than the other drugs in the blood and lymphatic systems (leukopenia ROR=5.34). Ribociclib had a lower AE signal intensity in the blood and lymphatic system than palbociclib (leukopenia ROR=7.55); however, among hepatic AE, ribociclib had the highest signal intensity of increased gamma-glutamyltransferase (ROR=4.05). In rare severe hepatic systemic AE, abemaciclib had the strongest signal in hepatic failure (ROR=3.50) and drug-induced liver injury (ROR=4.68). Erythema multiforme was a newly identified signal in the abemaciclib reports (ROR=3.06). Conclusion: The safety profile of CDK4/6 inhibitors varies. Analysis of the FAERS database revealed hematologic and lymphatic system toxicities for palbociclib and ribociclib and gastrointestinal and hepatorenal toxicities for abemaciclib. Erythema multiforme was found as a novel severe AE for abemaciclib. Individualized drug selection and monitoring of AE based on the patient’s physiological status and AE are needed during treatment.
[Key words] CDK4/6 inhibitors; Adverse events; FAERS; Real world; Disproportionality analysis; Pharmacovigilance
乳腺癌是女性最常见的恶性肿瘤,以激素受体(hormone receptor,HR)阳性、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阴性乳腺癌最为常见,大约占全部乳腺癌的70%[1]。内分泌治疗是早期HR+/HER2-乳腺癌的有效治疗手段。然而对于晚期患者,单纯使用内分泌治疗药物已不足以控制癌症进展[1]。细胞周期蛋白依赖性激酶4和6(cyclin-dependent kinase 4/6,CDK4/6)抑制剂分子靶向药物的应用改变了HR+/HER2-晚期乳腺癌的临床治疗模式,患者的生存也获得了突破性的改善[2]。哌柏西利是第一个进入临床的CDK4/6抑制剂,瑞波西利和阿贝西利紧随其后。中国自主研发的CDK4/6抑制剂达尔西利也于2022年上市。CDK4/6抑制剂中,哌柏西利、瑞波西利、阿贝西利和达尔西利已被国内外指南推荐用于HR+/HER2-乳腺癌女性患者的治疗[3-4]。这类药物耐受性良好,疗效相似,但在不良反的类型和发生频率方面存在一定差异[5-8]。在进行药物选择时,医疗团队需要系统了解CDK4/6抑制剂不良事件(adverse events,AE)的异同,在发挥疗效的同时尽可能减轻AE对患者治疗连续性和生活质量产生的影响。
目前,CDK4/6抑制剂AE的管理主要参考临床试验结果[9-10]。然而受限于受试者严格的入组标准和有限的随访时间,发生率较低的严重AE可能无法在临床试验中充分体现。CDK4/6抑制剂AE的对比研究主要是基于临床试验数据的meta分析,对于真实世界安全性数据的系统研究仍处于初步阶段[5,11-13]。
美国食品药品管理局(Food And Drug Administration,FDA)不良事件报告系统(FDA Adverse Event Reporting System,FAERS)是一个涵盖数千万例药物AE报告的自发报告系统,包括了FDA收集的所有不良事件信息和用药错误信息,为AE的早期识别提供庞大的真实世界数据来源。与PubMed、EMBASE、MEDLINE数据库收录的药品AE相关文献不同,FAERS数据库中的AE信息是以单个病例为单位进行记录及查询,数据更为原始。同时FAERS数据库包含所有美国上市药物的用药详细信息,拥有更广泛的用药人群数据。通过对FAERS中的AE信号进行挖掘,可以及时对临床研发期间未识别的安全信号进行持续的风险管理[14]。
本研究通过对FAERS数据库中CDK4/6抑制剂的相关报告开展数据挖掘,了解真实世界中不同CDK4/6抑制剂AE的异同,探索发现未知的AE和罕见的严重AE信号,从而为CDK4/6抑制剂的选择和长期应用管理提供参考依据。
1 资料和方法
1.1 数据来源
本研究的数据来自FAERS数据库。研究提取2014年第一季度到2023年第一季度的ASCⅡ 数据包的全部信息。所有数据导入到SAS 9.4软件中,按照FDA推荐的去除重复报告方法进行数据清理并开展分析[15]。数据筛选依据FAERS数据库中字段中的“DRUGNAME”进行,筛选 “palbociclib”、“abemaciclib”和“ribociclib” 的报告,并将报告的怀疑程度限定为“首要怀疑(primary suspect)”。截至2023年7月20日,达尔西利(dalpiciclib)在FAERS数据库无不良事件报告,故本研究未对达尔西利开展数据挖掘与分析。
1.2 AE信号检测与分析
FAERS数据库是根据《国际医学用语词典监管活动医学词典》(Medical Dictionary for Regulatory Activities,MedDRA)中的首选术语(preferred term,PT)进行描述的。PT术语可以归属于3个层级,其中最高层级为系统器官分类(system organ classification,SOC)。FAERS数据库中AE信号的检测通常使用比例失衡测量法(disproportionality analysis,DPA),通过比较指定药物与所有其他药物之间发生AE的比例,从而识别AE的信号[16]。研究采用报告比值比(reporting odds ratio,ROR)法和综合标准法(Medicines and Health care Products Regulatory Agency,MHRA)对CDK4/6抑制剂的AE信号进行检测,具体计算方法见表1[17]。MHRA法参考比例报告比值比(proportional reporting ratio,PRR)、χ2以及报告数3个指标对AE信号进行评价。为避免假阳性信号的出现,阳性AE信号的判断应同时满足ROR法阳性:ROR的95%置信区间(95% confidence interval,95% CI)的下限(ROR025)>1和MHRA法阳性:报告数≥3、PRR>2、χ2>4。ROR值越大表示信号越强,说明药物与AE的相关性越强。CDK4/6抑制剂报告中罕见严重AE的筛选是依据欧盟发布的指定医疗事件(designated medical event,DME)清单[18]进行。

2 结 果
2.1 CDK4/6抑制剂AE报告的人口统计学信息
本研究通过图1所示的数据处理流程,2014年1月—2023年3月共计筛选出85 562条与CDK4/6抑制剂相关的AE报告,人口统计学信息见表2。在这些报告中,哌柏西利报告AE数目最多,其次是瑞波西利,阿贝西利报告AE数量最少。超过半数报告的患者年龄在60岁以上。从报告来源来看,消费者自主报告占比最高(41.98%),其次是药师(26.62%),医师(15.12%)次之。来自中国的报告占数据库的极少部分(0.92%)。严重AE报告占据43.29%,主要临床结局是住院(15.11%)和死亡(13.33%)。AE的中位开始时间:阿贝西利<瑞波西利<哌柏西利。
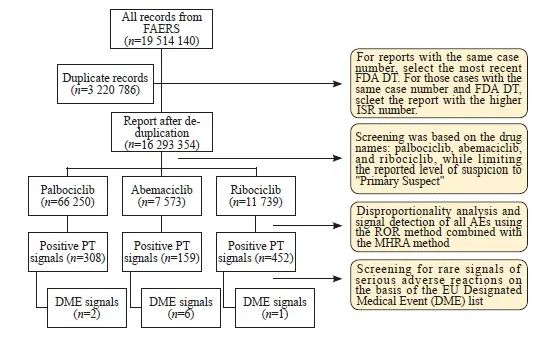
图1 FAERS数据库中CDK4/6抑制剂相关报告的筛选和分析流程
Fig. 1 Flowchart for screening and data analysis of reports related to CDK4/6 inhibitors in the FAERS database
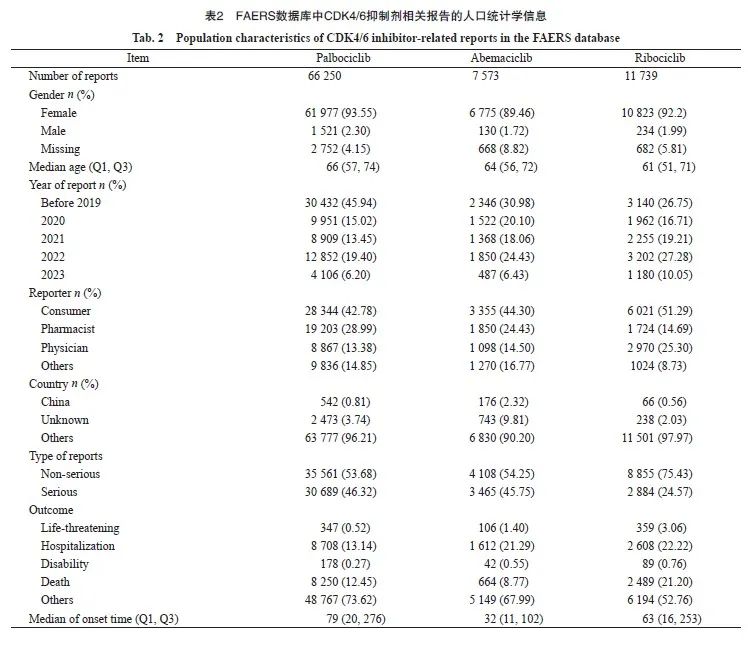
2.2 CDK4/6抑制剂AE信号在各系统器官中的分布
将AE信号按SOC进行分类,三种CDK4/6抑制剂的报告数量、信号强度及分布情况见图2。哌柏西利在全身性疾病及给药部位各种反应的报告最多(N=38 045),血液及淋巴系统疾病信号最强(ROR=2.79)。阿贝西利在胃肠系统疾病的报告最多(N=4 106)且信号最强(ROR=3.86)。瑞波西利在全身性疾病及给药部位各种反应的报告最多(N=8 917),在良性、恶性及性质不明的肿瘤的信号最强(ROR=4.59)。
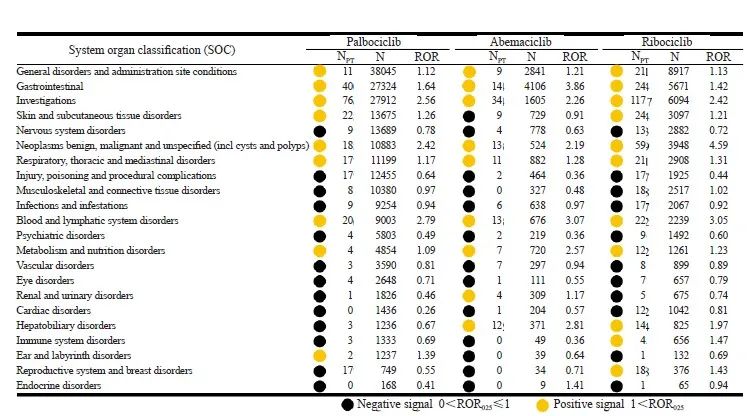
图2 CDK4/6抑制剂AE在不同系统器官中的分布情况
Fig. 2 Distribution of AE of CDK4/6 inhibitorin different systemic organs
NPT represented the number of PTs that generate a signal under the ROR combined with MHRA method; ROR025 represented the lower limit of the 95% confidence interval of ROR.
2.3 CDK4/6抑制剂AE信号在PT层级的分析
研究对所有信号在PT层级进行分析,将出现频率最高的前30个信号检测结果见表3。死亡、与恶性肿瘤相关的AE、COVID-19等相关PT不纳入分析。研究在哌柏西利报告中发现听觉减退、免疫系统紊乱、淋巴水肿、指甲折断或改变等新AE信号。在阿贝西利报告中发现上腹痛、口腔黏膜炎等新AE信号。在瑞波西利报告中发现免疫反应降低、胸腔积液等新AE信号。
CDK4/6抑制剂在重点器官中常见的AE信号检测结果见图3~6。哌柏西利和瑞波西利在血液和淋巴系统的信号强度较高。哌柏西利在白细胞减少症(ROR=20.01)和红细胞减少症(ROR=13.84)中信号最强。而阿贝西利在胃肠道和营养系统中具有更高的信号强度,以腹泻(ROR=13.54)的信号最强。在肝肾系统AE中,瑞波西利和阿贝西利均有较高肝功能相关信号。瑞波西利在丙氨酸氨基转移酶升高的信号最强(ROR=3.70)。阿贝西利在血肌酐升高下的信号强度最高(ROR=7.74)。在全身性AE中,哌柏西利的疲乏的信号强度最高(ROR=4.59)。

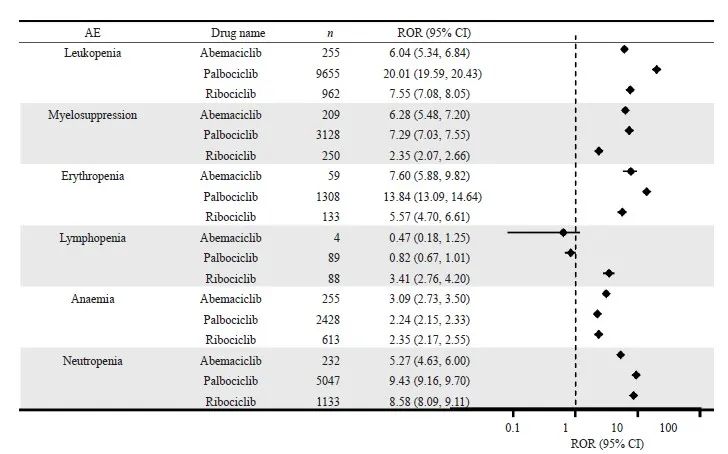
图3 CDK4/6抑制剂的血液和淋巴系统AE信号检测
Fig. 3 Signal detection of hematologic and lymphatic AEs of CDK4/6 inhibitors
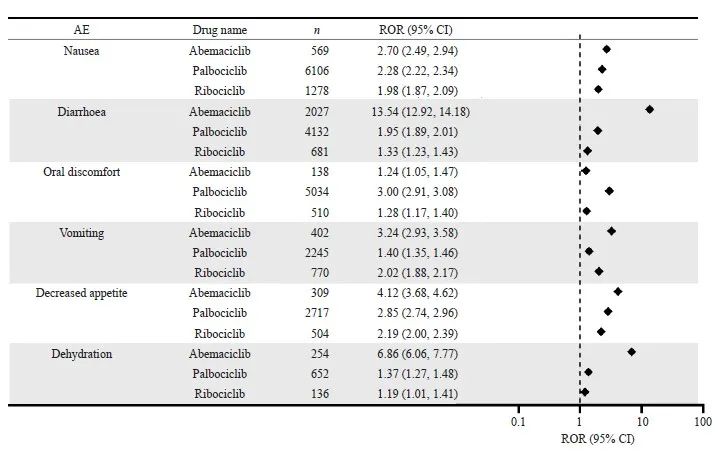
图4 CDK4/6抑制剂在胃肠道系统和营养系统的AE信号检测
Fig. 4 Signal detection of adverse events in the gastrointestinal and nutritional systems of CDK4/6 inhibitors
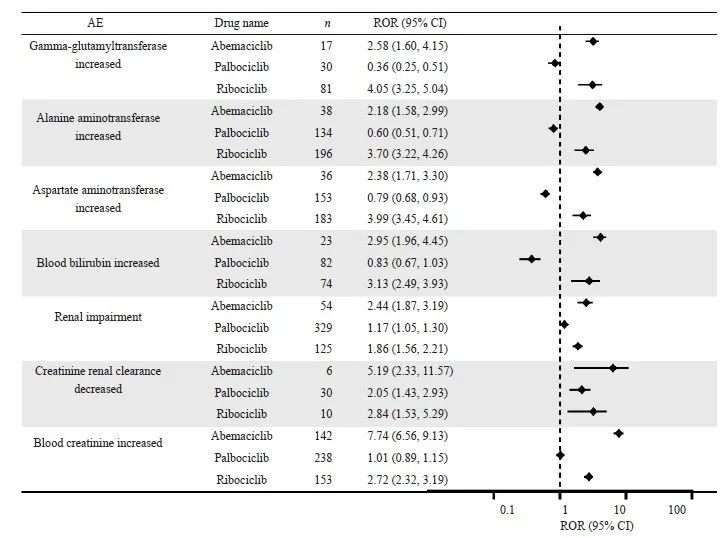
图5 CDK4/6抑制剂的肝肾系统AE的信号检测
Fig. 5 Signal detection of AEs in the hepatic and renal systems of CDK4/6 inhibitors
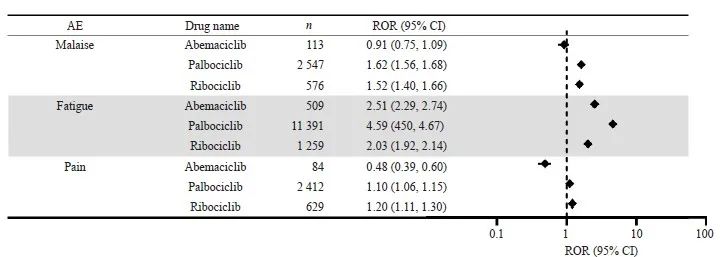
图6 CDK4/6抑制剂的全身性AE信号检测
Fig. 6 Signal detection of systemic AEs of CDK4/6 inhibitors
2.4 罕见且严重AE信号在CDK4/6抑制剂中的分布情况
研究对出现阳性信号的DME进行统计(图7)。肝胆系统相关DME中,阿贝西利的信号强度高于瑞波西利。在血液及淋巴系统相关的DME中,哌柏西利的骨髓功能衰竭(ROR=11.64)信号强于阿贝西利(ROR=2.05);哌柏西利(ROR=2.01)和瑞波西利(ROR=2.02)在全血细胞减少症的信号强度相当。多形性红斑(ROR=3.06)是阿贝西利的新DME信号。
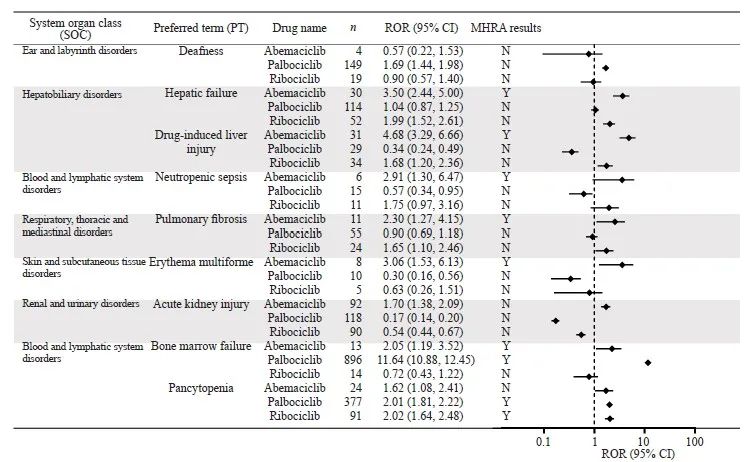
图7 CDK4/6抑制剂DME信号的检测结果
Fig. 7 Detection of CDK4/6 inhibitor designated medical event (DME) signals
A lower limit of the 95% confidence interval (95% CI) of the ROR value greater than 1 generated a signal of an adverse reaction. A PT with signals under both the MHRA and the ROR methods was considered a signal of a DME; N: No; Y: Yes.
3 讨 论
CDK4/6抑制剂的问世为乳腺癌的治疗提供更多可选方案。在对这些药物进行治疗决策评估时,安全性仍是医疗人员和患者关注的关键问题。研究反映真实使用环境下CDK4/6抑制剂的AE特征,从而有助于医师在药物选择时作出更为全面和准确的判断。通过研究分析可知,CDK4/6抑制剂的AE在实际临床实践中表现十分广泛,涉及到多个系统器官。研究对FAERS数据库中哌柏西利、阿贝西利和瑞波西利的AE信号进行比对分析,从常见AE和罕见严重AE两个方面充分了解这3个药物安全性的异同。对照药品说明书,所有说明书提及的AE均在本次数据挖掘中发现。常见AE在本研究中均表现出较高的信号强度,其中以哌柏西利和瑞波西利的血液及淋巴系统AE,阿贝西利的胃肠道系统AE最为明显。
3种CDK4/6抑制剂在血液和淋巴系统AE中均有信号。然而在信号强度方面,阿贝西利明显低于其他两个药物。依据分子机制,3种药物对CDK4和CDK6的选择性不同,阿贝西利对CDK4的选择性最强,效价最高,故血液学毒性较另外两个药物小[19-20]。这一点在既往研究中也得以证实[5-6]。哌柏西利的信号最强,且研究发现骨髓功能衰竭信号,这提示在临床工作中需格外关注发生血液学AE的哌柏西利用药患者,警惕病情加重。对于高风险患者,如需继续使用CDK4/6抑制剂,可考虑将阿贝西利作为备选方案。然而,阿贝西利在贫血、骨髓抑制中也表现出与哌柏西利相近的信号强度,其血液学毒性也不可轻视。
阿贝西利的AE主要发生在胃肠道系统,以腹泻为代表。信号对比显示,与其他药物相比,阿贝西利发生胃肠道AE的风险最高,这一点与已发表的研究[21]结果一致。在分子机制方面,阿贝西利的胃肠道毒性可能与其脱靶效应有关,与对CDK4/6的抑制作用无关。阿贝西利抑制肠道高表达的GSK3β(与肠上皮细胞增殖和分化密切相关),导致肠上皮细胞分化不良,这一效应在阿贝西利对CDK9的抑制下放大,从而使其表现出不同于其他两个药物的胃肠道毒性[22]。因此在治疗选择中,对于阿贝西利胃肠道不耐受的患者,除了降低给药剂量和对症处理外,还可以考虑换用另两个药物。值得注意的是,哌柏西利在口腔炎中的信号较高。口腔炎的发生会对患者生活质量和用药依从性造成一定影响,在临床中也需要引起注意。
肝脏系统AE可表现为实验室检查指标上升到肝衰竭等多种形式。本研究发现,不论是转氨酶增加和胆红素上升这类常见AE,还是肝衰竭和药物诱导的肝损伤这类严重AE,瑞波西利和阿贝西利均存在一定风险,哌柏西利则相对安全,这一趋势也在其他研究中发现[5]。考虑到严重肝毒性会带来致命后果,医疗团队需要对使用阿贝西利或瑞波西利的患者进行肝功能指标和体征的定期监测。目前CDK4/6抑制剂肝毒性的发生机制尚不明确。对已发生肝脏AE的用药患者,是否可换用其他CDK4/6抑制剂进行治疗还不确定,未来仍需要对CDK4/6抑制剂的肝毒性机制开展进一步研究。
在肾脏系统AE方面,阿贝西利的信号最强,以血肌酐值升高为代表。既往研究证明这一现象与阿贝西利对肾小管的抑制有关,但肾小球滤过率实际并未受到影响[23]。这提示当使用阿贝西利的患者出现血肌酐升高时,不能直接将其视为肾功能损害。为加以区分,临床还需参考肾功能替代测量的结果。对于肾功能没有受损的轻度肌酐上升的患者,阿贝西利仍可继续使用。
除常见AE外,本研究对罕见却可能导致严重后果的AE信号进行探究分析。在“耳聋”信号检测中,哌柏西利的ROR信号为阳性,但MHRA信号为阴性,故未将耳聋视为哌柏西利的AE。然而,直到2023年第一季度,FAERS数据库中已有149例报告将哌柏西利列为耳聋的首要怀疑因素,且听觉减退也是出现频率较高的新AE信号。考虑研究数据中近半数报告来自60岁以上的群体,这类人群本身容易出现听力下降等退行性生理改变,我们无法排除生理因素对听觉系统的影响。但这个结果提醒在临床随访过程中,医疗团队需要留意患者听力水平的改变,评估是否与用药相关。进一步开展相关机制研究,探究哌柏西利与听觉功能改变之间是否存在内在联系。
研究[24]还发现多形性红斑是阿贝西利的罕见AE信号,这一AE已有相关病例报道,表现为面部、口咽部、四肢末端出现水疱伴黏膜损害,严重威胁患者生命。这提示在临床工作中,不仅需要关注常见AE,也需要对罕见的AE保持警觉,及时干预。
本研究存在一定的局限性。研究数据来源于自发呈报数据库,存在一些已知的偏差,包括漏报、重复、刺激报告等因素引起的混淆,数据的质量及完整性存在一定不足[14]。同时,FAERS数据库的报告主要来自欧美国家,来自亚洲人群的数据占比较低,因此研究结果可能与中国的实际情况有所差异,但大样本的挖掘对药物的安全合理使用仍有警示作用。所有的信号检测结果只能提示存在统计学相关性,是否存在真正的因果关系还需要进一步的评估和研究。此外,信号强度仅代表风险的相对大小,不能对绝对风险进行量化。后续研究中,还需要基于本研究发现的AE信号,开展更多高质量研究,以明确各AE在真实用药环境下的发生率。
除阿贝西利、哌柏西利和瑞波西利外,由国内自主研发的新型CDK4/6抑制剂达尔西利也于2022年进入临床使用。由于达尔西利未在其他国家上市,其AE信息未被FAERS数据库收录,故本研究未涉及。根据已发表的Ⅲ期临床试验结果,达尔西利在中国人群耐受性良好,最常见AE为血液学AE,最常见的3~4级AE是NEU减少(84.3%)和白细胞减少(60.1%)[25-26]。同时,由于达尔西利引入了哌啶结构,消除了谷胱甘肽捕获风险,降低了潜在的肝毒性,3级及以上的AST升高比例为0.4%(3级以上ALT升高比例为0%)。相对于其他CDK4/6抑制剂,达尔西利未观察到严重腹泻情况,心脏毒性风险低[26]。由于达尔西利上市时间较短,来自大规模人群的AE数据尚不明确。在后续的研究中,研究者还需要进一步纳入达尔西利的使用人群。通过开展真实世界研究,发现达尔西利的未知AE信号,从而更全面地了解达尔西利的AE,协助临床进行AE监测管理与治疗方案选择。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1]HUPPERT L A, GUMUSAY O, IDOSSA D, et al. Systemic therapy for hormone receptor-positive/human epidermal growth factor receptor 2-negative early stage and metastatic breast cancer[J]. CA Cancer J Clin, 2023, 73(5): 480-515.
[2]WU Y M, ZHANG Y, PI H, et al. Current therapeutic progress of CDK4/6 inhibitors in breast cancer[J]. Cancer Manag Res, 2020, 12: 3477-3487.
[3]中华人民共和国国家卫生健康委员会. 乳腺癌诊疗指南(2022年版)[J]. 中国合理用药探索, 2022, 19(10): 51. National Health Commission of the People's Republic of China. Guidelines for the diagnosis and treatment of breast cancer (2022 edition)[J]. China Licens Pharm, 2022, 19(10): 51.
[4]GRADISHAR W J, MORAN M S, ABRAHAM J, et al. Breast cancer, version 3.2022, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2022, 20(6): 691-722.
[5]ONESTI C E, JERUSALEM G. CDK4/6 inhibitors in breast cancer: differences in toxicity profiles and impact on agent choice. A systematic review and meta-analysis[J]. Expert Rev Anticancer Ther, 2021, 21(3): 283-298.
[6]GRINSHPUN A, TOLANEY S M, BURSTEIN H J, et al. The dilemma of selecting a first line CDK4/6 inhibitor for hormone receptor-positive/HER2-negative metastatic breast cancer[J]. NPJ Breast Cancer, 2023, 9(1): 15.
[7]GAO J J, CHENG J, BLOOMQUIST E, et al. CDK4/6 inhibitor treatment for patients with hormone receptor-positive, HER2-negative, advanced or metastatic breast cancer: a US Food and Drug Administration pooled analysis[J]. Lancet Oncol, 2020, 21(2): 250-260.
[8]SCHETTINI F, GIUDICI F, GIULIANO M, et al. Overall survival of CDK4/6-inhibitor-based treatments in clinically relevant subgroups of metastatic breast cancer: systematic review and meta-analysis[J]. J Natl Cancer Inst, 2020, 112(11): 1089-1097.
[9]THILL M, SCHMIDT M. Management of adverse events during cyclin-dependent kinase 4/6 (CDK4/6) inhibitor-based treatment in breast cancer[J]. Ther Adv Med Oncol, 2018, 10: 1758835918793326.
[10]国家肿瘤质控中心乳腺癌专家委员会, 中国抗癌协会肿瘤药物临床研究专业委员会, 徐兵河, 等. CDK4/6抑制剂治疗激素受体阳性人表皮生长因子受体2阴性晚期乳腺癌的临床应用共识[J]. 中华肿瘤杂志, 2021, 43(4): 405-413.Breast Cancer Expert Committee of National Cancer Quality Control Center, Cancer Drug Clinical Research Professional Committee of China Anti-Cancer Association, XU B H, et al. Consensus recommendations for the clinical application of CDK4/6 inhibitors in patients with hormone receptor positive, human epidermal growth factor receptor 2 negative advanced breast cancer[J]. Chin J Oncol, 2021, 43(4): 405-413.
[11]DESNOYERS A, NADLER M B, KUMAR V, et al. Comparison of treatment-related adverse events of different cyclin-dependent kinase 4/6 inhibitors in metastatic breast cancer: a network meta-analysis[J]. Cancer Treat Rev, 2020, 90: 102086.
[12]RASCHI E, FUSAROLI M, ARDIZZONI A, et al. Cyclin-dependent kinase 4/6 inhibitors and interstitial lung disease in the FDA adverse event reporting system: a pharmacovigilance assessment[J]. Breast Cancer Res Treat, 2021, 186(1): 219-227.
[13]RASCHI E, FUSAROLI M, LA PLACA M, et al. Skin toxicities with cyclin-dependent kinase 4/6 inhibitors in breast cancer: signals from disproportionality analysis of the FDA adverse event reporting system[J]. Am J Clin Dermatol, 2022, 23(2): 247-255.
[14]SAKAEDA T, TAMON A, KADOYAMA K, et al. Data mining of the public version of the FDA Adverse Event Reporting System[J]. Int J Med Sci, 2013, 10(7): 796-803.
[15]Administration USDO. FDA Adverse Event Reporting System (FAERS) quarterly data extract files [EB/OL] (2023-04-27)[2023-7-14]. https://fis.fda.gov/extensions/FPD-QDE-FAERS/FPD-QDE-FAERS.html.
[16]CANDORE G, JUHLIN K, MANLIK K, et al. Comparison of statistical signal detection methods within and across spontaneous reporting databases[J]. Drug Saf, 2015, 38(6): 577-587.
[17] 尚鹏辉, 詹思延. 数据挖掘在药品不良反应信号检出和分析中的应用(下): 药物流行病学研究新方法系列讲座
(三)[J]. 中国药物应用与监测, 2009, 6(3): 187-190.
HANG P H, ZHAN S Y. Application of data excavation in the signal detection and analysis of adverse drug reactions(third)[J]. Chin J Drug Appl Monit, 2009, 6(3): 187-190.
[18] Agency EM. Designated Medical Event (DME) list [EB/OL] (2020-06-15)[2023-7-14]. https://www.ema.europa.eu/documents/other/designated-medical-event-dme-list_en.xls.
[19] BRAAL C L, JONGBLOED E M, WILTING S M, et al. Inhibiting CDK4/6 in breast cancer with palbociclib, ribociclib, and abemaciclib: similarities and differences[J]. Drugs, 2021, 81(3): 317-331.
[20] WANDER S A, O'BRIEN N, LITCHFIELD L M, et al. Targeting CDK4 and 6 in cancer therapy: emerging preclinical insights related to abemaciclib[J]. Oncologist, 2022, 27(10): 811-821.
[21] LI J, FU F M, YU L W, et al. Cyclin-dependent kinase 4 and 6 inhibitors in hormone receptor-positive, human epidermal growth factor receptor-2 negative advanced breast cancer: a meta-analysis of randomized clinical trials[J]. Breast Cancer Res Treat, 2020, 180(1): 21-32.
[22] THIBAULT S, HU W Y, HIRAKAWA B, et al. Intestinal toxicity in rats following administration of CDK4/6 inhibitors is independent of primary pharmacology[J]. Mol Cancer Ther, 2019, 18(2): 257-266.
[23] CHAPPELL J C, TURNER P K, PAK Y A, et al. Abemaciclib inhibits renal tubular secretion without changing glomerular filtration rate[J]. Clin Pharmacol Ther, 2019, 105(5): 1187-1195.
[24] VRANA E, MYLONA S, BOBOS M, et al. Ribociclib and palbociclib-induced erythema multiforme: a case report[J]. Oxf Med Case Reports, 2022, 2022(11): omac116.
[25] ZHANG P, ZHANG Q Y, TONG Z S, et al. Dalpiciclib plus letrozole or anastrozole versus placebo plus letrozole or anastrozole as first-line treatment in patients with hormone receptor-positive, HER2-negative advanced breast cancer (DAWNA-2): a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial[J]. Lancet Oncol, 2023, 24(6): 646-657.
[26] XU B H, ZHANG Q Y, ZHANG P, et al. Dalpiciclib or placebo plus fulvestrant in hormone receptor-positive and HER2-negative advanced breast cancer: a randomized, phase 3 trial[J]. Nat Med, 2021, 27(11): 1904-1909.


