“绘”解读真报告丨结直肠癌检出不同基因胚系突变,遗传性检测别只关注林奇综合征
时间:2023-12-05 16:33:40 热度:37.1℃ 作者:网络
随着生活水平和检测技术的进步,遗传性肿瘤基因检测也备受关注。在2023年CSCO结直肠癌诊疗指南“遗传性结直肠癌筛检和基因诊断原则”中,明确所有结直肠癌患者需进行林奇综合征遗传基因筛检,并给出林奇综合征的筛查流程,即通过错配修复缺陷(MMR)基因胚系检测评估确诊(图1)。
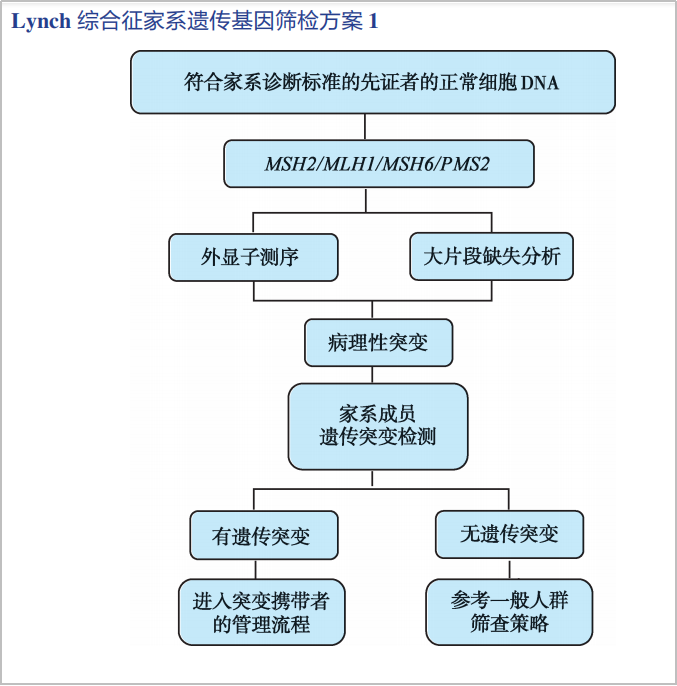
图1.CSCO指南林奇综合征家系遗传基因筛检方案
除了MMR基因之外,越来越多的基因也被证实会提高结直肠癌的发生风险,提示肠癌仍需关注更多遗传性基因的检测。从这个角度出发,回顾我司近期接收的结直肠癌患者中检出的CHEK2、BRIP1、PALB2等胚系基因突变,予以解读。
案例一
患者信息:男、82岁
临床诊断:结肠癌
送检样本:石蜡切片+对照外周血
检测项目:肠癌129基因检测
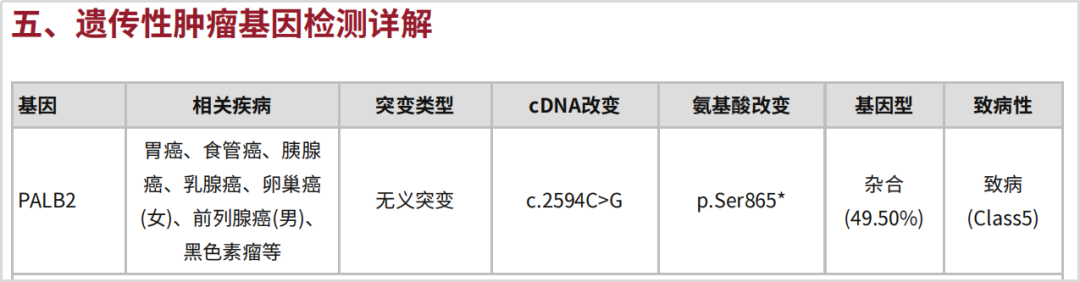
PALB2基因位于16号染色体短臂(16p12.2),全长38kb,包含13个外显子,编码肿瘤抑制蛋白Palb2。PALB2基因胚系突变研究多聚焦于最常发生的乳腺癌。国内研究数据显示[1],中国健康人群中PALB2致病性胚系突变的频率仅为0.19%,但在年龄≤30岁的女性乳腺癌患者中,PALB2突变的频率高达1.85%[3]。这也解释了胚系突变使携带者过早地患癌的现象。
关于PALB2与结直肠癌,早在2017年,丹娜法伯癌症中心发表在JAMA上的研究,在680名肠癌患者中检出了3例PALB2胚系突变的患者,肠癌患者中PALB2胚系突变的比例是正常人的4.91倍,而ATM基因突变为2.81倍[2]。在2022年ESMO年会上,保定市第一医院通过3880例实体瘤样本分析了PALB2基因胚系突变在实体瘤中的发生现状[3],在478例结直肠癌患者中发现19例(4.0%)携带PALB2胚系突变,PALB2突变可作为对PARP抑制剂或基于铂类化疗的预测生物标志物,肯定了同源重组修复缺陷基因的异病同治。
在预后上,复旦大学中山医院的研究表明PALB2基因变异和蛋白表达缺失是结直肠癌患者的预后不良因素[4],在对118例复发或转移的晚期结直肠癌患者的预后跟踪,曲线分析显示相比PALB2基因正常的患者,表明PALB2基因突变患者的无疾病生存期(DFS)和总生存期(OS)显著缩短,是预后不良的标志物(图2)。
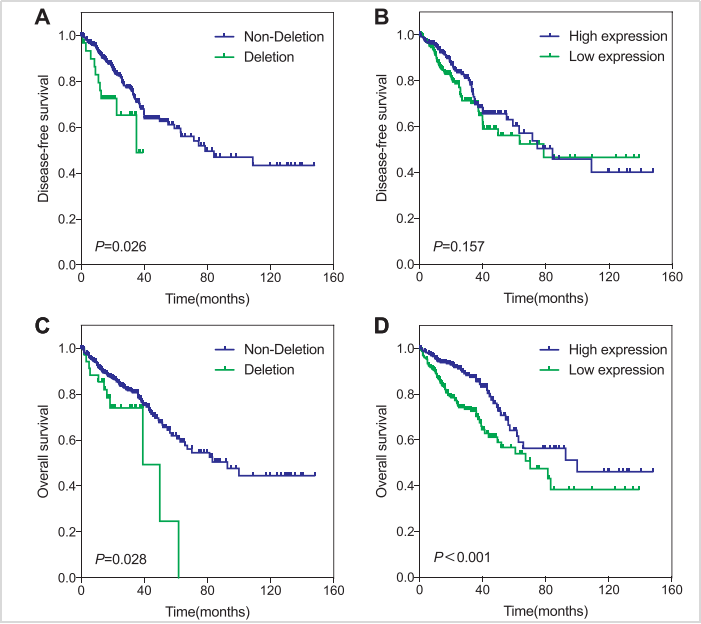
图2. PALB2状态与结直肠癌患者DFS和OS的生存曲线图
因此,通过荟萃文献总结出,直肠癌患者检出PALB2基因胚系突变的比例要高于正常人群,PALB2胚系突变的检出,不仅能够明确遗传因素,还能够在PARP抑制剂靶向治疗和患者预后上提供指导帮助。然而,也有研究提到PALB2胚系突变可能与结直肠癌的发生风险无必然联系[5],这需要更多的研究探索证实。
案例二
患者信息:女、60岁
临床诊断:结肠中低分化腺癌
送检样本:腹水+对照外周血
检测项目:实体瘤201基因(PLUS)检测

CHEK2基因,又称细胞周期调定点激酶基因2,它是一种编码丝氨酸/苏氨酸激酶的肿瘤抑制基因,通过ATM-CHK2-p53通路的DNA损伤反应来参与DNA修复、细胞周期调节和细胞凋亡,进而抑制肿瘤的发生发展。
在NCCN指南《遗传/家族高风险评估:结直肠》中,将CHEK2基因确认为结直肠癌发生风险基因,预计风险值为5%—10%。指南参考British Journal of Cancer(IF=8.8)上的一篇大型临床研究[6],纳入5953例患者,包括2012例乳腺癌,2007例前列腺癌和1934例结肠癌患者,分析533例检出CHEK2阳性,以及431例受影响的亲属。最终确定了CHEK2致病性突变与结直肠癌发生风险具有显著关系,而且亲属的癌症类型往往受先证者影响,例如,结肠癌的亲属中结肠癌的风险要高于前列腺或乳腺癌患者(HR,4.2;95%CI;95%CI,2.4-7.8;P =0.0001)。指南也建议,携带CHEK2胚系突变且无CRC个人史应每5年进行一次结肠镜检查,起始于40岁或早于一级亲属确诊年龄10年前。为CHEK2胚系突变家系结直肠癌亲属的筛查做出了指导(图3)。

图3.摘自NCCN指南《遗传/家族高风险评估:结直肠》
在治疗上,发表在World J Gastroenterol上的一篇文献介绍了两位CHEK2胚系突变肠癌患者(图4),可供参考[7]。
患者1为58岁男性,诊断为转移性乙状结肠癌,淋巴结组织活检显示KRAS、NRAS和BRAF均为阴性,化疗4年后发生肺转移,再次NGS多基因检测检出了8个基因突变,其中CHEK2基因Arg117Gly突变为胚系致病性变异,由于属于HRR基因。患者随后超适应症服用奥拉帕利,一个月后,患者主诉咳嗽和呼吸困难缓解,3个月后,患者癌胚抗原水平降低(57 ng/ml至25 ng/ml),肿瘤缩小且体重增加6公斤。展现出了良好的治疗疗效,实现了获益。
患者2为一位49岁女性肠癌患者伴随多发转移,携带KRAS G12D突变,先用12个周期的FOLFIRINOX联合贝伐珠单抗方案,后续检出RAD51C(T287A)突变,该基因与CHEK2一样也被证明为HRR基因。采用奥拉帕利治疗3个月后,但CT显示出肿瘤进展,疗效并不好,随后终止奥拉帕利使用。究其原因,分析发现患者同步携带的TP53BP1基因变异,证实为奥拉帕利的耐药突变。

图4. 两位患者在奥拉帕利用药3个月后病灶变化
文章也提到PARP抑制剂的耐药机制包括:BRCA基因回复突变,MDR1基因表达、TP53BP1缺失突变等。因此,在治疗指导上,奥拉帕利的使用也应关注耐药机制的评估。综合基因突变和患者的病情指导最佳用药方案。
除了结直肠癌之外,CHEK2基因胚系突变与肺癌的遗传风险也应该受到关注,可以参考:一例多原发性胚系CHEK2突变的肺癌患者
案例三
患者信息:男、72岁
临床诊断:直肠癌伴肝转移
送检样本:石蜡切片+对照外周血
检测项目:实体瘤全景680基因检测

BRIP1基因,也称为乳腺癌基因相互作用蛋白1(BRIP1),用于DNA修复和染色体稳定性的维护,与BRCA1/2基因一样,属于同源重组修复(HRR)基因。BRIP1突变会导致DNA损伤修复机制的缺陷,进而导致癌症的发生。在《遗传性妇科肿瘤高风险人群管理专家共识》中明确指出,BRIP1致病性胚系突变携带者卵巢癌的相对风险(RR)增加8-11倍[8],但在结直肠癌患者中的数据比较少。
2021年,有研究通过两个BRIP1胚系突变的肠癌家系分析发现,BRIP1胚系突变确实会增加罹患结直肠癌的风险,并且这种风险处于中度外显水平[9]。
加利福尼亚大学在2019年发表了BRIP1基因在结直肠癌中的首篇报道[10],介绍了两位携带BRIP1基因胚系突变的结肠癌患者,实现了遗传和诊治双评估。
患者1是一位52岁的乙状结肠癌患者,具有兄弟肺癌,祖父前列腺癌,祖母双侧乳腺癌的家族史,并无结肠癌家族史。肠镜活检结果显示为中度分化腺癌,随后接受手术。经NGS检测检出体细胞突变BRIP1 P619fs*20;TP53 783-2A>G: CDK8扩增和 APC E1295*,林奇综合征相关基因和蛋白无异常。随后检出BRIP1基因12号外显子c.853_1854lnsG胚系杂合突变。患者疾病发展至IIIB期,接受FOLFOX辅助化疗。化疗结束后6个月,发现腹膜和左侧卵巢有转移。她接受了HIPEC手术、腹膜切除术和双侧输卵管卵巢切除术。随后接受了8个周期的化疗FOLFIRI,但1年后出现了肺转移和胸腔积液。随后患者又接受6个周期FOLFOX联合贝伐珠单抗的治疗,且仍在持续。
患者2是一位62岁女性,接受肠镜检查确诊升结肠癌,具有多位肠癌患者家族史。携带BRIP1基因19号外显子c.2962deIT(S988 fs)胚系突变,以及AKT1等基因突变。患者后续确诊为肠癌肝转移,后期接受了12个周期的FOLFOX化疗。两年后,肝部病灶复发。肝部切除并辅以八个周期的FOLFOX辅助化疗,复查无复发。

图5. 两例BRIP1胚系突变的结肠癌患者报道
为什么结直肠癌需要检测更多的遗传性基因?
除了CHEK2、BRIP1和PALB2基因之外,仍有更多的胚系基因突变影响着结直肠癌的遗传性。例如,2022年,梅奥诊所在Clinical Gastroenterology and Hepatology(IF=12.6)上发表的研究[11],纳入了361例未选择年龄和家族史的结直肠癌患者进行NGS测序,结果在15.5%(N=56)的患者中检出了胚系致病性突变(PGV),并对基因致病外显率进行了高度、中度、低度划分,其中44例为中度和高度外显的基因,包括MMR基因、BRCA2、PALB2、APC、MUTYH、CHEK2、ATM、BRIP1及BLM等(图6)。
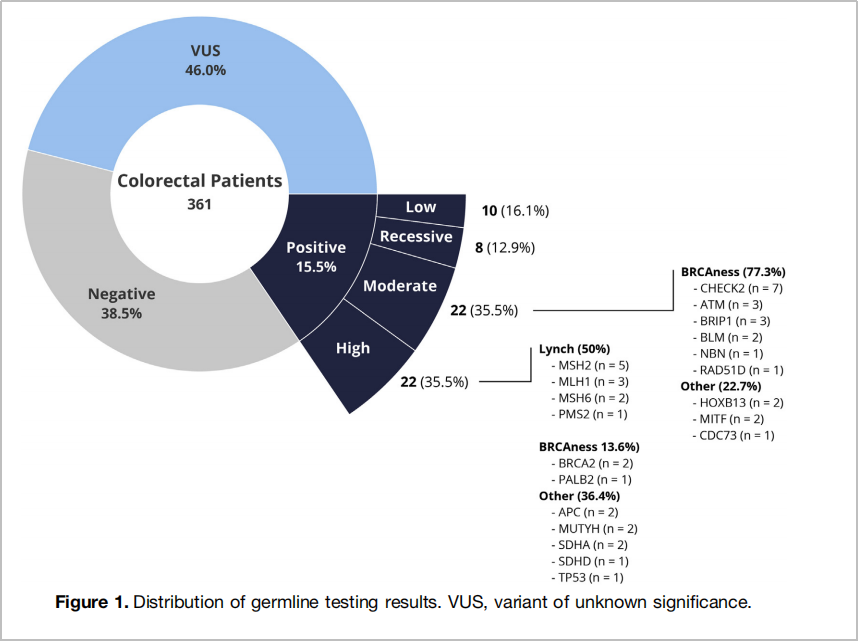
图6. 361例患者胚系致病突变检出及分级
今年3月份,意大利家族肿瘤协会(AIFET)、美洲遗传性胃肠道癌协作组(CGA-IGC)、欧洲遗传性肿瘤小组(EHTG)和国际胃肠道遗传性肿瘤学会(InSiGHT)等多机构联合发布了首部早发性结直肠癌的国际管理指南,陈述了31条管理建议,发表在Clinical Gastroenterology and Hepatology(IF=12.6)期刊上[12]。
在遗传性基因检测筛查方面,指南建议对50岁以下诊断的CRC患者进行的基因检测应至少包括:APC、BMPR1A、EPCAM、MLH1、MSH2、MSH6、MUTYH、POLD1、POLE、PMS2、PTEN、SMAD4、STK11和TP53(图7)。
如果可行且成本不高,检测还应包括以下在CRC中比较常见并能改变临床管理策略的基因:BRCA1、BRCA2、ATM、CHEK2、PALB2,以及可能罕见的BRIP1、BARD1、CDKN2A、CDH1、RAD51C和RAD51D;与CRC或息肉病相关的基因:AXIN2、GREM1、MLH3、MSH3、MBD4、NTHL1、RNF43和RPS20(证据水平1B,推荐等级B)。这也是最新的肠癌遗传性筛查管理指南,从国际化指南的角度证实了结直肠癌遗传性基因不只限于林奇综合征相关基因,有条件的患者,建议行胚系检测需尽可能选择多基因检测项目!
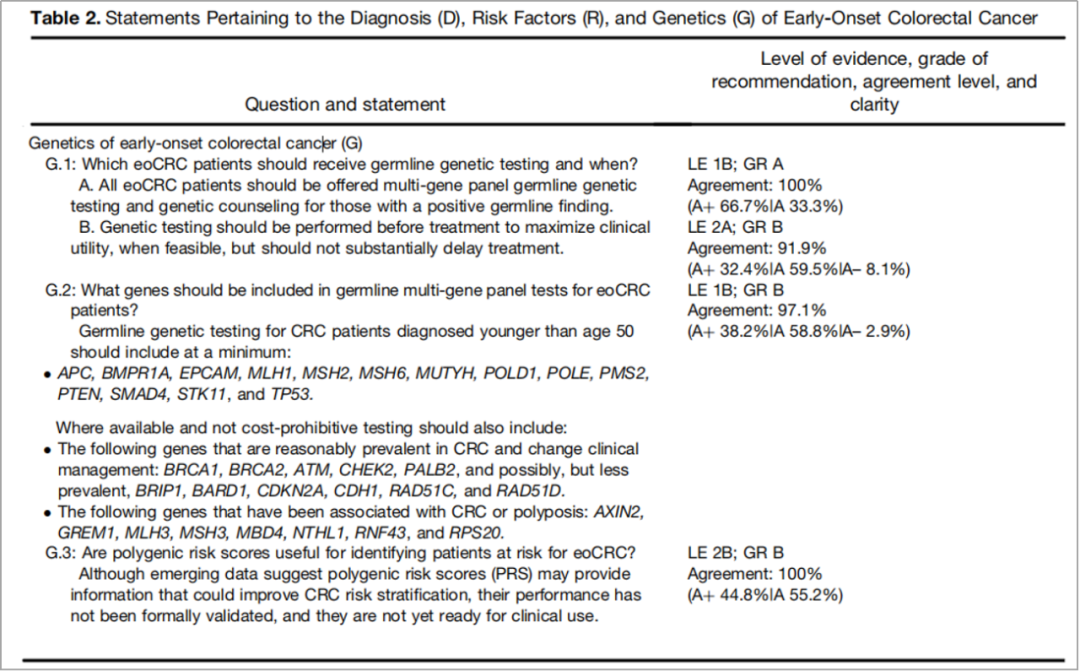
图7. 早期结直肠癌遗传性基因检测建议
因此,结合我司样本的真实检出以及所做的调研,不难发现,结直肠癌患者不应只关注林奇综合征相关的错配修复(MMR)基因胚系突变,同时也需要关注一些同源重组修复(HRR)基因及更多基因的胚系突变。值得说明的是,HRR基因胚系突变实际上重点风险癌种并非肠癌,像乳腺癌,卵巢癌等其他肿瘤更易发生。但一旦检出,则能够在整个实体瘤的预防和早诊上具备重要的意义!另外,除了遗传风险评估之外,随着现阶段异病同治理念的盛行,在PARP抑制剂治疗的角度也颇具指导意义。
本次介绍的三位肠癌患者选择的肠癌129基因、实体瘤201基因(PLUS版)、实体瘤全景680基因检测,在能够为肠癌患者指导靶向,免疫和化疗等不同的治疗方案外,均能包含众多遗传性相关基因检测。回顾我司既往检测结果,除了文中介绍的案例及经典的MMR基因之外,在肠癌患者中还检出了其他基因胚系突变,如RAD50、NF1、RAD51D、BRCA1、BRCA2、ATM、APC等多种基因的胚系突变,为更多地患者提供了准确的检测结果和诊疗指导!
参考文献:
[1] Wu Y, Ouyang T, Li J, et al. Spectrum and clinical relevance of PALB2 germline mutations in 7657 Chinese BRCA1/2-negative breast cancer patients[J]. Breast Cancer Res Treat, 2020, 179(3): 605-614.
[2] Pearlman R, Frankel WL, Swanson B, et al. Prevalence and Spectrum of Germline Cancer Susceptibility Gene Mutations Among Patients With Early-Onset Colorectal Cancer. JAMA Oncol. 2017;3(4):464–471. doi:10.1001/jamaoncol.2016.5194
[3] Pearlman R, de la Chapelle A, Hampel H. Mutation Frequencies in Patients With Early-Onset Colorectal Cancer—Reply. JAMA Oncol. 2017;3(11):1587. doi:10.1001/jamaoncol.2017.1744
[4] Pan W, Lu K, Wang W, Yao J, Hou Y. PALB2 as a potential prognostic biomarker for colorectal cancer. Comput Biol Chem. 2020 May 20;87:107289. doi: 10.1016/j.compbiolchem.2020.107289. Epub ahead of print. PMID: 32497983.
[5] Yang X, Leslie G, Doroszuk A, Schneider S. Cancer Risks Associated With Germline PALB2 Pathogenic Variants: An International Study of 524 Families. J Clin Oncol. 2020 Mar 1;38(7):674-685. doi: 10.1200/JCO.19.01907. Epub 2019 Dec 16. PMID: 31841383; PMCID: PMC7049229.
[6] Gronwald J, Cybulski C, Piesiak W, Suchy J, Huzarski T, Byrski T, Gorski B, Debniak T, Szwiec M, Wokolowczyk D, Matuszewski M, Sun P, Lubinski J, Narod SA. Cancer risks in first-degree relatives of CHEK2 mutation carriers: effects of mutation type and cancer site in proband. Br J Cancer. 2009 May 5;100(9):1508-12. doi: 10.1038/sj.bjc.6605038. PMID: 19401704; PMCID: PMC2694428.
[7] Ghiringhelli F, Richard C, Chevrier S, Végran F, Boidot R. Efficiency of olaparib in colorectal cancer patients with an alteration of the homologous repair protein. World J Gastroenterol. 2016 Dec 28;22(48):10680-10686. doi: 10.3748/wjg.v22.i48.10680. PMID: 28082821; PMCID: PMC5192280.
[8] 王玉东、王颖梅、王建东、王丹波、向阳、张师前、张玉敏、邹冬玲、周琦、薛凤霞.遗传性妇科肿瘤高风险人群管理专家共识(2020)[J].中国实用妇科与产科杂志, 2020, v.36(09):38-47.DOI:CNKI:SUN:ZGSF.0.2020-09-009.
[9] Martín-Morales L, Garre P, Lorca V, Cazorla M, Llovet P, Bando I, García-Barberan V, González-Morales ML, Esteban-Jurado C, de la Hoya M, Castellví-Bel S, Caldés T. BRIP1, a Gene Potentially Implicated in Familial Colorectal Cancer Type X. Cancer Prev Res (Phila). 2021 Feb;14(2):185-194. doi: 10.1158/1940-6207.CAPR-20-0316. Epub 2020 Oct 28. PMID: 33115781.
[10] Ali M , Delozier C D , Chaudhary U .BRIP-1 germline mutation and its role in colon cancer: Presentation of two case reports and review of literature[J].BMC Medical Genetics, 2019, 20(1).DOI:10.1186/s12881-019-0812-0.
[11] Uson PLS Jr, Riegert-Johnson D, Boardman L, Kisiel J, Mountjoy L, Patel N, Lizaola-Mayo B, Borad MJ, Ahn D, Sonbol MB, Jones J, Leighton JA, Gurudu S, Singh H, Klint M, Kunze KL, Golafshar MA, Esplin ED, Nussbaum RL, Stewart AK, Bekaii-Saab TS, Jewel Samadder N. Germline Cancer Susceptibility Gene Testing in Unselected Patients With Colorectal Adenocarcinoma: A Multicenter Prospective Study. Clin Gastroenterol Hepatol. 2022 Mar;20(3):e508-e528. doi: 10.1016/j.cgh.2021.04.013. Epub 2021 Apr 20. PMID: 33857637.
[12] Cavestro GM, Mannucci A, Balaguer F, Hampel H, Kupfer SS, Repici A, Sartore-Bianchi A, Seppälä TT, Valentini V, Boland CR, Brand RE, Buffart TE, Burke CA, Caccialanza R, Cannizzaro R, Cascinu S, Cercek A, Crosbie EJ, Danese S, Dekker E, Daca-Alvarez M, Deni F, Dominguez-Valentin M, Eng C, Goel A, Guillem JG, Houwen BBSL, Kahi C, Kalady MF, Kastrinos F, Kühn F, Laghi L, Latchford A, Liska D, Lynch P, Malesci A, Mauri G, Meldolesi E, Møller P, Monahan KJ, Möslein G, Murphy CC, Nass K, Ng K, Oliani C, Papaleo E, Patel SG, Puzzono M, Remo A, Ricciardiello L, Ripamonti CI, Siena S, Singh SK, Stadler ZK, Stanich PP, Syngal S, Turi S, Urso ED, Valle L, Vanni VS, Vilar E, Vitellaro M, You YN, Yurgelun MB, Zuppardo RA, Stoffel EM; Associazione Italiana Familiarità Ereditarietà Tumori; Collaborative Group of the Americas on Inherited Gastrointestinal Cancer; European Hereditary Tumour Group, and the International Society for Gastrointestinal Hereditary Tumours. Delphi Initiative for Early-Onset Colorectal Cancer (DIRECt) International Management Guidelines. Clin Gastroenterol Hepatol. 2023 Mar;21(3):581-603.e33. doi: 10.1016/j.cgh.2022.12.006. Epub 2022 Dec 20. PMID: 36549470.



