断崖式衰老女子确诊卵巢早衰
时间:2023-12-05 19:36:20 热度:37.1℃ 作者:网络
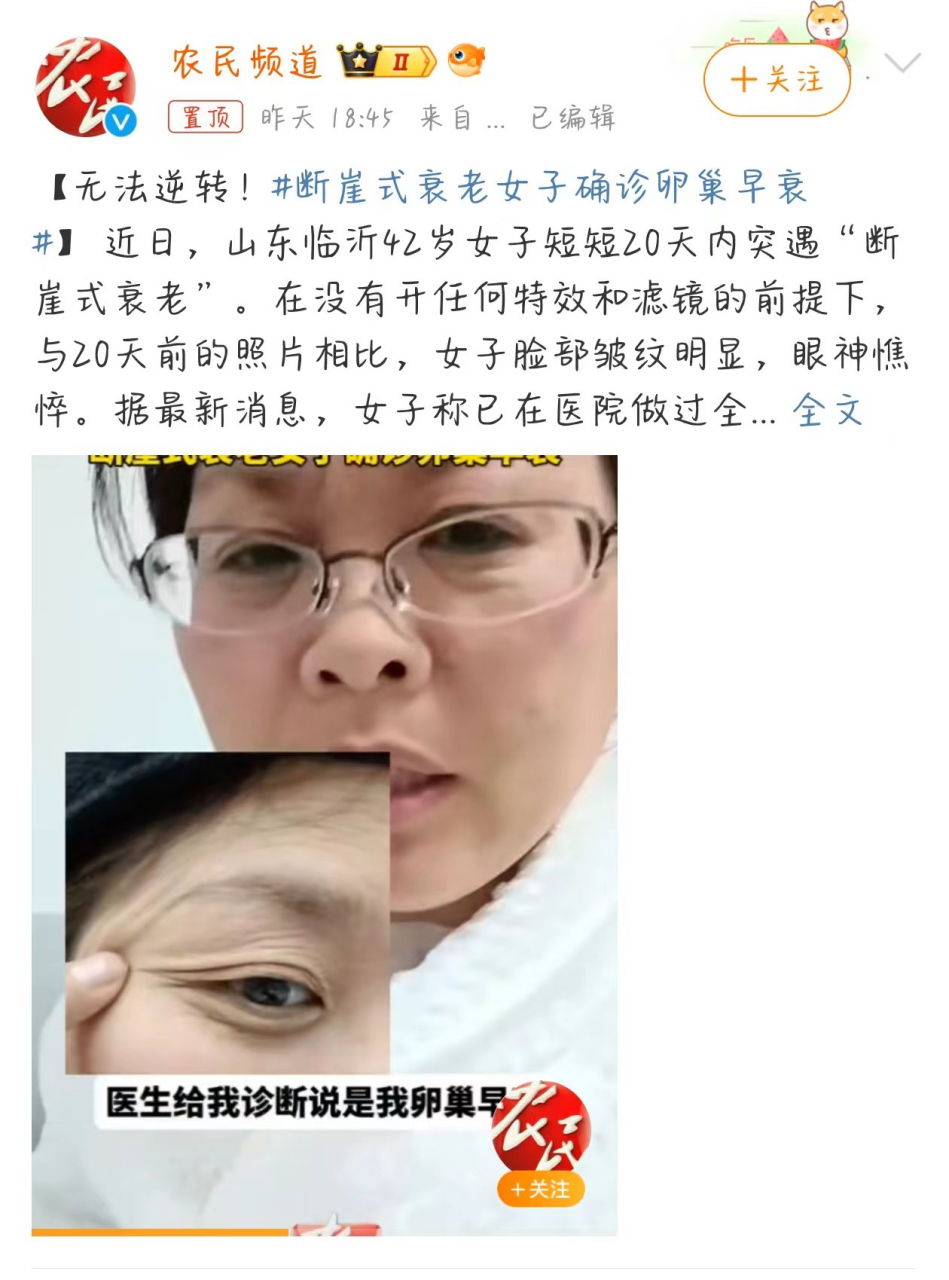
近日,山东临沂42岁女子短短20天内突遇“断崖式衰老”。在没有开任何特效和滤镜的前提下,与20天前的照片相比,女子脸部皱纹明显,眼神憔悴。据最新消息,女子称已在医院做过全身检查,医生诊断其为卵巢早衰,且无法逆转。
早发性卵巢功能不全(POI)是卵巢功能受损的一种极端表现形式,指女性40岁之前发生的卵巢功能减退,主要表现为月经紊乱(如停经或稀发月经)伴有高促性腺激素和雌激素水平波动性下降为特征。
关于卵巢功能提前衰竭的疾病,其定义曾有过多种不同的表述,2008年之前通常使用卵巢早衰(POF)这一术语;美国生殖医学学会(ASRM)在2008年首次提出了“原发性卵巢功能不全”的概念;随着人们对该疾病认识的不断深入,欧洲人类生殖与胚胎学会(ESHRE)2016年发表了最新的“POI处理指南”,将POI正式更名为“早发性卵巢功能不全”。
POI严重影响女性身心健康,特别是生殖健康,不良影响主要包括生育力的下降、不孕以及长期低雌激素状态造成的不良影响,短期内会出现潮热、盗汗、性交不适、阴道干涩、睡眠障碍、焦虑及抑郁等围绝经期症状;远期并发症包括心血管疾病风险增加、骨骼健康受损以及严重的社会心理后遗症,对女性的身心健康有较大的影响。
病因
1、遗传学因素
有研究显示,10% 的 POI 患者存在卵巢早 衰或过早绝经的家族史,还与 X 染色体异常密切相关,可能也和染色体基因突变有关。
X 染色体异常一般可分为两种,第一种指的是数目异常,通常指的是 X 单体、三倍体或缺失等。另一种为结构异常,是指 X 染色体出现倒置、易位等现象。 以 Turner 综合征最为常见,这部分患者表现为婴儿型生殖器、小阴唇发育不良、小子宫、第二性征不发育、原发性闭经或青春期发育停滞伴继发性闭经、不育等。
此外,有研究表明脆性 X 型智力迟钝 1(FMR1)、种系 α 因子(FIGLA)、新生儿卵巢同源盒基因(NOBOX)、骨形态发生蛋白 15(BMP15)和生长分化因子 9(GDF9)、卵泡刺激素受体(FSHR)、叉头盒 L2(FOXL2)、 lncRNA HCP5 等基因突变也与 POF 的发生关系密切。
2、免疫因素
POI 患者中 4% ~ 30% 存在自身免疫性卵巢炎。 24% ~ 73% 的 POI 患者可检测出抗卵母细胞抗体(AOA),POI 中检出率较高的其他抗体有抗类固醇生成细胞抗体(StCA)、抗透明带抗体(ZPAb)、抗心磷脂抗体(ACL)、抗核抗体(ANA)以及抗肾上腺皮质抗体(AAA)等,但其灵敏度和特异度仍需要进一步研究。当抗体与卵巢相关抗原结合后,卵巢的自身免疫性反应可加速卵泡闭锁,导致卵巢功能衰竭。
与 POI 有关的常见免疫性疾病有甲状腺功能减退、自身免疫性肾上腺功能不全、自身免疫性多腺体综合征和自身免疫性 Addison’s 病等。
3、医源性因素
主要是放化疗和手术(卵巢组织缺损或骨盆内手术造成性腺供血减少)对卵巢的损伤。放疗相关的风险主要取决于放疗区域、剂量及患者年龄。化疗相关的POI风险与需要使用的化疗药物相关,并与患者年龄相关,如需要使用具有生殖毒性的化疗药物,则POI风险升高,且风险存在药物剂量依赖性。
此外,盆腔内手术,无论伴或不伴卵巢切除术,均可能会伤及卵巢周围组织,引起卵巢缺损或局部炎症,损害卵巢功能。相对于开腹而言,腹腔镜在妇科手术中的广泛应用降低了手术对卵巢功能损害的风险,但无法避免电凝止血对卵巢带来的不良影响。
4、酶缺陷
17α-羟化酶和 17,20-碳链裂解酶缺陷会导致血清和卵泡液中的雌二醇水平降低,影响卵泡的生长发育进而导致卵巢功能降低,严重者可致 POI。10-11 易位甲基胞嘧啶双加氧酶(TET)与 DNA 去甲基化有关。Tet1 缺陷会导致泛素化缺陷、自噬下降、X 染色体连锁基因表达下调(如 FMR1 基因),影响卵母细胞的质量及数量并降低卵泡储备,最终进展为 POI。
5、疫苗与其他
有研究表明,POI 与接种四价(HPV)疫苗的相关性有统计学意义。也有报道称接种 HPV 疫苗后,POI 患病风险并没有增加,对生育力的损害也基本没有,两者关系需要进一步研究明确。
此外,半乳糖血症、低碳水化合物及低膳食纤维摄入可引发代谢异常,导致 POI。环境中的化学物质例如增塑剂、杀虫剂、尼古丁等也会导致卵母细胞凋亡和体内激素水平变化。吸烟、酗酒、负面情绪刺激、昼夜节律紊乱和长期的精神压力等会引发体内雌孕激素水平波动,加速卵巢功能的衰退,严重者可致 POI。
POI的临床表现
1、月经改变
原发性POI表现为原发性闭经。继发性POI随着卵巢功能的衰退,可先后出现月经周期缩短或不规律、经量减少、月经稀发、闭经等。从卵巢储备功能下降至功能衰竭,可有数年时间,临床异质性较高。少数患者可出现无征兆的月经突然终止。
2、生育力降低或不孕
在卵巢储备功能下降的初期,由于偶发排卵,仍有5%~10%的自然妊娠机会,但流产和胎儿染色体异常的风险明显增加。即使应用辅助生殖技术(ART)进行生育治疗,但获卵数较少,周期取消率较高,临床妊娠率低。目前,尚无确切有效的改善POI患者生殖结局的方法,赠卵仍是POI患者解决生育问题的有效途径。
3、雌激素水平降低的表现
原发性POI表现为女性第二性征不发育或发育差,骨龄小于实际年龄,骨骺闭合延迟,身高持续增长。继发性POI可有潮热出汗、生殖道干涩及灼热感、性欲减退、骨质疏松、情绪改变、心血管症状和代谢紊乱等。
4、其他伴随症状
如Turner综合征常伴发心血管系统发育缺陷、性征发育异常等。此外,POI可伴发肾上腺和甲状腺功能低减、复发性流产等。
5、体征
原发性POI存在生殖器官和第二性征发育不良,体态和身高发育异常,如:Turner综合征表现为第二性征不发育、身材矮小、肘外翻、蹼颈、发际线偏低等;妇科检查时为外阴阴道呈低雌激素表现,黏膜菲薄,弹性差,皱襞减少,阴毛稀少,子宫较小。
继发性POI患者的一般体格、体重、第二性征正常,也可有乳腺萎缩、阴毛腋毛脱落、外阴阴道萎缩等表现,妇科检查时子宫大小无明显变化。
诊断标准
1、年龄<40岁;
2、月经稀发或停经4个月以上;
3、血清基础FSH>25 U/L(至少2次,间隔>4周)。
POI的管理
早发现、早诊断、早治疗为 POI 重要的治疗原则,虽然目前尚无有效的方法恢复卵巢功能,但 POI 病因学研究的不断深入给改善 POI 患者卵巢功能提供了多种思路。
一、激素补充治疗
激素补充治疗(HRT)不仅可以缓解低雌激素症状,而且对心血管疾病和骨质疏松可起到预防作用。若无禁忌证,POI患者均应给予HRT。目前,关于HRT最佳方案的研究有限,在给药途径、给药剂量、雌激素和孕激素制剂类型方面,临床实践中存在较大差异。
1、原发性POI:当POI发生在青春期前时,患者无内源性雌激素,从青春期开始至成年期间必须进行持续治疗,直至平均自然绝经年龄,以诱导患者性发育,维持第二性征,还能维持患者骨量,提高患者生存质量,降低远期并发症的发生率和死亡率。
(1)时机:早期诊断的POI患者,推荐在11~12岁时开始低剂量的雌激素治疗;对诊断较晚者,可权衡生长潜能和性发育的情况后,采取个体化治疗。
(2)持续性:鼓励持续治疗至女性平均自然绝经年龄,即50岁左右。之后参考绝经激素治疗(MHT)方案继续进行治疗。
(3)剂型:雌激素剂型主要为经皮和口服雌激素。其中经皮雌激素因不经过肝脏代谢,是较好的激素补充药物。目前应用较多的口服雌激素为戊酸雌二醇或17β-雌二醇。尽量避免应用口服避孕药诱导青春期发育。
(4)剂量及疗程:开始为小剂量(成人生理剂量的1/8~1/4),然后每6个月增加1次剂量,2~3年后逐步达到成人生理剂量。若开始治疗时年龄已经偏大、更接近于成年,增至成人生理剂量的过程可适当缩短。为维持POI患者正常的乳腺和子宫发育,推荐开始雌激素治疗2年后或有突破性出血发生时,考虑加用孕激素,即推荐雌孕激素序贯治疗,模拟自然周期。
(5)随访:治疗过程中需注意监测生长发育和乳腺、外阴、子宫的情况,注意监测血压、肝功能、血脂及凝血功能等。在HRT期间,不建议常规监测FSH及LH水平。
2、继发性POI:因较早缺乏雌激素的保护作用,故建议POI患者长期用药;且因年轻、并发症少,用药风险较低。应遵循以下原则:
(1)时机:在无禁忌证、评估慎用情况的基础上,尽早开始HRT。
(2)持续性:鼓励持续治疗至平均自然绝经年龄,即50岁左右。之后可参考绝经后的MHT方案进行管理。
(3)治疗前评估:①排除禁忌证:已知或怀疑妊娠,原因不明的阴道流血,已知或可疑患乳腺癌,已知或可疑患性激素依赖性恶性肿瘤,最近6个月内患活动性静脉或动脉血栓栓塞性疾病,严重肝肾功能不全等。②评估慎用情况:恶性肿瘤,心脑血管疾病,血栓形成倾向,子宫肌瘤,子宫内膜异位症,系统性红斑狼疮,胆道疾病,哮喘等。
(4)剂型:雌激素剂型主要为经皮、口服及经阴道。其中经皮雌激素的血栓风险较低,而口服雌激素对糖脂代谢更有益,口服药物主要为戊酸雌二醇或17β-雌二醇。乙炔雌二醇是合成雌激素,常见于复方口服避孕药中,血栓形成风险高于天然雌激素,因此一般仅适用于有避孕需求患者的短期使用。阴道用雌激素主要作为全身用药时的辅助用药,以改善局部症状。孕激素选择则优先推荐天然或接近天然的制剂,如微粒化黄体酮或地屈孕酮。
(5)剂量及疗程:使用标准或稍大剂量,不强调小剂量,根据患者需求适当调整。
①单纯雌激素治疗:适用于已切除子宫的POI患者。推荐剂量是:17β-雌二醇2 mg/d、戊酸雌二醇2 mg/d、雌二醇凝胶1.5 mg/d或半水合雌二醇皮贴50 μg/d,连续应用。
②雌孕激素序贯治疗:适用于有完整子宫、仍希望有月经样出血的POI患者。在使用雌激素的基础上,每周期加用孕激素10~14 d。按雌激素的应用时间又分为周期序贯和连续序贯,前者每周期停用雌激素2~7 d,后者连续应用雌激素。雌激素的推荐:17β-雌二醇2 mg/d、戊酸雌二醇2 mg/d、雌二醇凝胶1.5 mg/d或半水合雌二醇皮贴50 μg/d(应根据患者的具体情况个体化调整)。孕激素多采用:地屈孕酮10 mg/d或微粒化黄体酮胶丸100~300 mg/d。也可采用复方制剂,如雌二醇片-雌二醇地屈孕酮片(每盒28片,前14片每片含1 mg或2 mg 17β-雌二醇,后14片每片含1 mg或2 mg 17β-雌二醇+10 mg地屈孕酮)。由于序贯治疗方案相对复杂,复方制剂的依从性明显好于单药的配伍,鼓励采用复方制剂,POI患者更建议应用2 mg的雌激素剂量。
③雌孕激素连续联合用药:由于POI患者通常较年轻,且需要的雌激素量高于绝经后女性,易发生突破性出血,一般不采用雌孕激素连续联合方案进行HRT。
④阴道局部雌激素的应用:仅在改善泌尿生殖道萎缩症状时,以及对肿瘤手术、盆腔放疗、化疗及其他一些局部治疗后引起的症状性阴道萎缩和阴道狭窄者,或医源性原因导致的POI、有全身使用HRT禁忌者,可考虑阴道局部用药。若全身用药后阴道局部仍有症状,也可以在全身用药时辅助阴道局部用药。用药方法:阴道用药,每日1次,连续使用。2周症状缓解后,改为每周用药2~3次。阴道局部应用雌激素通常不需要加用孕激素。但尚无资料提示药物长期(>1年)局部应用的全身安全性。长期单独应用者应监测子宫内膜的情况(可参考《中国绝经管理与绝经激素治疗指南2023版》相关内容)。
(6)随访:治疗期间需每年定期随访,以了解患者用药的依从性、满意度、不良反应,必要时调整用药方案、药物种类、剂量、剂型。
二、非激素治疗
对于存在HRT禁忌证、暂时不愿意或者暂时不宜接受HRT的POI患者,可选择非激素制剂来缓解低雌激素症状。但非激素治疗对POI患者骨健康及心血管代谢健康的益处相关研究数据较少,尚无一致结论。
1、植物类药物:包括黑升麻异丙醇萃取物、升麻乙醇萃取物,作用机制尚未完全明确。
2、植物雌激素:指植物中存在的非甾体雌激素类物质,其雌激素作用较弱,长期持续服用可能会降低心血管疾病风险、改善血脂水平、改进认知能力。但目前仍不推荐常规使用,仅作为保健品使用。
3、中医药:中成药包括坤泰胶囊等,其他包括针灸、耳穴贴压、按摩、理疗等。
4、其他:多种维生素等、辅酶Q10、脱氢表雄酮(DHEA)、褪黑素、运动治疗如太极、瑜伽等均对卵巢功能有一定的保护作用。
三、一般管理
包括遗传咨询、心理疏导及生活方式调整。
1、遗传咨询与指导:根据家族史和遗传学检测结果评估遗传风险,为制定POI患者的生育计划、保存生育力、预测绝经提供指导。具体包括对有POI家族史或早绝经家族史的女性,可借助高通量基因检测技术筛查致病基因;对家系中携带遗传变异的年轻女性建议尽早生育,或在政策和相关措施允许的情况下进行生育力保存。
2、缓解心理压力:POI患者会出现严重的焦虑及抑郁,生活满意度较低,应告知POI患者尤其是年轻患者,仍有排卵、自然妊娠的机会。对焦虑、抑郁等精神症状严重者进行心理咨询指导和治疗及必要的社会功能康复训练。
3、调整生活方式:规律作息,管理情绪,保持开朗、乐观、积极的态度;适当锻炼,避免熬夜、久坐,控制体重;避免接触生殖毒性物质,如吸烟等;健康合理饮食、粗细搭配,适当补充钙剂及维生素D等。
四、生育治疗
POI患者并非完全的卵巢“衰竭”,还存在间歇性和无法准确预测的卵巢活动,约25%诊断为POI的患者可能自发排卵,5%~10%的POI患者可能自然受孕。目前已有许多提高妊娠率的研究,但各种方法,无论是通过自然受孕还是ART,仍无有效的治疗定论。
1、生育指导与ART治疗:目前尚无最佳的用药方案。增加促性腺激素剂量、促性腺激素释放激素拮抗剂方案、促性腺激素释放激素激动剂短方案、微刺激及自然周期方案虽一定程度上可改善ART治疗的结局,但对POI患者均未能证实确切有效。多种预处理方案及辅助抗氧化制剂的疗效仍有待进一步证实。
2、生育力保存:针对因某些疾病或治疗可能损伤卵巢功能的POI高风险人群,采取生育力保存非常重要。
部分Turner综合征患者的卵巢虽然可见少量卵泡,但其自然妊娠和药物辅助妊娠发生不良母儿结局的风险较高,如:Turner综合征患者妊娠后更容易发生主动脉夹层或破裂,不一定适宜生育,故应在保存生育力前评估妊娠时的心血管疾病风险;同时,卵母细胞质量差、染色体异常、获取卵巢组织后可能进一步加速卵巢功能衰退等情况需充分告知、评估。
常见的生育力保存方法有:胚胎冷冻、成熟卵母细胞冷冻及未成熟卵母细胞冷冻等。


