东华大学李静超Angew:双靶向仿生半导体聚合物纳米复合物,用于骨转移瘤多模态诊疗
时间:2023-12-11 12:37:17 热度:37.1℃ 作者:网络
骨转移是多种晚期恶性肿瘤患者常见的并发症之一,严重影响患者生存质量。在骨转移环境中,癌细胞通过产生破骨细胞刺激因子促进破骨细胞的增殖和活性,进而导致骨吸收;而破骨细胞则通过分泌多种生长因子促进肿瘤进展,因此在骨吸收与肿瘤生长之间形成“恶性循环”。早期骨转移没有明显症状,但传统的分子影像技术对于骨转移瘤部位微小的肿瘤病灶和骨吸收通常无法实现有效检测。另外,骨骼组织富含羟基磷灰石且血供较差,药物递送不仅困难,也缺乏组织特异性。因此,开发合适的诊疗剂以实现骨转移瘤的早期精准诊断和高效治疗至关重要。
基于以上背景,东华大学李静超设计了一种双靶向仿生半导体聚合物纳米复合物(SPFeNOC),通过同时靶向破骨细胞和癌细胞,提高纳米诊疗剂在骨转移瘤组织的富集,实现增强型多模态诊疗。静脉给药后,表面残留的膜蛋白能够通过同源靶向作用,引导SPFeNOC积聚在转移瘤部位(图1b)。通过氧化铁纳米颗粒和半导体聚合物介导的磁共振和荧光双模式成像,SPFeNOC能够检测转移瘤部位的癌细胞和破骨细胞。在肿瘤过氧化氢以及超声照射下,SPFeNOC介导的化学动力和声动力联合治疗能够通过同时杀死转移瘤部位的癌细胞和破骨细胞,抑制肿瘤生长和骨吸收,打破骨转移部位的“恶性循环”。该研究通过双靶向策略,实现了对骨转移瘤的增强型多模态诊疗,并且具有很好的生物安全性。

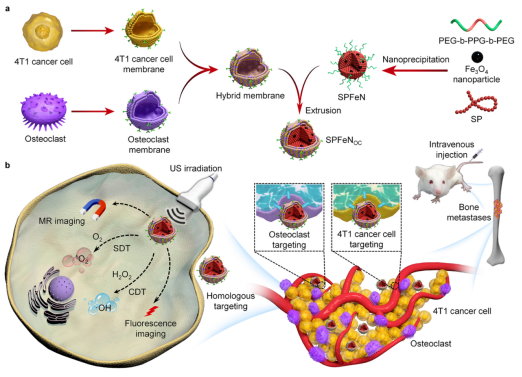
图1. SPFeNOC的制备及多模态诊疗机制示意图
通过纳米共沉淀技术该团队首先制备了含有半导体聚合物和氧化铁纳米颗粒的纳米复合物(SPFeN)。随后,在SPFeN表面包裹癌细胞和破骨细胞形成的杂化细胞膜,得到双靶向仿生纳米复合物(SPFeNOC)。按照同样的方法,以癌细胞或破骨细胞单一膜包裹的纳米复合物作为对照材料。
该团队对SPFeNOC及对照材料在转移瘤荷瘤小鼠中的双模式成像性能进行了评价(图2)。实验结果表明,SPFeNOC可以通过T2磁共振成像和近红外荧光成像检测肿瘤。且由于双靶向作用,SPFeNOC相对于单一细胞膜包裹的对照材料表现出更强的检测效果。随后,该团队评价了SPFeNOC及其对照材料在体内的肿瘤生长抑制效果。实验结果表明,增强的肿瘤富集使SPFeNOC能够对肿瘤生长表现出更强的抑制效果。
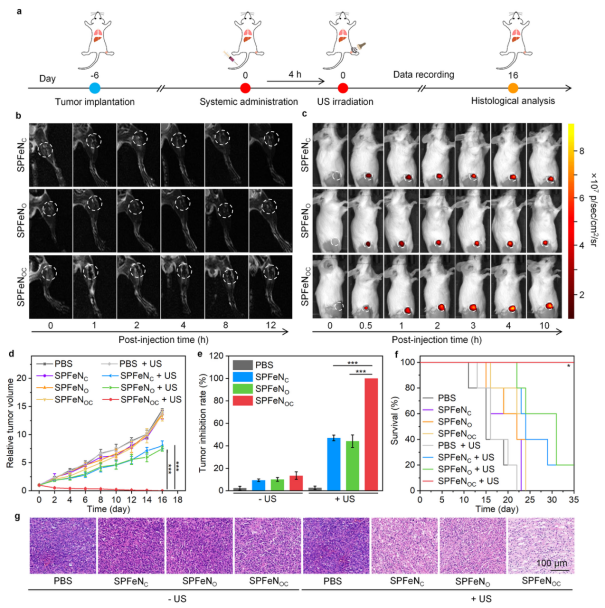
图2. 双模式成像、体内肿瘤富集以及治疗效果评价
随后,该团队对SPFeNOC及其对照材料在体内的抗转移效果和作用机制展开了研究(图3)。该研究团队对荷瘤小鼠在单次治疗后肿瘤在肺和肝脏的转移情况进行了评估。为了阐明SPFeNOC的作用机制,该团队对治疗后肿瘤部位的脂质过氧化,谷胱甘肽和活性氧生成的水平进行了研究。实验结果表明,SPFeNOC相对于单一细胞膜包裹的对照材料能够通过更强的靶向性更有效地抑制肿瘤的转移;这种理想的肿瘤生长和转移抑制效果是通过声动力治疗和化学动力治疗联合实现的。

图3. 肿瘤在肺和肝脏的转移抑制以及体内作用机制评价
此外,该团队对治疗后的荷瘤胫骨和股骨远端进行微型计算机断层扫描(micro-CT),评价骨参数以及骨转移部位破骨细胞水平(图4)。实验结果表明,SPFeNOC介导的治疗可以有效降低转移瘤部位破骨细胞数量从而最大程度缓解骨转移相关的骨破坏。
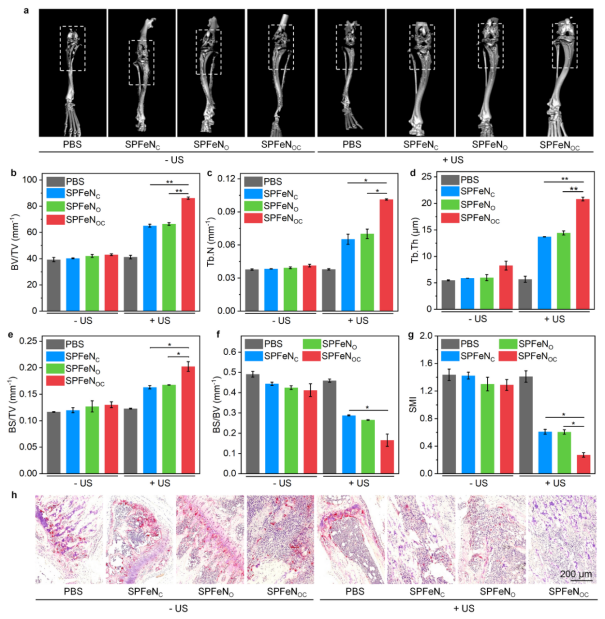
图4. 骨转移相关骨损伤评价
总之,这种利用癌细胞和破骨细胞的杂化细胞膜包覆的双靶向仿生纳米复合物在骨转移瘤的诊疗中具有显著优势:首先,杂化细胞膜的包覆可以延长纳米诊疗剂的血液循环时间,并实现对破骨细胞和癌细胞的同时靶向作用,提高纳米复合物在肿瘤部位的富集;其次,纳米复合物的磁共振和近红外荧光双模式成像同时检测破骨细胞和癌细胞,能够实现骨转移瘤的早期精准诊断;纳米复合物的声动力治疗和化学动力学治疗的联合效应,能够同时杀死肿瘤细胞和抑制破骨细胞对肿瘤细胞的促生长作用,打破骨转移瘤部位破骨细胞和肿瘤细胞之间的“恶性循环”,提高肿瘤治疗效果。
该研究成果以“Dual-Targeting Biomimetic Semiconducting Polymer Nanocomposites for Amplified Theranostics of Bone Metastasis”为题发表在Angewandte Chemie。东华大学生物与医学工程学院硕士研究生张伊婧为该论文第一作者,东华大学李静超研究员为共同通讯作者,上海市松江区中心医院放射科夏进东教授为论文共同通讯作者。该研究工作得到上海市科委和上海市高等学校特聘教授(东方学者)项目的资助。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/anie.202310252

