病理干货 | 从大象为什么不易得癌症聊起:扒一扒p53
时间:2023-12-14 19:47:20 热度:37.1℃ 作者:网络
生存环境的改变,医疗条件的改善,人类寿命越来越长,随之而来一个威胁人类生命的问题 - 癌症,而另一个长寿的哺乳动物 - 大象,却并没有相似的困扰。大象寿命平均可达65岁,有的甚至能活到一百岁高龄,它们却只有3%的癌症死亡率,远远低于人类根据它们的体型所预期的罹癌率。图1对比了人类和大象的体细胞数、癌症死亡率和p53拷贝数,我们一起认识下让大象不易得癌症的p53。

图1 人类与大象患癌风险上数据对比
01 p53的抑癌功能
p53基因家族在多细胞动物发育过程中已经进化了6亿至8亿年[1],自从发现p53基因家族,40年间我们了解到p53的功能几乎参与调控所有的生物学过程,包括细胞凋亡、细胞周期、细胞衰老、细胞分化、细胞迁移、细胞代谢和细胞自噬等,但绝大多数的研究关注p53在肿瘤中的作用。
人体有40万亿以上的体细胞,任一体细胞突变为癌细胞,并逃过免疫指控的控制后,就会发生癌症,p53突变是癌症中发现得最多的突变之一,所以,人类50%以上的癌症中都能检测到p53突变。p53的抑癌功能像警察对付罪犯一样,分四步。首先,限制罪犯活动 - 将有DNA损伤的细胞停留在G1期,防止其分裂、增值;其次,对罪犯进行再教育 - 对DNA损伤的细胞,启动DNA修复;再次,教育不好的终身监禁 - 对DNA损伤难以修复的细胞,启动细胞老化;最后,威胁很大的罪犯执行死刑 - DNA严重损伤时,启动细胞凋亡。尤其是细胞凋亡过程对防止肿瘤发生非常重要,因为许多DNA损伤和基因突变是不可能通过DNA修复来复原,当突变积累,细胞增殖就可能失控。
长期以来,人们一直认为p53可诱导抗增殖细胞周期阻滞、凋亡和衰老程序,以应对各种应激信号,但近年来的各种研究表明,p53还具有其他重要功能,可能也有助于肿瘤抑制,包括调节肿瘤代谢、铁下垂、肿瘤微环境中的信号传导,干细胞自我更新/分化[2]。
02 p53受到的调控及对下游的调控
p53功能通过对上下游的调控而实现。p53受到的上游调控分为对p53蛋白浓度的调控和对p53蛋白分子活性的调控。对p53蛋白浓度的调控,主要依赖MDM2泛素化蛋白,两者达到动态平衡。p53蛋白半衰期在6-20分钟,在细胞中保持一个相对较低的浓度水平,当DNA损伤或细胞出现增殖信号时,ATM/ATR及ARF会抑制MDM2,使p53的半衰期大大增加,p53在细胞中的浓度增加。对P53蛋白分子活性的调控通过ATM/ATR及CHK1/CHK2可以使p53蛋白磷酸化,使得p53蛋白与目标DNA的结合能力大大增加;与MDM2的亲和力大大下降,使得被降解的速度降低。
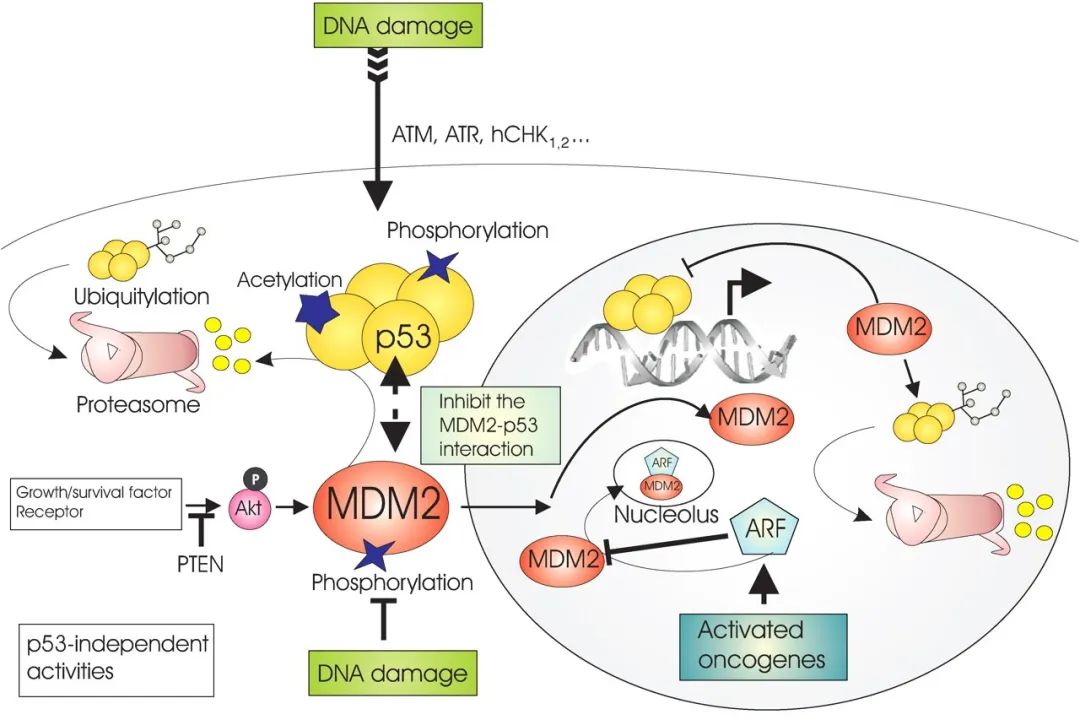
图2 MDM2与p53之间的负反馈调节
DNA损伤、强的增值信号、缺少氧、缺少营养等因素都能激活p53,增加细胞中p53的浓度,促进p53磷酸化,进一步调控下游基因,通过转录与一系列细胞信号转导通路相互作用,实现细胞损伤修复、细胞凋亡等许多不同的细胞功能。见图3。
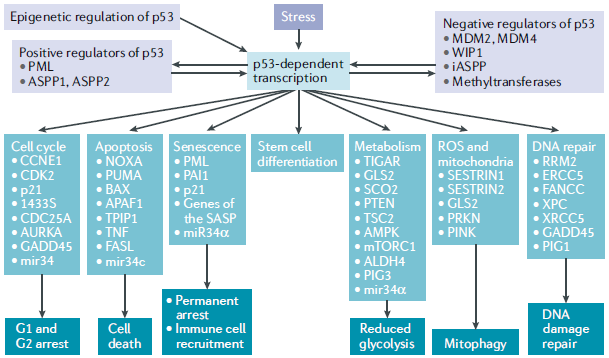
图3 p53对不同类型应激反应的转录输出
03 p53在癌症诊疗和预后中的意义
p53基因与人类50%以上的癌症有关,目前明确的有结直肠癌、乳腺癌、肝癌、膀胱癌、胃癌、前列腺癌、软组织肉瘤、卵巢癌、脑瘤、淋巴细胞肿瘤、食道癌、肺癌、成骨肉瘤等,人类肿瘤中p53突变主要在高度保守区内,以175、248、249、273、282位点突变最高,不同种类肿瘤不同。结直肠癌的发生、发展与肠上皮细胞的凋亡、增殖速度密切相关,多种基因、信号蛋白参与了这个过程,p53基因通过调控细胞周期,进而调节细胞的增殖与分化,对结直肠癌的发生、进展起重要作用[3]。30%~35%的原发性浸润型乳腺癌中存在p53突变,在三阴性乳腺癌中高达80%的突变率,HER2过表达型乳腺癌突变率为70%,突变型p53很可能会成为乳腺癌,尤其是三阴性乳腺癌的生物标志物和(或) 新的治疗靶点[4];在肺癌中,33%的腺癌和70%的SCLC发生p53突变,p53突变的肺癌预后不良并对化疗药物和放疗更加抵抗,包括增加致癌性,增加肿瘤转移和侵袭的能力,降低对化疗药物的敏感性等[5]。p53突变杂合的Li–Fraumeni综合征患者可以发展为婴幼儿肿瘤,如脉络丛癌、肾上腺皮质癌、横纹肌肉瘤和某些类型的髓母细胞瘤。
04 p53蛋白判读标准汇总
p53进化了8亿年,成为功能强大、机制复杂的信号通路,在临床中常以免疫组化的结果来反应p53在癌症中的表达,下表总结了在不同文献中p53蛋白免疫组化判读。

结语:
人类的p53拷贝数虽远低于大象,但未来随着对p53在代谢、肿瘤、生殖、生物寿命等众多领域更深入的研究,它作为关键的生物标志物,在靶向药物的研发,合适的治疗方案选择,人类寿命延长等方面将发挥越来越重要的作用。
参考文献
[1] Levine, Arnold J. p53: 800 million years of evolution and 40 years of discovery. Nature reviews. Cancer, 2020, 20(8).
[2] Yanqing Liu , Wei Gu, The complexity of p53-mediated metabolic regulation in tumor suppression[J], Seminars in Cancer Biology, doi.org/10.1016/j.semcancer.2021.03.010.
[3] 焦俊霞,叶晓霞 EGFR、P53、Ki-67在结直肠癌中表达及临床病理学意义[J].中国老年学杂志 2020 ,5 ( 40 ):2065-2068.
[4] 张伯阳,段秀庆. p53 作为乳腺癌潜在生物标志物和治疗靶点的研究进展[J]. 医学综述 2019, 25(12):2366-2371.
[5] 黄文彦 刘凯珊. 以新视角观察p53家族在肺癌发生及治疗中的独特作用[J]. 中 国 肺 癌 杂 志 2 0 1 3,1 6 ( 8 ):422-426.
[6] p53免疫组织化学在妇科病理学中的多种应用:2020年USCAP年会国际妇科病理学会联席会议论文集(第109届美国和加拿大病理学会年会(USCAP)).
[7] WHO Classification of tumors.5th edition.Female Genital Tumors.2020 IARC.
[8] College of American pathologists. Template for Reporting Results of Biomarker Testing of Specimens From Patients With Carcinoma of the Endometrium.
[9] Lien N Hoang , Melissa K McConechy, Martin Köbel, et al. Histotype-genotype correlation in 36 high-grade endometrial carcinomas [J]. Am J Surg Pathol. 2013;37(9):1421-32.
[10] Naveena Singh , Anna M Piskorz , Tjalling Bosse, et al. p53 immunohistochemistry is an accurate surrogate for TP53 mutational analysis in endometrial carcinoma biopsies [J]. J Pathol. 2020 Mar;250(3):336-345.
[11] Martin Kobel, Anna M Piskorz, Sandra Lee, et al. Optimized p53 immunohistochemistry is an accurate predictor of TP53 mutation in ovarian carcinoma [J]. J Path: Clin Res October 2016; 2: 247–258.


