梗阻性肥厚型心肌病和Takotsubo心肌病综合征:如何管理左心室扩张?
时间:2023-12-17 19:01:31 热度:37.1℃ 作者:网络
摘要:目前,对急性左心室为何会球囊样扩张,有两种假设原因。最常引用第一种假设,即心肌细胞的直接儿茶酚胺毒性或微血管缺血引起了球囊样扩张。我们将这种发病机制引起的左心室球囊样扩张称为Takotsubo综合征。最近,提出了第二种假设原因:在某些患有基础性肥厚型心肌病的患者中,左心室球囊样扩张是由潜在的左心室流出道突然梗阻引起的。当病情严重且持续不缓解时,大大加重的后负荷和急性氧供需不平衡的缺血,导致球囊样扩张。这两种疾病,都可能表现为左心室球囊样扩张并引起混淆。了解每种机制的病理生理学以及如何正确确诊可能会指导治疗。
关键词:急性心血管监护、球囊样扩张、肥厚型心肌病、左心室流出道阻塞、Takotsubo
非标准缩写和首字母缩略词
肥厚型心肌病(hypertrophic cardiomyopathy,HCM)、左室流出道梗阻(left ventricular outflow tract obstruction,LVOTO)、梗阻性肥厚型心肌病(obstructive hypertrophic cardiomyopathy,OHCM)、Takotsubo综合征注册研究(Registry on Takotsubo Syndrome,RETAKO)、收缩期前向运动(systolic anterior motion,SAM)、Takotsubo综合征(Takotsubo syndrome,TTS)
奥卡姆剃刀,又称简约法则,在医学上可以概括为:对病因的解释越少,越可能正确。相反,希克姆法则与奥卡姆剃刀截然不同,宣称任何病症都可能有两个或更多的病理生理学原因,并不是所有病症解释都是单一简约的。在Takotsubo综合症(TTS)中,奥卡姆剃刀认为,急性左心室(LV)球囊样扩张是由于急性事件期间血浆去甲肾上腺素、肾上腺素和多巴胺极度升高引起的。然而,其他研究表明,具有LV球囊样扩张的患者中有少数患者有潜在梗阻性肥厚型心肌病(OHCM),潜在的梗阻和突然发生的持续高流出压力梯度导致了球囊样扩张。希克姆法则允许LV 球囊样扩张不止1个病因。
在这份综述中,我们讨论了急性左心室球囊样扩张的两种病因。第一种是最常引用的假设,即球囊样扩张是由儿茶酚胺对心肌细胞的直接毒性或微血管缺血引起的。我们将这个病因引起的称为神经体液型Takotsubo综合症(TTS)。最近,出现了第二种病因。在一些患有潜在梗阻性肥厚型心肌病(HCM)的患者中,左心室球囊样扩张是由于潜在的左心室流出道梗阻(LVOTO)的突然梗阻引起的,当严重且持续时,重度的不能代偿的后负荷和急性氧需大于氧供性缺血导致了球囊样扩张。在本综述中,我们将这种发病机制称为潜在梗阻性肥厚型心肌病引起的左心室球囊样扩张。
重叠的流行病学和临床表现
急性左心室球囊样扩张的患者中,由于这些综合症的流行病学重叠,区分神经激素性应激性心脏病(TTS)和由梗阻性肥厚型心肌病(OHCM)引起的球囊样扩张具有困难。通常,神经激素性TTS90%发生在绝经后的妇女。同样,对由OHCM引起心尖球囊样扩张的患者进行的一项回顾性病例系列研究显示,13名患者中10例(77%)是女性,平均年龄为64±7岁。此外,对18例既有TTS又有梗阻性肥厚性心肌病的病例系统回顾发现,78%的患者为女性,中位年龄为66.2岁。这些发现说明在出现神经激素性TTS和由OHCM引起的心脏球囊样扩张的患者人口学上存在重叠,这可能导致误分类。而心源性休克时,容易发生在TTS,患者通常是年轻人,且男性患者的比例较高。
一项对被诊断为TTS的患者进行的回顾性盲法读超声心动图的队列研究显示,经过详细分析超声心动图后,多达30%的病例是隐性HCM伴左心室球囊样扩张。基于人群研究,漏诊和误分类的普通HCM病例多达三分之一。因此,将HCM描述为心脏病的伪装大师。左心室球囊样扩张是掩盖HCM最强的面具之一。另一个掩盖OHCM的面具是左心室相对轻度肥大伴球囊样扩张。轻度肥大的左心室不能承受严重的后负荷失调。而OHCM中常见的较厚的心室可以承受室壁应力。因此,详细了解OHCM伴心尖部球囊样扩张的临床表现、病理生理变化和临床病程,可能会提高我们准确诊断HCM在这种特征性临床疾病的能力。
神经体液性TTS患者与OHCM引起的球囊样扩张患者临床特征也有重叠。敏锐的读者会注意到,无论是神经体液性TTS还是OHCM引起的球囊样扩张,都可能由应激产生的过量儿茶酚胺诱发,TTS是通过儿茶酚胺的直接毒性或血管痉挛诱发,OHCM伴球囊样扩张是通过严重的压力梯度诱发。主要通过对流出道梗阻的深入评估和超声心动图检测到的二尖瓣病变(包括二尖瓣叶片的收缩期前移和疾病随时间的演变)独特异常,来区分OHCM伴左心室球囊样扩张和TTS。左心室流出道阻塞(LVOTO)定义为心室内压力梯度>30mmHg,若梯度超过50mmHg,通常认为与血液动力学异常相关。具体来说,左心室功能正常后,OHCM球囊样扩张的患者中,室间隔肥厚、长二尖瓣叶片、乳头肌异常和二尖瓣瓣叶前移均可观察到。在急性发作前,超声心动图检查的患者中,也能发现这些独特的异常(图1和2,视频S1和S2)。
入院前一个月
休息时 运动后
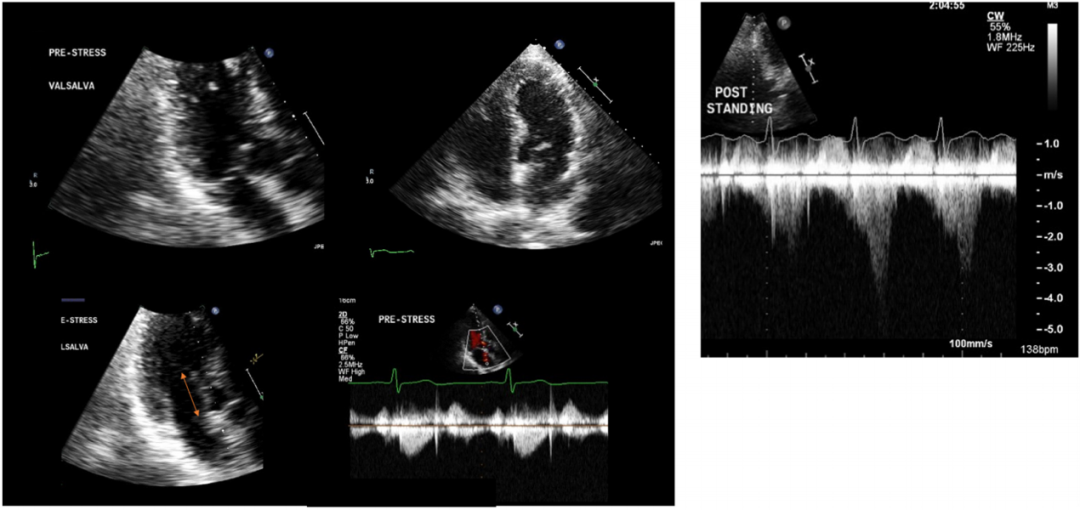
图1.肥厚型心肌病与隐匿性梗阻
60岁的男性患者,他有心绞痛和新发的收缩期杂音。左图显示休息时收缩期二尖瓣前向运动(SAM),二尖瓣前叶未与室间隔接触,室间隔轻度隆起,四腔心收缩功能显示正常,二尖瓣前叶测量长达30mm,静息时的左心室流出道(LVOT)压力梯度正常。在运动应激心超后,由于SAM、二尖瓣与室间隔接触,检测到50mmHg的LVOT梯度。可看到室间隔轻度隆起、收缩功能正常(也可参见视频S1)。
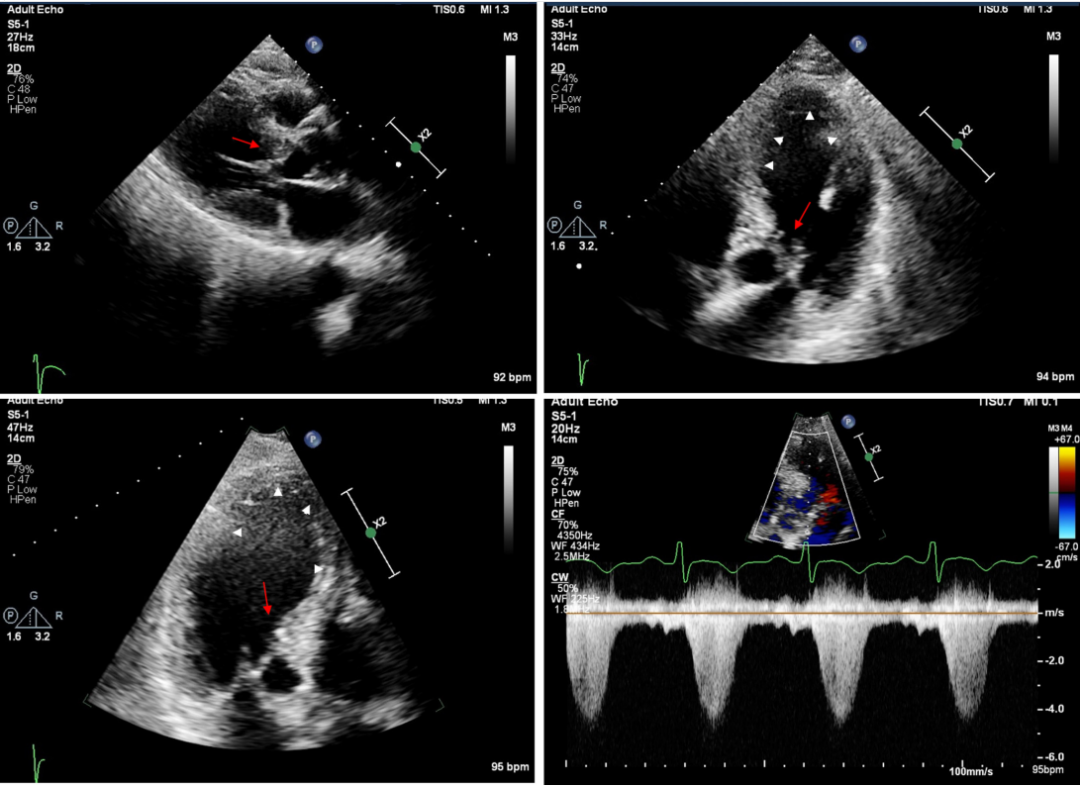
图2.肥厚性心肌病(HCM)伴潜在梗阻患者的急性心尖球囊样扩张
因胸痛、呼吸急促和血流动力学不稳定(血压=70/40mmHg),与图一的同一个患者入急诊室后经胸超声心动图检查。胸骨旁和心尖长轴视图以及心尖四腔心视图显示急性左心室(LV)球囊样扩张(白色箭头),伴有严重的二尖瓣收缩期前向运动(SAM)、二尖瓣与室间隔的接触(红色箭)(也可参见视频S2)。连续波多普勒显示右下图中的左心室流出道(LVOT)压力梯度高达90mmHg。在静脉注射β受体阻滞剂和苯肾上腺素后完全恢复。该病例展示了当压力梯度严重而持续时,潜在的梗阻性肥厚性心肌病(HCM)可能会进展到心尖球囊样扩张,从而加重病情。
此外,这两种疾病都可能因心房肌病而加重,导致室上性心动过速。无论是肥厚型心肌病合并心尖球囊样扩张还是TTS,特别报道了心房颤动的发生率都在20%~30%。TTS患者中,白细胞介素-6和白细胞介素-10导致的炎症,认为是TTS的病因机制以及心房肌病及心律失常间关键的但尚未证实的因素。另一方面,随着OHCM的结构重塑,左心房纤维化和左心房增大,以及左心房压力升高,都易导致心房肌病,导致左心房充盈和收缩功能受损。持续和难治性的LVOTO和二尖瓣反流可能是导致心房颤动的多米诺骨牌。
不断变化的左心室中部梗阻诱发心尖球囊样扩张
很久前,就观察到OHCM可导致左心室(LV)球囊样扩张。2005年,Merli等人描述了4例急性期左心室中部梗阻的TTS(应激性心肌病)病例,她们是伦敦圣乔治医院就诊的老年妇女,轻度室间隔肥厚(舒张期,位于左心室肌节段基底环和中间环#的室间隔厚度,12-14mm)。作者假设左心室梗阻在TTS的病理生理学中起重要的作用:在低血容量和小左心室的情况下,儿茶酚胺应激可能诱导左心室中腔梗阻,产生高压和高室壁应力的心尖腔室。现认为左心室做功增加时,高腔内舒张压会降低心内膜下冠状动脉流量,产生心肌顿抑(心尖球囊样扩张)。当心尖腔室缺血更强烈时,收缩功能障碍会减少左心室中段梗阻,缓解了最初的缺血部位。根据该假设,这样的事件序列需要一个初级异常,即心室肌的增厚,使得能产生一个显著的可逆梯度:也就是认为与HCM相关的室间隔肥厚。值得注意的是,在随访的第20天,使用低剂量多巴酚丁胺应激心超再现了左心室中部梗阻,增强了该假设的可信度。
(译者注:为准确评估左心室节段性室壁运动异常,将左心室心肌分割成多个节段。目前最常用的左室心肌节段划分方法是ASE提出的16段模型法和17段模型法。左心室心肌分为三个心肌环,即基底环、中间环和心尖环,每个环的高度均是左室长度的1/3,其分界点为:二尖瓣瓣环水平至乳头肌尖端为基底环、从乳头肌尖端至乳头肌根部为中间环、乳头肌根部以下为心尖环


左室流出道梗阻是显性肥厚型心肌病球囊样变的原因
在该病例系列中,所有患者均完全逆转了休克和左心室功能障碍,并且全部存活。因此,OHCM中的左心室球囊样扩张是一种可治疗的心源性休克的原因。
随后,2011年,报道了2例因收缩期二尖瓣叶前移(SAM)导致左心室流出道梗阻(LVOTO)的梗阻性肥厚型心肌病(OHCM)患者,进一步引起了对该现象的关注。这两位患者有潜在的LVOTO,能被应激心超诱发,在严重和持久的左室流出道梗阻导致观察到明显的LV球囊样扩张前,能充分代偿。他们急性发病后,进展为心源性休克,对静脉输液、高剂量静脉β阻滞剂和苯肾上腺素均无反应。为缓解梗阻,最后只得手术置换二尖瓣。在2小时内,就改善了严重左心室功能障碍和休克,左心室功能迅速恢复正常。随后,在一份多中心报告中,又报道了14例因LVOTO和球囊样扩张导致的OHCM心源性休克病例,其中8例需要机械循环支持,5例只能通过减少室间隔厚度来逆转。这为通过缓解梗阻来逆转球囊样扩张和难治性心源性休克,提供了有力的证据,证明梗阻是球囊样扩张和休克的原因。该病例系列中,所有患者都完全逆转了他们的休克和左心室功能障碍,并且全部存活。因此,当OHCM伴心源性休克时,纠正LV的球囊样扩张,有治疗效果。
除可能发生令人震惊的心源性休克外,OHCM伴左心室(LV)球囊样扩张还能特征性的模拟心肌梗死。现已很清楚,左心室球囊样扩张是OHCM自然病程的一部分。值得注意的是,在最近的mavacamten和aficamten研究中,3名患者左心室球囊样扩张,其中2名在Explorer研究的mavacamten组,1名在aficamten研究的安慰剂组。相比之下,从未在非梗阻性HCM的患者中报告过左心室球囊样扩张。
更细微的反应压力梯度性左心室功能障碍的超声心动图征象
多普勒超声心动图发现左心室射血速度在收缩中期下降(即“龙虾爪样异常频谱”),以及组织多普勒显示的收缩期提前终止,这些都是HCM心肌对后负荷独特敏感的超声心动图演示(图3和4)。通过使用负性肌力药物消除压力梯度,这些异常得以正常化。这里有个反常情况:尽管给予具有负性肌力的药物,但在消除心室内压力梯度后,反而恢复了局部和整体的收缩功能。通过改善OHCM患者的纵向应变和美托洛尔解除压力梯度,最近已证实了这一称为反常性可逆收缩功能障碍现象。当LVOTO持续不缓解时,由于高左心室内压力(和做功)和低舒张期灌注压,导致冠脉血供有限,还会发生氧供不能满足氧需的缺血。因此HCM中,超声心动图显示的LV球囊样扩张,说明是更严重的反常性可逆性收缩功能障碍。
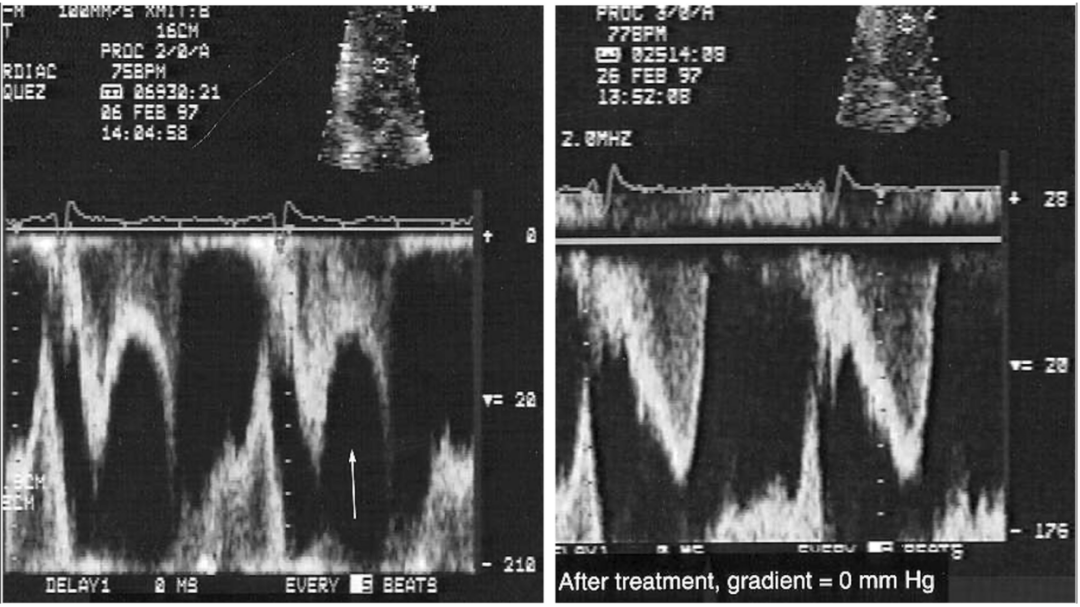
图3异常的龙虾爪样频谱
在二尖瓣下2.5厘米处测得的脉冲波多普勒速度频谱曲线,显示收缩中期速度下降。白色箭显示的是下降的最低点,其形状类似龙虾爪。测得左心室流出道(LVOT)压力梯度为90mmHg。该征像在左室流出道压力梯度≥60mmHg的患者中普遍存在,是后负荷不匹配的表现。在同一天用丙吡胺消除压力梯度后,就检测不到收缩中期速度下降。
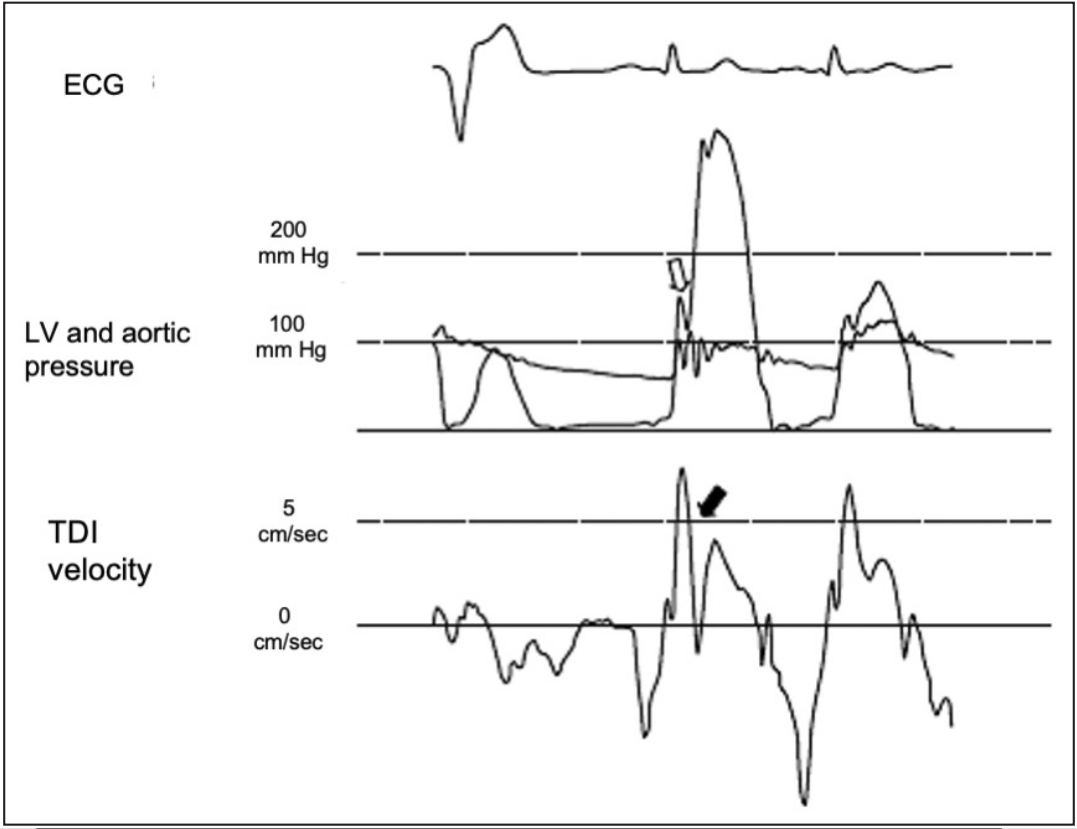
图4梗阻性肥厚型心肌病的患者心电图(ECG)、左心室流出道(LVOT)压力梯度,以及室间隔基底部的组织多普勒成像(TDI)速度曲线。注意室性早搏后,会同时出现LVOT压力梯度(白色箭)和组织多普勒曲线显示的收缩中期室间隔运动的减速凹陷(黑色箭)。该图形描绘了所谓的反常性可逆收缩功能障碍现象。
在11%到33%的TTS病例中观察到,因SAM导致动态的LVOTO。以前曾提出,TTS中流出道梗阻是由于流出道狭窄、过度活跃(译者注:过度活跃是指心脏的某个部分比正常情况下更加活跃,即心肌收缩更强烈,血液流动速度更快。这可能是由于各种原因,比如药物刺激、内源性交感神经系统的高度活跃、心动过速、前负荷减少等),由于LV几何形状的功能性改变而产生的Venturi效应。该理论已得到广泛认可,但并无支持性证据。相比之下,关于HCM中SAM的大量证据表明,它是由流动的牵引力,即流动的推力,而不是由Venturi效应引起的。当SAM开始时,OHCM的流出速度很低,排除了Venturi效应作为一种机制。由于LV球囊样变导致严重的心尖和中LV运动减弱/不运动,左心室流出道的流速也一定很低。通过直接观察,发现左心室流出道的流速很低,约20cm/秒。
其他的证据来自于7例因左室球囊扩张而入院的患者,这些患者在临床康复和左室功能正常化后行多巴酚丁胺应激超声心动图检查。在多巴酚丁胺应激超声心动图检查中,由于二尖瓣前移(SAM)和二尖瓣-室间隔接触,在无左室球囊样扩张的情况下,这7名患者出现高左室流出道压力梯度。这表明,SAM并非由左室形状的几何变化或基底部高动力状态引起的,恰恰相反,SAM首先出现,然后才是左心室球囊状扩张。值得注意的是,这些患者中许多人要么有轻度的室间隔肥厚,要么狭小的主动脉-室间隔角度伴S形室间隔(译者注:主动脉-室间隔角度狭窄,可能会增加左心室流出道梗阻的风险。S形室间隔(即肥厚的室间隔基底部)在老年人中更常见,可能与晕厥和轻度心室梗阻有关)。这些患者与先前报道的合并急性左心室球囊扩张的轻度室间隔增厚OHCM患者完全相似。根据这些数据、以及先前关于OHCM左室球囊扩张的观察以及合理的病理生理机制,临床上诊断为左室球囊扩张的患者亚组中,并非室壁运动异常引起了二尖瓣-室间隔接触,而是二尖瓣-室间隔接触导致了严重的收缩功能障碍(即室壁运动异常)。
除轻度室间隔肥厚外,在心室球囊样扩张的患有肥厚型心肌病(HCM)患者,以及最初因为TTS入院而后发现OHCM的患者中,还发现了其他形态学异常。这些患者的二尖瓣前叶片较长,从二尖瓣前叶片的尖端到主动脉瓣非冠状动脉尖的起点>30mm;他们的二尖瓣前移,使得二尖瓣的闭合平面提前置于左心室流出道中,他们还有残留的未闭合的叶片,即部分二尖瓣前叶突出到与后叶片的闭合平面之外。这些都是导致仅轻度室间隔增厚的患者易发生二尖瓣-室间隔接触的特征。这些特征与那些在仅轻度室间隔增厚的OHCM患者中观察到的特征完全相同。
虽然入院时的超声心动图上很容易检测到SAM,但最高的左心室压力梯度可能发生在住院前,由于心室内血流流动下降,降低了对二尖瓣的牵拉力,这种压力梯度在接下来的几个小时内可能无法检测到。
LVOTO对左室球囊样扩张临床进程的影响
基于大型全国性登记数据的最近观察结果表明,LVOTO在LV球囊样扩张中的患病率在7%~13%之间。目前正在评估其影响。我们假设许多既有LVOTO又有心源性休克的患者,其潜在病理是OHCM,这强调了由于OHCM引起的LV球囊样扩张和神经体液TTS引起的LV球囊样扩张间的差异。心源性休克恶化了6%~20%的LV球囊样扩张患者的临床病程,且是住院死亡的主要原因之一。
意大利Takotsubo网络对227名患者进行的一项研究显示,左心室流出道梗阻(LVOTO)与急性心力衰竭、心源性休克和住院死亡的复合指标在单变量分析中存在相关性。然而,在调整混杂因素后,这种关联并未得到证实。最近,分析了全国多中心Takotsubo综合征登记表(RETAKO)中的711名左心室球囊样扩张的患者,证实LVOTO与心源性休克独立相关。此外,二尖瓣SAM触发了继发性、短暂和可逆的中重度二尖瓣反流,这进一步降低了心脏每博量。通过不同的病理生理途径,无论是二尖瓣SAM还是牵引二尖瓣(译者注:当左心室扩张和二尖瓣环扩张时,就可能导致二尖瓣牵引(tethering of the mitral valve),导致二尖瓣叶片在收缩期间受限,不能正确地闭合。这种情况通常是由于左心室的疾病,而不是二尖瓣叶片的异常),都可以导致重度的急性二尖瓣反流增加肺动脉压力,严重情况下可导致急性心力衰竭。潜在发病机制消退后,二尖瓣反流也通常消退。
神经体液Takotsubo综合症的病因病理机制
之前讨论了肥厚型心肌病(HCM)和左心室流出道阻塞(LVOTO)背景下的左心室球囊样扩张,并提供了机械血流动力学的解释。
与之相比,神经体液性Takotsubo综合征病因发病机制不同。尽管儿茶酚胺似乎起着核心作用,但心脏和大脑间的神经体液途径、炎症、激素和遗传因素似乎都参与Takotsubo综合征的病理生理机制。
微血管功能障碍
冠脉微循环功能障碍可能是心肌收缩功能障碍的病因决定因素。由于儿茶酚胺和内皮素水平升高,进一步加重了微循环的血管收缩。然而,使用核素显像或造影超声心动图,其他临床研究显示急性期TTS患者的心肌灌注正常。
心外膜血管痉挛
某些TTS患者的诊断性血管造影期间,报告了冠状动脉痉挛,这可能是儿茶酚胺激增导致的。然而,为了解释基底型和中间型的Takotsubo综合征,冠脉痉挛只能发生在(供应左心室基底和中间部分的)基底侧支,而不能发生在大的心外冠状动脉(译者注:即供应整个左心室的大血管,这是因为如果大的心外冠状动脉发生痉挛,那整个左心室都会受到影响,而不仅仅是基底部分或中间部分)。从更全面和多因素的视角下,提出了既有高儿茶酚胺水平对心肌的直接毒性作用,又有痉挛性缺血的作用,属双重打击机制。在TTS患者中,降低的微RNA 125a-5p浓度和升高的内皮素-1的血浆浓度,两者均收缩冠脉微循环血管和增加血管张力,通过心内膜活检检测,显示这两种机制都与内皮细胞凋亡有关。一项实验研究中,Uchida等学者显示由于微血管痉挛,儿茶酚胺激增引起了微血管内皮细胞的凋亡。通过缺血-再灌注机制,随后氧化应激增加,可能诱导心肌顿抑和左心室心尖部球囊样扩张。作者认为从应激和儿茶酚胺激增到心肌顿抑,内皮细胞凋亡是关键的但尚未证实的因素。
心肌炎症
在TTS急性期的早期,使用心脏磁共振成像评估心肌炎症标志水肿时,使用T2短时反转恢复序列经常可发现水肿,特别在室壁运动异常的区域。
儿茶酚胺对心肌细胞的直接作用
TTS患者的心内膜活检显示了一种收缩带坏死的模式,类似于嗜铬细胞瘤或蛛网膜下腔出血患者的情况。认为这是由交感神经风暴引起的,是儿茶酚胺直接作用于心肌细胞的结果。
在神经体液性TTS中,为解释为什么刺激肾上腺素后会发生心尖球囊样扩张,可能有两个生理原理:
• 左室心尖部,β1和β2肾上腺素能受体的密度较基底段更高。
•通过改变与G蛋白偶联受体(GPCR)相互作用的G蛋白类型(从Gs蛋白改变到Gi蛋白)(译者注:Gs蛋白可以激活腺苷酸环化酶,增加细胞内的环磷酸腺苷(cAMP)水平,从而增强心肌收缩力。而Gi蛋白则抑制腺苷酸环化酶的活性,降低cAMP的水平,从而减弱心肌收缩力),升高的儿茶酚胺水平反而抑制收缩。根据该假设,刺激β1后激活Gs途径,可能是引发β2肾上腺素能受体磷酸化并随后切换到Gi途径的起始步骤,最终导致负性肌力反应。
旁分泌效应
多项实验研究已表明,通过许多介质,内皮细胞具有旁分泌功能,这些介质有助于调节收缩性能和舒张。由包括心室内压力过载在内的多因素引起的内皮-心内膜损伤的情况下,预期由一氧化氮引起的内皮依赖性心室舒张会全消失。内皮素-1组织水平也显著增加,增加血管张力和收缩冠脉微血管,最终导致内皮细胞凋亡。由于左心室心尖部是左心室最薄且最高度小梁化的部分,因此,提出心内膜-内皮信号通路的急性改变为心尖部球囊样变的诱因之一。此外,因氧供需不平衡,虽然LVOTO主要引起心内膜下缺血,但通过旁分泌环路,也可以解释其他心肌层的损伤。
决策中心和治疗
正确的诊断是指导不同治疗策略的基础(图5)。
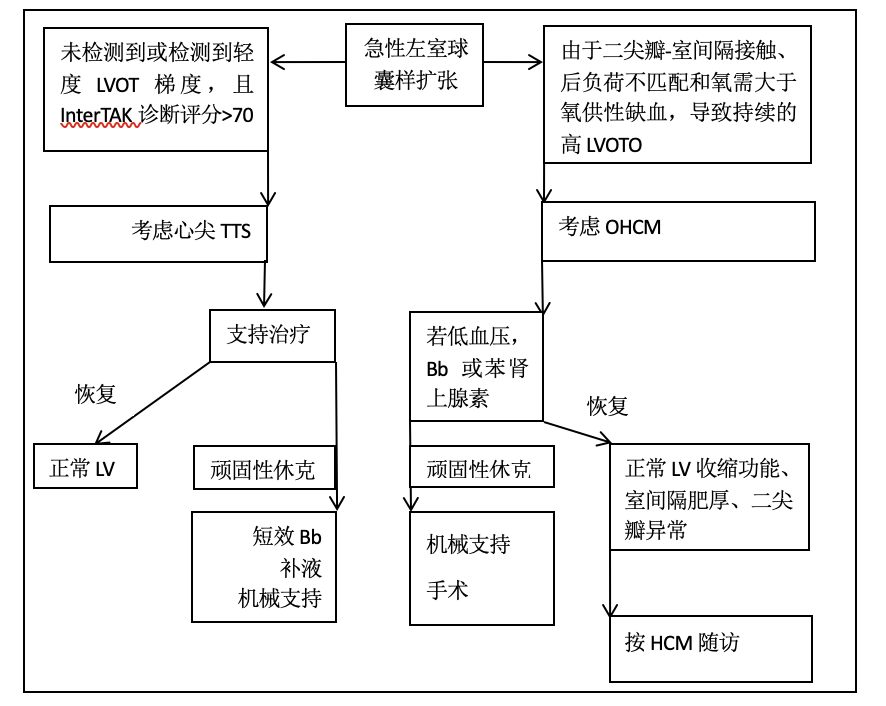
图5管理和治疗流程
心尖球囊样变和心室内梗阻患者的诊断要点和治疗策略。
Bb β受体阻滞剂、HCM肥厚型心肌病、LV左心室、LVOT左心室流出道、LVOTO左心室流出道梗阻、TTS Takotsubo综合征。
心尖球囊样扩张的患者中,通常通过多普勒心超检查来诊断LVOTO。持续高度LVOTO(特别是初次出现时,这可能是二尖瓣接触室间隔引起的)、后负荷不匹配和氧需大于氧供性缺血的情况下,应考虑诊断为OHCM。相反,若住院期间未检测到或检测到轻度LVOT梯度(<50mmHg),且计算出的InterTAK评分>70,应考虑可能为神经体液型TTS。在具有基底反应性增强,特别是当有易感形态特征(如左心室较小时)的神经体液型TTS患者中,可能会出现球囊样扩张和低压力梯度变化的LVOTO。
心尖球囊样扩张和LVOTO的患者都应用β-受体阻滞剂治疗,根据临床紧急程度或静脉注射或口服,并使用苯肾上腺素治疗低血压。临床经验表明,OHCM时,静脉注射美托洛尔15mg(或静脉注射普萘洛尔),持续15分钟是安全的,且无需延迟药物滴定,可降低LVOT梯度并提高血压。在伴有LVOTO的神经激素TTS中,一般更倾向于使用短效β阻滞剂,如艾司洛尔。在缺乏针对梗阻性患者的临床试验的情况下,血管紧张素转换酶抑制剂和血管紧张素受体阻滞剂似乎是禁忌的。
LVOTO时,无论是TTS还是HCM,都应谨慎使用利尿剂,仅限于缓解肺水肿,因为通过减少前负荷,过度利尿可增加心室内梯度。无论是TTS还是HCM,静脉注射液体可增加前负荷,可能有助于消除心室内压力梯度问题。
在心源性休克患者中,由于急性泵衰竭,正性肌力药物通常在治疗中起主要作用。然而,这些药物应避免用于心尖部球囊样扩张和LVOTO的患者,因为正性肌力药会加大对二尖瓣的推动,加重SAM和心室内梯度。值得注意的是,即使没有LVOTO的患者,儿茶酚胺在神经体液型TTS并发心源性休克的患者中仍存在争议。有报道称,应用外源性儿茶酚胺可能会加重急性期并与死亡率增加有关。在这方面,为替代儿茶酚胺,可考虑使用非肾上腺素类的肌力药物(如Ca2+增敏剂左西孟丹)。
难治性心源性休克且LVOTO的患者中,可考虑恢复过程中短期使用机械循环支持。使用经皮左心辅助装置(Impella)将血液直接排入主动脉并避开LVOT,可能会恢复血液动力学,但这会降低前负荷(译者注:这是因为Impella装置的工作原理是通过主动减少左心室的容积来卸载左心室。这意味着,当Impella装置工作时,它会从左心室中排出更多的血液,从而降低左心室的容积。这种容积的减少就相当于降低了前负荷)。主动脉内球囊泵会降低后负荷,并可能加重心室内压力梯度。因此,存在LVOTO的病例,禁忌主动脉内球囊泵。在器官低灌注的难治性心源性休克病例中,使用静脉-动脉体外膜肺氧合可能更合适,具体选择取决于中心的专业知识和可用性。重要的是要强调,由于缺乏随机对照研究,当前的建议仅基于病例报告、回顾性研究和专家意见。
OHCM患者中,难治性休克对减少室间隔厚度反应迅速,这就需要熟悉HCM球囊样综合征,并准备好进行干预的团队。相比之下,神经体液型TTS伴休克的患者没有任何特定治疗,只是支持性治疗,但他们可能会因低血压而正性肌力药物治疗。
对于TTS和LVOTO引起的心尖球囊样扩张患者,由于长期管理和预后尚未得到全面研究。因此,对于持续症状的患者,目前无法提供基于确凿证据的长期药物治疗建议。为明确室壁运动异常、心室内梯度和二尖瓣反流是否消失、什么情况下会消失,应密切超声心动图随访。在恢复阶段,为揭示压力梯度是否持续存在并监测β阻滞剂疗法的效果,应行运动应激超声心动图检查。为了防止梗阻性症状的再次出现,可以考虑使用强效负性肌力药物,如新型肌球蛋白ATP酶抑制剂。一方面,完全预防LVOTO将是最佳的。另一方面,如果治疗失败或治疗过程中仍出现LVOTO,抑制剩余的功能性心肌将是有害的。进一步的经验将揭示强效负性肌力药物是否会有所帮助。
结论
患有OHCM的患者可能会突然出现类似于神经体液性TTS经典形式的左心室(LV)球囊样扩张。另一方面,继发性LV球囊样扩张可能是未被识别的潜在或轻度HCM形式的首次临床表现。这两种机制,神经体液型TTS和LVOTO型球囊样扩张,都是常见LV球囊样扩张表型的亚型。在心尖球囊样扩张的病因学中,应考虑到被漏诊的HCM或轻度肥厚的心肌病,尤其是有潜在动态LVOTO的情况下。由于左心室(LV)球囊样扩张有两种重要的发病机制,对于临床实践中建立适当的治疗管理,正确识别这两种不同的亚型至关重要。对LV球囊样扩张的病因解释,不应援引奥卡姆剃刀,而应援引希克姆法则。


