Leukemia:徐卫/梁金花/吴轶凡团队探索CSF-ctDNA阳性在新诊断DLBCL中的发病率、基因组、转录组学及预后价值
时间:2024-05-24 19:00:57 热度:37.1℃ 作者:网络
DLBCL CSF-ctDNA
中枢神经系统受累(CNSi)是系统性弥漫性大B细胞淋巴瘤(DLBCL)中不常见但致命的事件,但常规诊断手段对于检测继发性CNS淋巴瘤(SCNSL)的灵敏度有限,而脑脊液循环肿瘤DNA (CSF-ctDNA)作为液体活检在中枢神经系统淋巴瘤中具有重要作用,但尚未有研究报道CSF-ctDNA在新诊断DLBCL (ND-DLBCL)患者中的发病率和临床意义,其中枢神经系统传播的机制也仍未得到充分探讨。因此,迫切需要在大队列ND-DLBCL患者中对CSF-ctDNA进行全面评估。
鉴于此,江苏省人民医院徐卫教授牵头对100例ND-DLBCL患者作为训练队列进行了回顾性评估,随后又前瞻性纳入26例ND-DLBCL患者进行验证(验证队列),以揭示CSF-ctDNA阳性在ND-DLBCL患者中的临床和生物学意义。研究结果近日发表于《Leukemia》,共同第一作者为梁金花医生和吴轶凡研究生,通讯作者为徐卫教授。

研究方法
该研究纳入2021.12-2023.4共100例连续ND-DLBCL作为训练队列,并前瞻性纳入2023.5-2023.6月另外26例接受基线CSF-ctDNA分析的ND-DLBCL患者作为验证队列;另纳入独立的24例ND-PCNSL患者用来比较基因组差异(测试队列)。所有ND-DLBCL患者的一线治疗均为R-CHOP样方案或R-CGVP方案,CNS预防策略参考NCCN指南。
研究设计概况见图1A,图1B为来自不同队列的肿瘤、CSF和血浆样本的收集情况。所有CSF样本均提交常规检测、生化检查、形态学和流式细胞术。
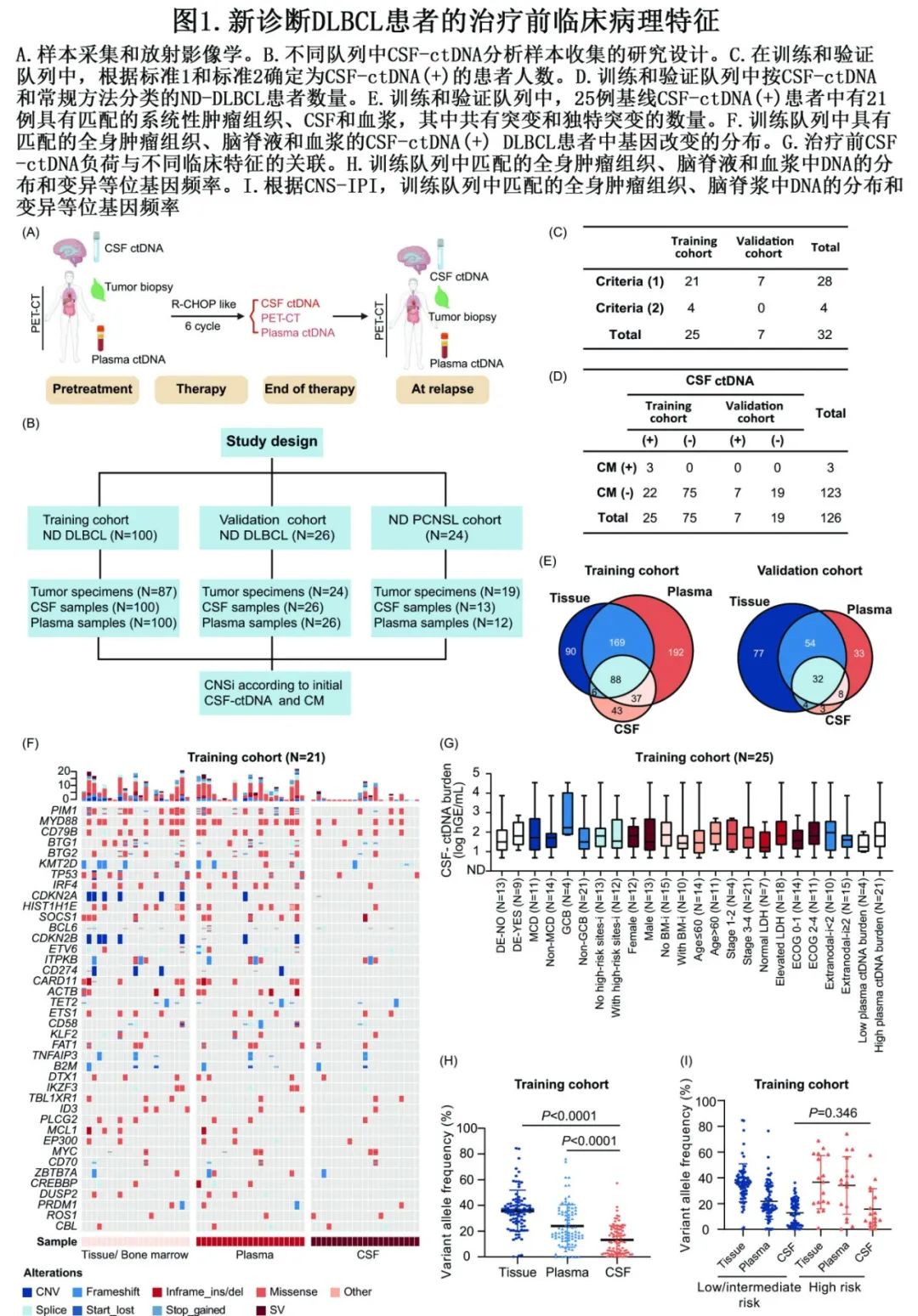
根据以下标准确定患者为CSF-ctDNA阳性(CSF(+)):(1)如果有组织,则在CSF-ctDNA中检测到至少一种与组织共享的突变变体;(2)如果没有可用组织,在CSF-ctDNA中检测到的至少一个突变变体为既往报道的DLBCL典型驱动突变。患者根据常规方法诊断为CNSi阳性(CNSi(+)) (CNS病变通过典型症状、影像学表现和/或CSF淋巴瘤细胞进行诊断)。
研究结果
CSF-ctDNA在新诊断DLBCL中检测CNS受累的灵敏度高于传统方法
训练和验证队列中分别有25例(25/100,25.0%)和7例(7/26,26.9%)CSF-ctDNA(+)患者;大多数CSF(+)病例根据第一种标准定义,包括训练队列中的21例(21/25,84.0%)和验证队列中的所有7例(7/7,100%)(图1C)。在训练和验证队列中的32例治疗前CSF(+)患者中,只有3例通过常规方法(CM)证实为CNSi(+)(图1D)。
接下来比较了CSF(+)患者中肿瘤、CSF和血浆样本之间的基因改变(GA)。在两个队列中,CSF中检测到的大多数GA与血浆和组织中检测到的GA一致(图1E),表明早期中枢神经系统浸润没有发生克隆进化。前5个突变基因分别为PIM1、MYD88、CD79B、BTG1和BTG2,它们是淋巴细胞MCD亚型的突变特征(图1F)。然而,CSF(+)患者的CSF-ctDNA负荷与临床特征之间未发现显著相关性(P>0.05)(图1G)。在训练和验证队列中,肿瘤组织和血浆中GA的平均变异等位基因频率(VAF)明显高于CSF(图1H)。GA的VAF与临床特征,包括高IPI评分、CNS-IPI评分和晚期之间也没有显著关联(图1I)。
CSF(+) ND-DLBCL和PCNSL的不同基因组特征
首先探讨了CSF(+) ND-DLBCL和PCNSL患者中淋巴细胞亚型的分布(图2A)。大多数PCNSL患者属于MCD亚型(18/24,75.0%),而CSF(+) ND-DLBCL患者中只有44.0%(11/25)属于MCD亚型。此外,与PCNSL患者相比,CSF(+) ND-DLBCL患者血浆中ctDNA负荷较高,但CSF中ctDNA负荷较低(图2B)。此外,PCNSL患者组织中MYD88 (P=0.027)和BCL-2 (P=0.042)的突变频率更高,而几种独特的GA仅在CSF(+) ND-DLBCL患者组织鉴定出来(图2C)。在CSF样本中,MYD88 (P=0.005)、IRF4 (P=0.025)、PIM1 (P=0.027)、BCL-2 (P=0.028)、P2RY8 (P=0.028)、PAX5 (P=0.028)和PRDM1(P=0.030)突变在PCNSL患者中更为丰富,而独特的GA(如TGFBR2、PLCG2和MEF2B)仅在CSF(+) ND-DLBCL患者鉴定出来(图2D)。
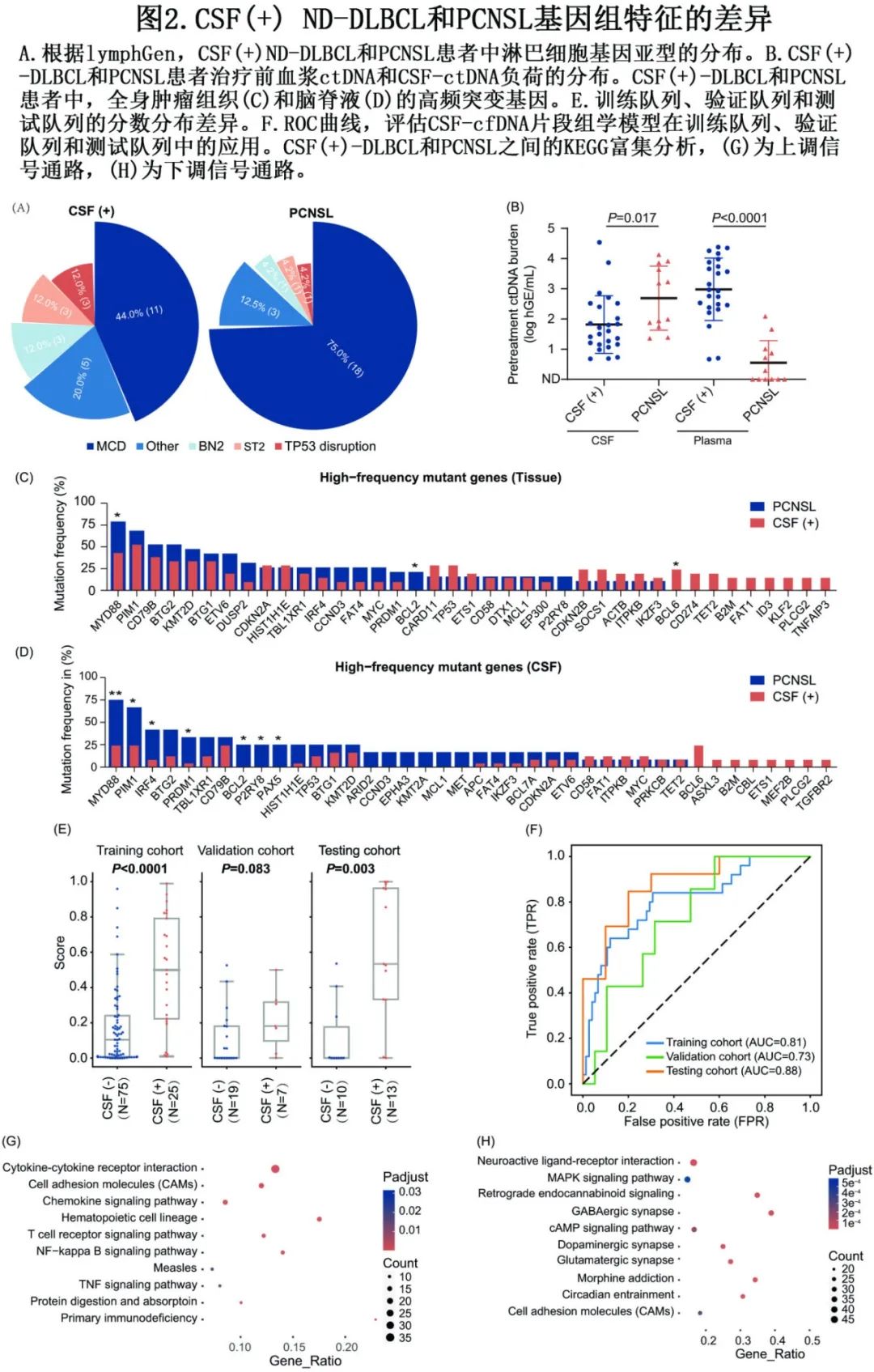
基于CSF-ctDNA突变谱,开发了一个机器学习模型来识别和分析CSF(+)和CSF(-)样本之间ctDNA片段特征的异质性。最终模型纳入拷贝数变异(CNV)和片段大小模式(fragment size pattern,FSP)特征,包括CSF中CNV和FSP的前三个曲线下面积(AUC) meta模型。该模型在训练队列(P<0.0001)和测试队列(P=0.003)中均显著区分CSF-ctDNA(+)和CSF-ctDNA(-)患者,但在验证队列中无差异(P=0.083)(图2E)。与此一致,训练和测试队列与验证队列相比,受试者工作特征(ROC)曲线的AUC值更高(图2F),表明性能更好。该结果的一个原因可能在于验证队列中很少有CSF-ctDNA(+)患者。
随后比较了CSF(+) ND-DLBCL和PCNSL患者组织样本的基因表达谱。在CSF(+) DLBCL患者的原发肿瘤组织中,细胞因子-细胞因子受体相互作用通路、细胞粘附分子和趋化因子信号通路激活,而在PCNSL患者中神经活性配体-受体相互作用和MAPK信号通路激活(图2G-H)。在CSF(+) ND-DLBCL患者中发现的这些独特的基因特征可能有助于SCNSL的发展。
与ND-DLBCL患者CSF-ctDNA阳性相关的临床和生物学因素
由于25%的ND-DLBCL患者为CSF(+),作者建立了一种预测ND-DLBCL中CSF浸润(CSFi)的风险评分模型。训练队列的单因素分析显示,CSF(+)与高危临床变量显著相关,包括晚期(P=0.009)、CNSi高危部位累及(乳腺、肾脏、肾上腺或睾丸)(P=0.007)、B症状(P=0.007)、ECOG评分2-4 (P=0.001)、血清乳酸脱氢酶(LDH)水平升高(P=0.037)、高危IPI评分(P=0.002)和高危CNS-IPI评分(P=0.002)(表1)。在验证队列中也观察到类似结果。
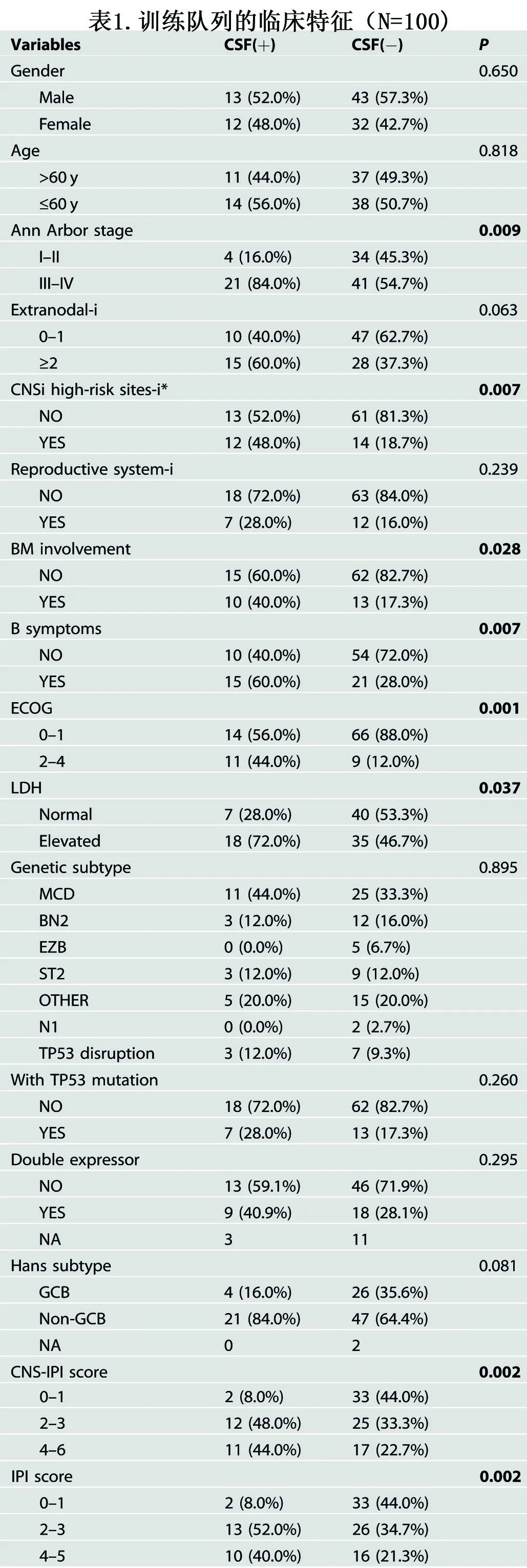
较高的血浆ctDNA负荷与CSF(+)显著相关(图3A)。在脑脊液(−)患者中,IPI评分与血浆ctDNA负荷呈正相关,而在脑脊液(+)患者中,IPI评分中危与高危患者之间的水平无差异(图3B)。CNS-IPI评分也显示类似结果。
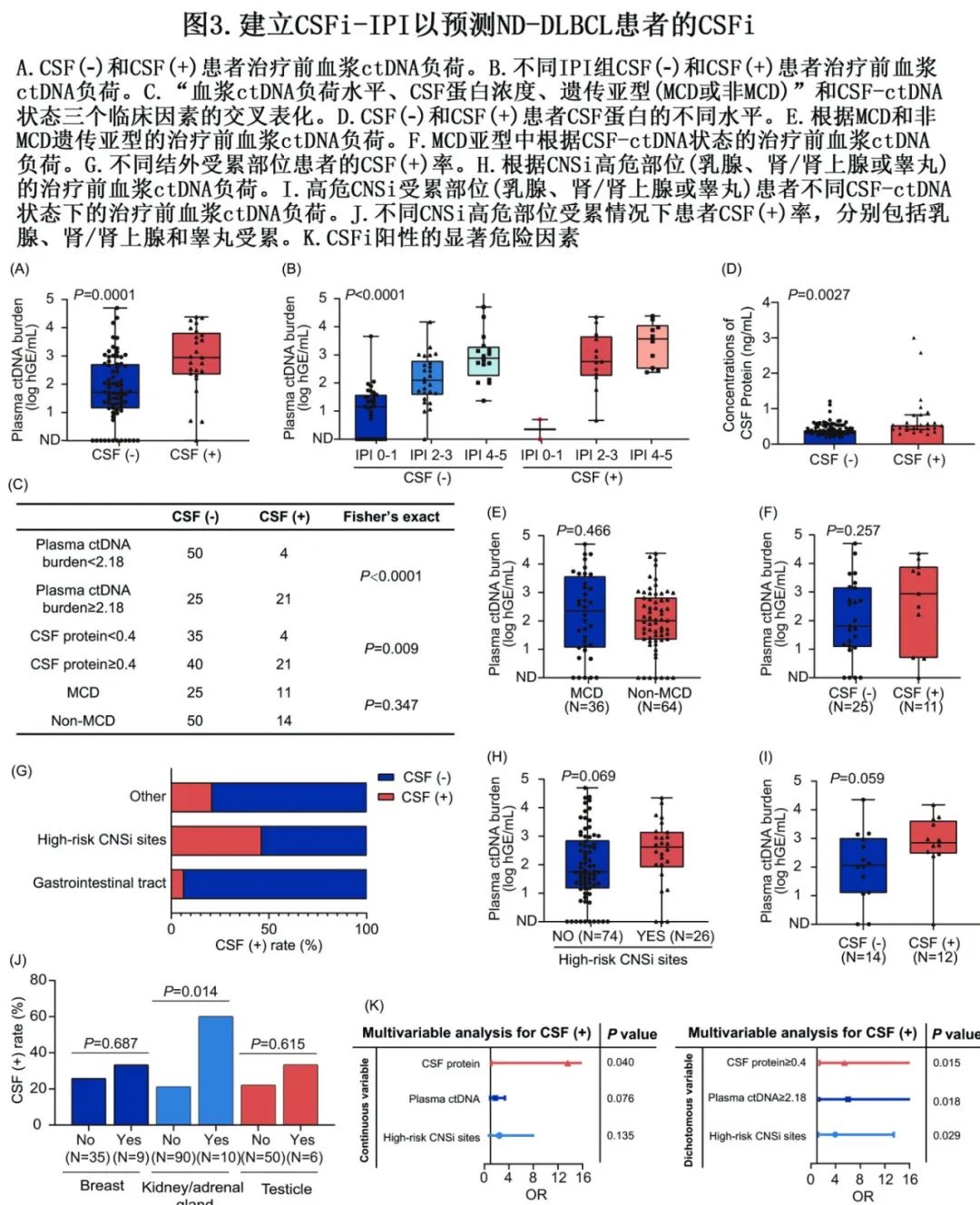
对于CSFi(+)预测,使用Youden指数确定血浆ctDNA负荷的最佳临界值为2.18(图3C)。此外,CSF蛋白水平与CSF(+)显著相关(P=0.0027;图3D),其最佳临界值为0.4(图3C),而CSF (+)与氯化物(CL)、葡萄糖或白细胞(WBC)计数水平之间没有关联。令人惊讶的是, MCD遗传亚型与CSF(+)无关,该结果与既往报道不一致 (图3C)。与此一致,MCD亚型与血浆ctDNA负荷也无关(图3E),但在其他高危临床因素中存在显著关联。此外,在非MCD亚型患者中,大多数高危临床因素与CSF(+)相关,而在MCD亚型患者中未观察到相关性,包括血浆ctDNA负荷(图3F)。该发现表明,在非MCD组中,高肿瘤负荷是CSF(+)的重要贡献因素,而在MCD组中则不是。CSF(+)与高危CNSi部位(包括乳腺、肾/肾上腺和睾丸)的受累显著相关,而CSF(-)与原发性胃肠道受累相关(图3G和表1)。此外,在高危CNSi部位的患者中发现有血浆ctDNA负荷更高的趋势(P=0.069,图3H)。在高危CNSi部位患者中比较CSF(+)组和CSF(-)组,也观察到类似趋势(P=0.059,图3)。具体来说,与其他两个高危部位相比,肾/肾上腺部位是CSF(+)的强预测因子(图3J)。
多因素分析确定了三个临床因素为CSFi阳性的独立预测因素:高CSF蛋白水平、高血浆ctDNA负荷和高危CNSi部位(图3K)。
ND-DLBCL与CSFi相关的驱动基因突变
为探索CSFi相关驱动突变,首先比较了CSF(+)和CSF(-)患者在组织(图4A)和血浆样本中的基因突变谱。PLCG2突变与CSF(+)显著相关(P=0.013),而JAK2 (P=0.056)、CARD11 (P=0.062)和ID3突变(P=0.088)也有一定趋势(图4B);FAT4突变(P=0.083)似乎与CSF(+)呈负相关。在MCD亚组中(图4C),CARD11 (P=0.048)突变与CSF(+)显著相关,而KLF2 (P=0.067)和MGA突变(P=0.080)也有一定趋势;但在非MCD亚组中(图4D),PLCG2 (P=0.040)和JAK2突变(P=0.040)与CSF-ctDNA阳性显著相关。在非MCD亚组中,FAT4突变(P=0.023)似乎也与CSF-ctDNA阳性呈负相关。
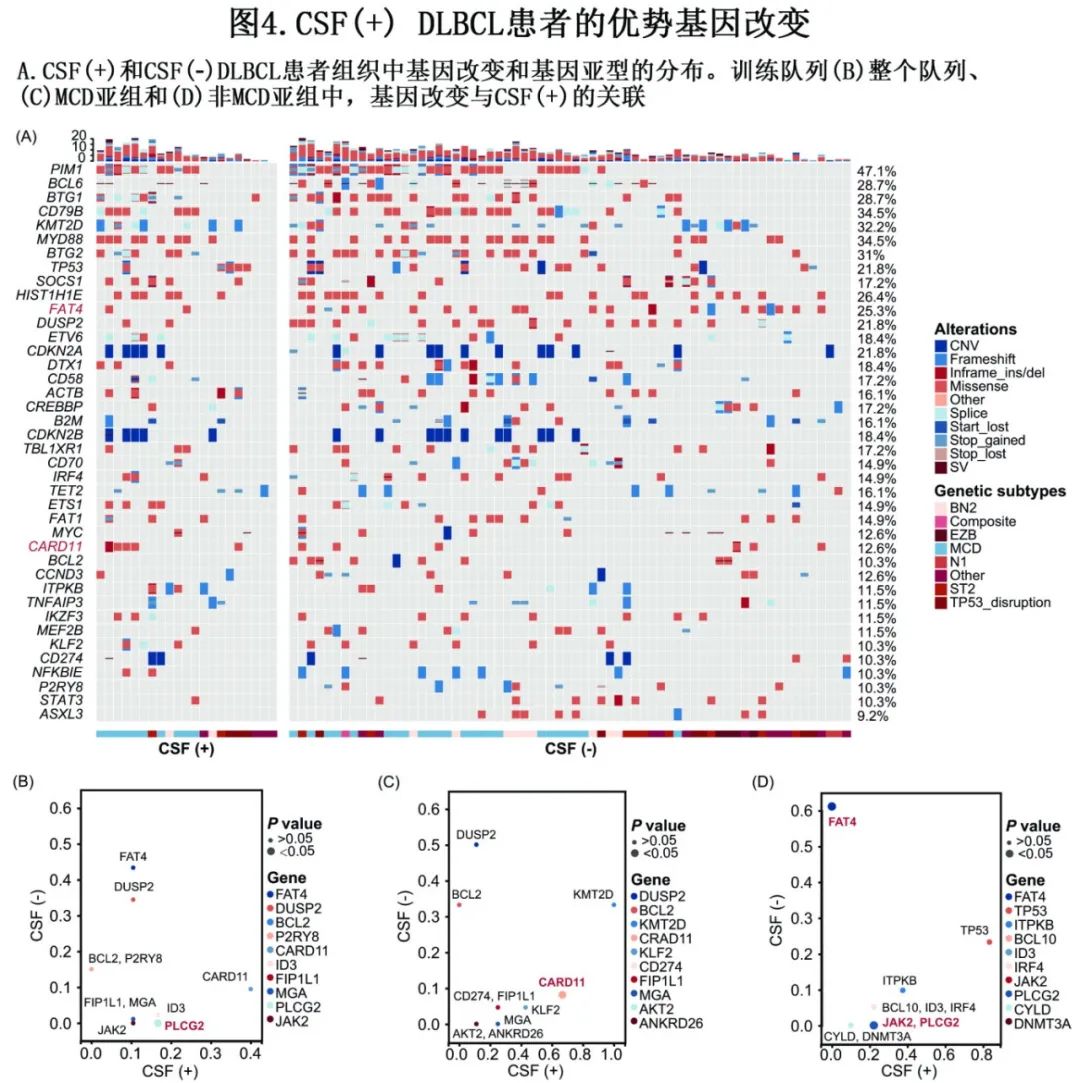
ND-DLBCL中促进CNS播散的潜在机制
为探索ND-DLBCL中CNS播散的潜在机制,比较了CSF(+)和CSF(-)患者的转录组变化(图5A)。CSF(+) DLBCL患者的下调基因显著富集于PI3K-AKT信号通路、局灶黏附、紧密连接、癌内通路、肌动蛋白细胞骨架调控、细胞黏附分子。为研究这些信号通路是否是CNS播散的潜在机制,发现在具有高ctDNA负荷、CARD11突变和FAT4野生型亚组的肿瘤细胞中显示了类似的结果(图5A)。图5B显示这六种通路中的主要基因,以供未来的机制研究。
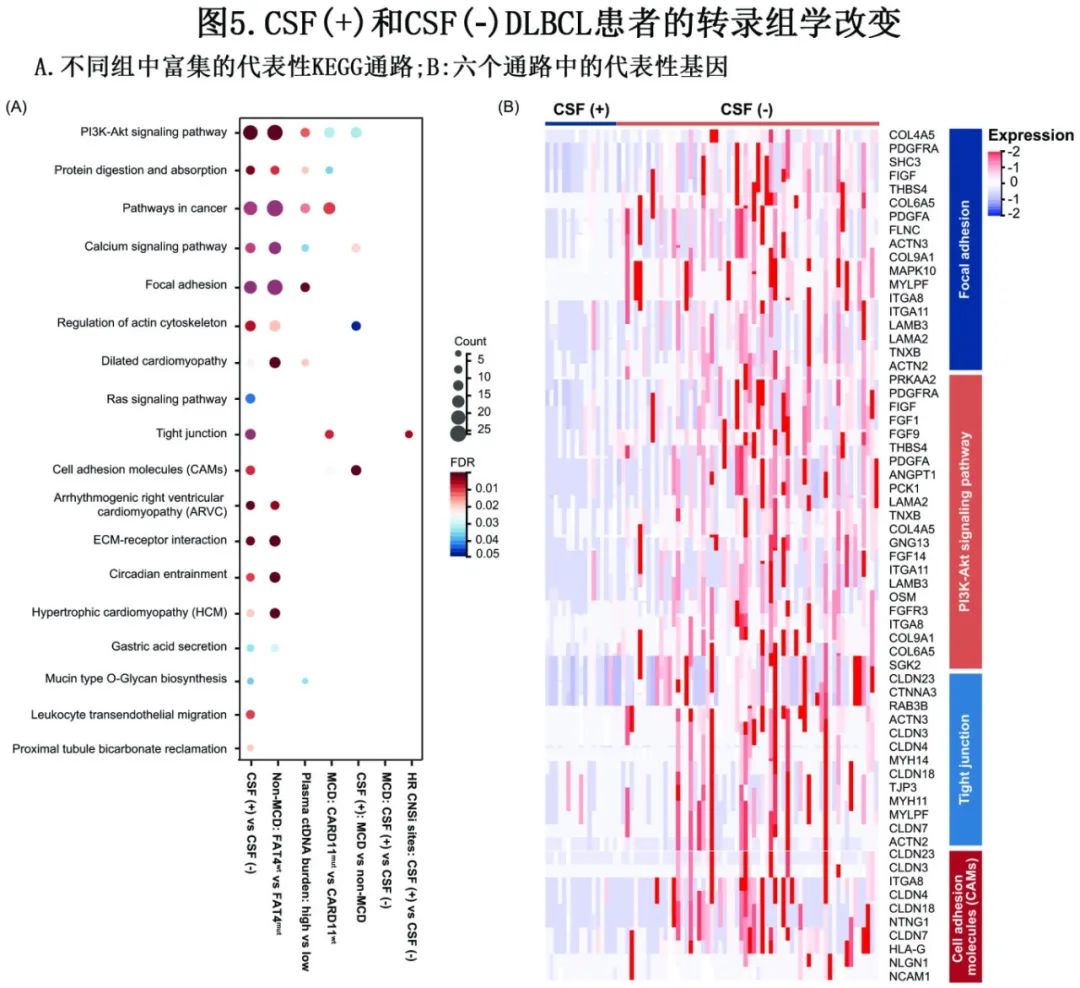
利用CSF-ctDNA监测CNS肿瘤负荷、治疗反应和肿瘤复发
在治疗结束时的缓解评估中,33.33% (24/72)的患者检测到血浆ctDNA(MRDend+)(图6A),CSF(+)与MRD end+显著相关(P=0.005)。CSF(+)组和CSF(-)组血浆ctDNA负荷的动态变化如图6B所示。训练队列的中位随访时间为10.1个月。治疗前CSF(+)转化为PFS和OS的不良结果(图6C, D)。
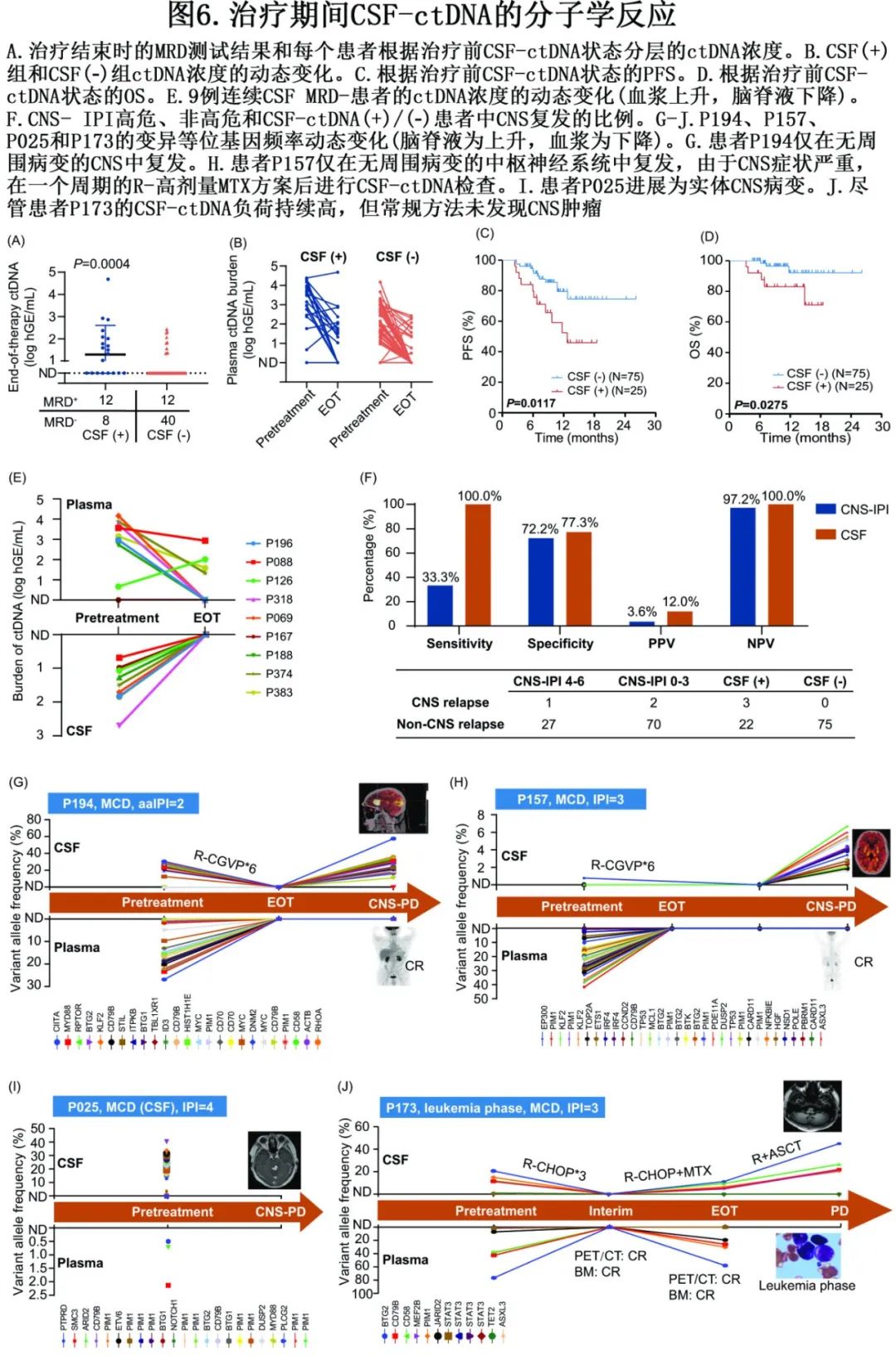
为验证传统预防是否可以清除CSF(+)患者的CSF-ctDNA负荷,评估了在治疗结束(EOT)或疾病进展的任何时间收集的CSF样本。25例脑脊液(+)患者中获得16例患者的动态EOT脑脊液样本,其中10例患者(6例MCD亚型,2例ST2亚型,1例BN2亚型,1例TP53突变)在治疗结束时CSF-ctDNA呈阴性,其中9例患者末次随访时仍保持CSF-ctDNA清除(图6E),另1例患者则进展为实体CNS肿瘤(图6G)。有趣的是,在治疗结束时达到CSF-ctDNA阴性的10例患者中,4例患者甚至没有接受特殊CNS治疗,只有6例患者达到血浆MRDend-(图6E、图6G)。对于其他在EOT或CNS进展时为CSF-ctDNA阳性的患者,CSF-ctDNA能够监测CNS肿瘤负荷并与血浆肿瘤负荷一致(图6G-J)。在25例CSF(+)患者中,3例患者克隆演变为CM检测的CNS实体病变(CNS复发)(图6G-I);而75例CSF(-)DLBCL患者直到末次随访也没有患者被诊断为CNS病变。因此,治疗前CSF-ctDNA预测CNS复发的敏感性为100%,特异性为77.3%。然而,3例CNS复发患者中只有1例为CNS-IPI高危,说明高危CNS-IPI预测CNS复发的敏感性仅为33.3%(图6F)。
总结
该研究中纳入100例连续ND-DLBCL患者为训练队列,另外前瞻性纳入26例ND-DLBCL患者为验证队列。训练组和验证组分别有25例(25.0%)和7例(26.9%)患者检测到CSF-ctCNA阳性(CSF(+)),显著高于常规方法检测到的CNS受累率。CSF (+)中CARD11、JAK2、ID3和PLCG2突变占优势,而FAT4突变与CSF(+)呈负相关。在CSF(+) ND-DLBCL中,PI3K-AKT信号通路、局灶黏附、肌动蛋白细胞骨架和紧密连接通路下调富集。此外,治疗前CSF(+)与不良预后显著相关。高CSF蛋白水平、高血浆ctDNA负荷和涉及高危部位是预测ND-DLBCL患者CSF(+)风险的三个危险因素。治疗前CSF-ctDNA预测CNS复发的敏感性和特异性分别为100%和77.3%。
综上所述,该研究首先介绍了CSF- ctCNA (+) DLBCL的发病率、基因组和转录组学特征,并强调了CSF- ct CNA作为一种非侵入性生物标志物,在检测和监测DLBCL的脑脊液浸润和预测CNS复发中的重要性。作者对ND-DLBCL患者CNS样本中ctDNA的综合分析,为通过液体活检更好地了解CNS浸润提供了路线图,并首次阐明ND-DLBCL中促进CNS播散的潜在机制。期望在检测和监测脑脊液浸润和预测ND-DLBCL的CNS复发方面有更有希望和更敏感的方法,从而在未来补充ND-DLBCL中CNS预防/治疗的临床标准。
参考文献
Liang, JH., Wu, YF., Shen, HR. et al. Clinical implications of CSF-ctDNA positivity in newly diagnosed diffuse large B cell lymphoma. Leukemia (2024). https://doi.org/10.1038/s41375-024-02279-7


