【AJH】浆母细胞淋巴瘤的诊断、风险分层和治疗:2024更新
时间:2024-05-26 06:01:35 热度:37.1℃ 作者:网络
浆母细胞淋巴瘤
浆母细胞淋巴瘤(PBL)是B细胞淋巴瘤中罕见且侵袭性较强的一种类型,发病机制尚不完全清楚,可能与HIV及EB病毒感染有关。PBL好发于感染HIV病毒、免疫功能缺陷、免疫抑制状态的患者,常与移植、免疫衰老、自身免疫性疾病、长期慢性炎症等因素相关;此外,免疫功能正常的群体也可发生。不同地区的研究人群中HIV+的PBL患者比例有较大差别,中国的PBL患者多为HIV-。
《American Journal of Hematology》近日发表综述,整理了浆母细胞淋巴瘤的诊断、风险分层和治疗。

疾病概述及发病机制
1997年,Delecluse等报道了16例侵袭性口腔淋巴瘤患者,其中15例感染HIV。恶性细胞类似于浆母细胞,为B细胞系但不表达CD20,因为可检测到免疫球蛋白基因重排。临床病程以化疗耐药、生存差为特点。浆母细胞淋巴瘤被第四版WHO淋巴瘤分类列为CD20阴性侵袭性非霍奇金淋巴瘤(NHL)。
PBL占所有HIV相关淋巴瘤的2%。美国国家癌症数据库(NCDB)的一项研究报告了2010年至2013年间共481例PBL,占弥漫性大b细胞淋巴瘤(DLBCL)所有病例的0.7%。尽管PBL与HIV感染有很强的相关性,但也有报道称PBL也可发生于在其他免疫缺陷(例如实体器官移植后)、自身免疫性疾病、惰性淋巴细胞增生性疾病转化事件以及(罕见)免疫功能正常的患者。
所有年龄和性别均可发病,但大多数患者为男性成人。PBL发生的中位年龄(55岁)低于DLBCL(68岁)。此外,HIV阳性患者诊断PBL的中位年龄(42岁)低于HIV阴性患者(55-62岁)。
临床上,PBL通常表现为结外受累,可影响任何器官。PBL的结外病变发生率(53%)高于DLBCL(35%),但晚期患者的比例相似,分别为57%和55%。结外最常见的受累部位包括口腔、胃肠道、淋巴结、鼻窦和皮肤,其他不太常见的受累部位包括骨骼、泌尿生殖系统、中枢神经系统、肝脏和肺部。
PBL的起源细胞为浆母细胞,其为经过体细胞超突变和类别转换重组的活化B细胞。PBL的发病机制尚不完全清楚,但慢性EB病毒(EBV)感染和MYC基因重排似乎起主要作用。慢性EBV感染通过潜伏膜蛋白1 (LMP-1)的过表达与B细胞的抗凋亡作用有关,潜伏膜蛋白1模拟CD40,提供T细胞样支持,并通过核因子κB诱导FLIP信号的表达,保护B细胞免受FAS介导的凋亡。此外,LMP-2A保护受感染的B细胞免受B细胞受体介导的凋亡。此外,EBV可产生BHRF-1(病毒BCL-2同源物),与BAK、PUMA、BID和BIM结合,阻止TGF–β介导的细胞凋亡。最后,EBNA-3A/3C可能阻止MYC诱导的细胞凋亡。
MYC最初在Burkitt淋巴瘤中发现,是癌症中最常失调的癌基因,MYC调节DNA复制、细胞增殖、生长、代谢和存活。BCL-6是生发中心B细胞中MYC的抑制因子,而BLIMP-1是终末分化B细胞中MYC的抑制因子。在PBL中,MYC基因重排导致其功能失调,从而克服BCL-6和BLIMP-1的调节作用。
尽管EBV感染和MYC基因重排在PBL中普遍存在,但并非所有病例都存在。因此,在PBL的发病机制中必须有其他机制的参与,这些机制可能与RAS-RAF、JAK-STAT、MCL1、IRF4、MAPK-ERK、PI3K-AKT、Wnt和NOTCH有关。PBL的病理生理机制如图1所示。
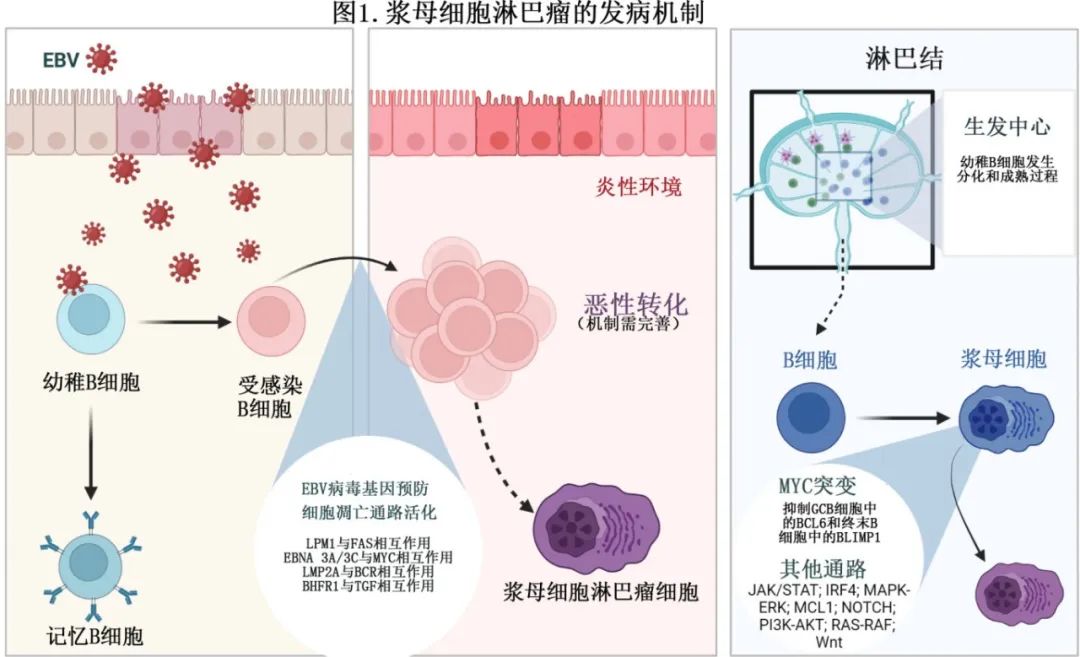
诊断与鉴别诊断
一旦怀疑PBL,最好的诊断方法是获得组织进行病理评估。考虑到PBL不寻常的形态和缺乏CD20表达,需要相对较大的样本,因此切除、切口或粗针穿刺活检均优于细针穿刺活检。与其他常见的侵袭性淋巴瘤类似,应使用PET/CT进行分期。临床分期应遵循Ann Arbor分期系统的Lugano修正。表1为其他诊断和分期检查及其临床意义。
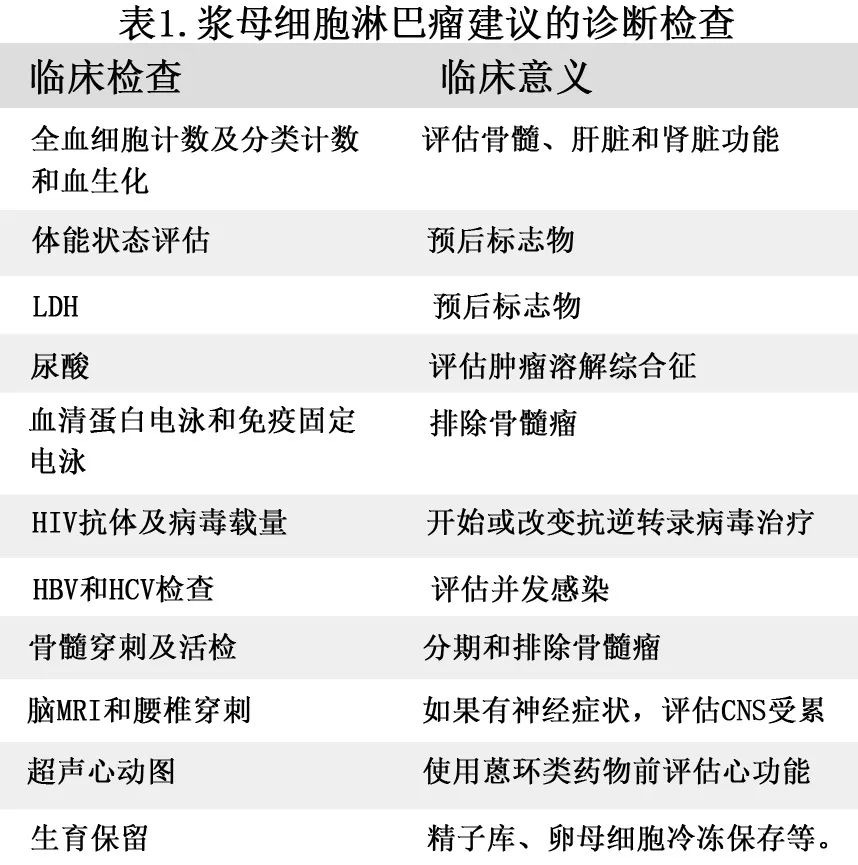
PBL的免疫表型特征为经典浆细胞分化阳性表达,如CD79a、IRF4/ MUM-1、BLIMP-1、CD38、CD138, B细胞标志物表达阴性(如CD20、PAX-5), CD19、CD45表达可变。部分病例 T 细胞标志物异常表达阳性,如CD2、CD3、CD4或CD8。几乎所有的肿瘤细胞都表达增殖标志物,如Ki-67。CD10、BCL2和 BCL6 表达不常见,与非生发中心起源一致。在66%的病例中检测到 EBV 编码 RNA(EBER) 或 EBV LMP-1 表达导致的 EBV 受累。分子检测发现,2/3的病例可检测到 MYC 重排。比较基因组杂交显示,PBL与 DLCBL 密切相关。
PBL 的鉴别诊断包括浆母细胞骨髓瘤 (PBM)、EBV+ DLBCL、ALK+ DLBCL、原发性渗出性淋巴瘤 (primary effusion lymphoma,PEL) 和HHV8+ 大 B 细胞淋巴瘤 (LBCL)。PBM 和 PBL 在形态和免疫表型上完全相同,但潜在的 HIV 感染和肿瘤细胞中检测到 EBER 倾向于PBL,而存在可检测血清单克隆副蛋白、肾功能不全和骨溶解病变则倾向于PBM。EBV+ DLBCL通常见于老年人,尽管EBV+ DLBCL中的恶性细胞可以具有浆母细胞形态,但 CD20普遍表达。PEL 与 HHV8 感染密切相关,临床表现为胸腔或心包积液或腹水;其腔外肿块极为罕见,可带来诊断挑战。ALK+ DLBCL是一种侵袭性 CD20 阴性淋巴瘤,可具有浆母细胞形态;但普遍存在ALK,通常与 HIV 感染或 EBER 表达无关。此外,涉及 ALK 基因的细胞遗传学异常,如t(2;17)等,是ALK+ DLBCL的典型特征。最后,HHV8+ LBCL也是一种侵袭性 CD20 阴性淋巴瘤,可见于潜在HIV 感染的患者,但可通过潜在的 IgA-或 IgG-lambda 轻链限制性以及与 HHV8 感染和多中心 Castleman 病的强相关性进行鉴别。PBL 的特征及鉴别诊断见表2。
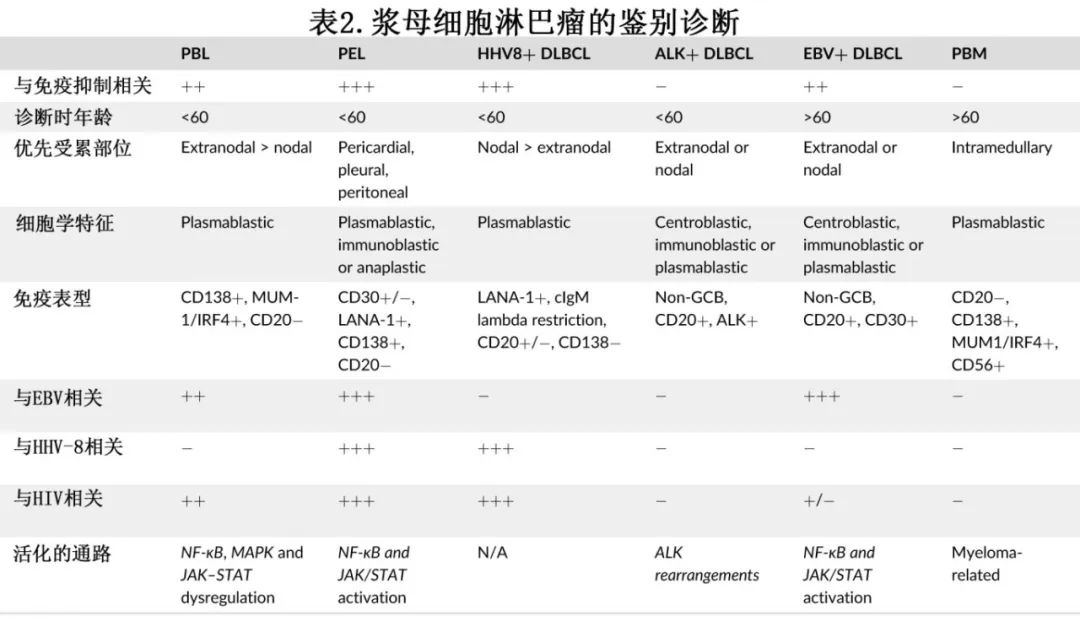
风险分层及预后
历史上标准治疗的预后很差。在Delecuse等首次报道的病例系列中,未报道患者的预后。最初,大量文献综述一致表明PBL患者的生存率较低。在一项对112例HIV阳性病例的研究中,中位总生存期(OS)为15个月,但包括治疗和未治疗的患者。另一项文献综述显示,70例接受标准化疗的HIV阳性PBL患者的中位生存期也很差,为14个月。76例HIV阴性PBL患者的中位生存期较短,为9个月。
一项对2000年至2010年间诊断和治疗的50例HIV阳性PBL患者的多中心回顾性研究显示,中位生存期为11个月。同样,法国的一项研究纳入2008年至2014年间诊断的82例PBL患者,报告2年无事件生存率(EFS;死亡、进展或失访)为41%。AIDS恶性肿瘤协会报告12例HIV阳性PBL患者1年总生存率为67%。LYSA小组报告了一项大型回顾性队列研究,包括2000年至2015年间135例患者(56例HIV阳性,17例为移植后,62例免疫功能正常),中位OS为32个月。一项欧洲跨国研究报告了49例PBL患者的2年OS为61%。最近一项针对加拿大不列颠哥伦比亚省1997年至2019年间诊断和治疗的42例PBL患者的研究中,中位OS为27个月。中国一项多中心回顾性研究评估了2008年至2019年期间接受治疗的102例PBL患者,2年OS率为65%。一项来自澳大利亚、加拿大、新加坡和英国的281例1999年至2020年间诊断为PBL的患者的大型回顾性队列研究中,中位OS为1.7年,5年OS为36%。
关于PBL预后的其他资料来自基于人群的研究。在一项NCDB研究中,包括481例PBL和68402例DLBCL患者,PBL与DLBCL患者相比,死于任何原因的风险高1.7倍。PBL患者的中位OS为15个月,而DLBCL患者为56个月,3年OS分别为40%和59%。在另一项使用SEER数据库的研究中,2010年至2016年诊断的248例PBL的3年OS为54%。
预后因素
鉴于该疾病的罕见性,大多数预后因素的数据来自回顾性病例系列。本综述汇集了来自已发表研究的数据,这些数据评估了临床和病理因素(即年龄≥60岁、晚期临床分期、高/中高危IPI评分、HIV状态、EBER表达和MYC基因重排)。
7项研究评估年龄≥60岁和<60岁,这些研究的综合效应为风险比(HR) 1.44(图2A)。一项研究在HIV阳性PBL患者中发现其与生存率没有关联。
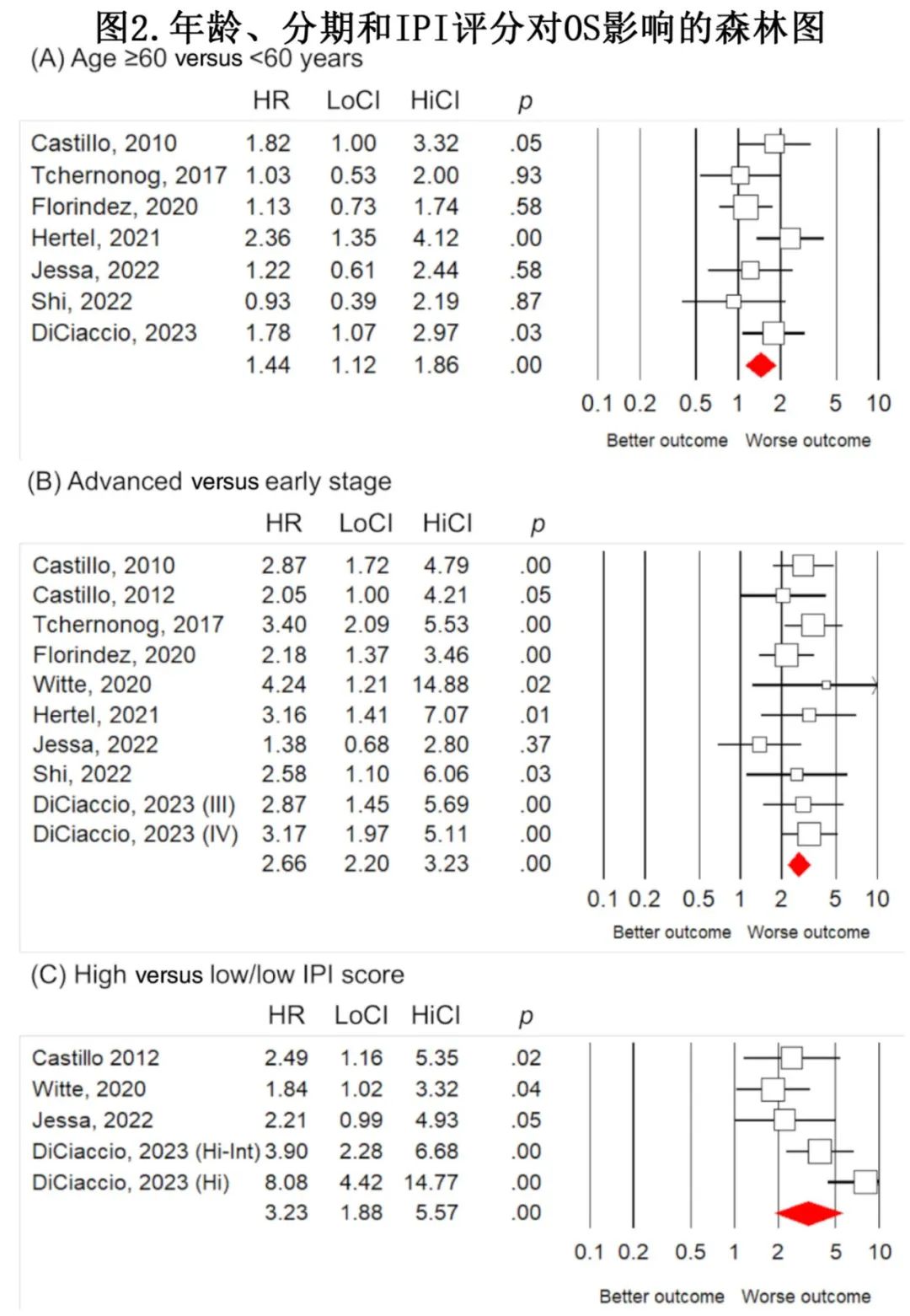
9项研究评估了晚期和早期,合并的效应为HR 2.66 (图2B)。两项研究报告了晚期和较差生存率之间的显著关联,但没有报道效应大小。
四项研究报告了IPI评分对PBL患者生存的影响,合并的效应大小为HR 3.23(图2C)。一项针对49例欧洲PBL患者的多中心回顾性研究报告,IPI评分高与低患者的2年OS率分别为11%和80%。德国一项对78例PBL患者的研究证实IPI评分的预后价值,并报道了NCCN-IPI评分比IPI评分更适合。后两项研究没有报告效应大小。
四项研究报告了HIV阳性与HIV阴性状态的效应大小,合并的效应值为HR 0.81。一项基于SEER的研究报告,HIV阳性和HIV阴性患者的2年OS分别为50%和35% (p=0.39)。三项研究报告艾滋病毒状态和生存之间没有关联,但没有提供效应大小。
五项研究报告了对PBL中EBER表达对OS的效应大小,合并的效应值为HR 0.66。另外两项研究报告没有发现EBER表达对OS的影响。注:不同研究之间的EBER阳性截止值并不一致。
四项研究报告了MYC基因重排对PBL患者OS的影响大小,合并的效应值为HR 1.93。
根据已发表的文献,年龄≥60岁、晚期和高/中高IPI评分与PBL的预后较差相关,而HIV状态、EBER阳性和MYC基因重排的预后作用尚不清楚。
当前治疗
PBL的治疗方法取决于几个因素,包括与HIV感染的关系、肿瘤的位置和扩展及治疗目标。目前没有标准治疗方案,但最常用的方法为联合化疗。
大多数关于PBL治疗的数据推导自HIV相关NHL,方案为用于治疗侵袭性亚型的联合化疗方案,包括CHOP(环磷酰胺、阿霉素、长春新碱和强的松)或CHOP样方案、hyper-CVAD-MA (超分隔环磷酰胺、长春新碱、阿霉素、地塞米松、大剂量甲氨蝶呤和阿糖胞苷)、CODOX-M/IVAC(环磷酰胺、长春新碱、阿霉素、大剂量甲氨蝶呤/异环磷酰胺、依托泊苷和大剂量阿糖胞苷)和EPOCH(依托泊苷、泼尼松、长春新碱、环磷酰胺和阿霉素)。
EPOCH在侵袭性淋巴瘤中的应用是基于一项回顾性研究,该研究分析了来自19项前瞻性临床试验的1546例HIV相关淋巴瘤患者,以评估治疗特异性因素及其对完全缓解(CR)率、无进展生存期(PFS)和OS的影响。在这项研究中,6%的患者为PBL。在单因素和多因素分析中,EPOCH治疗的OS优于CHOP。因此,NCCN建议使用比CHOP更强化的方案治疗PBL。
考虑到淋巴瘤和骨髓瘤之间的共同细胞起源,治疗PBL的一种新方案为在EPOCH中添加硼替佐米(V-EPOCH)。在回顾性研究中,16例患者接受4至6个周期的V-EPOCH伴或不伴放疗。硼替佐米的剂量为1.3 mg/m2 SQ或IV,每个EPOCH周期给药,每周一次或两次。15例患者(94%)达到缓解,1例(6%)达到部分缓解。中位随访为48个月,中位OS为62个月。5年总生存率为63%;HIV+患者中没有死亡病例。一些报告显示,在一线治疗中,对于HIV阳性和HIV阴性的PBL患者,硼替佐米加化疗的缓解和生存结局一致且令人鼓舞。
一项纳入美国80例早期PBL患者的研究中,3年OS约为80%,化疗后放疗的患者有更好的预后趋势。一线EPOCH患者的PFS优于CHOP患者。在I期和II期疾病及HIV阳性和HIV阴性PBL患者之间,PFS和OS没有差异。
自体干细胞移植(SCT)是一线治疗及复发患者的选择。高效抗逆转录病毒疗法(HAART)的出现使得自体SCT成为HIV+患者的可行选择。Al-Malki等回顾性分析了20例首次CR (CR1)或CR2的PBL患者自体SCT,1年和3年OS分别为69%和45%。一项欧洲登记组研究分析了接受自体SCT的24例PBL患者,发现67%的患者在一线治疗后接受了自体SCT治疗,50%达到CR, 17%达到PR;2年复发率为30%,包括7例原发难治性患者中2例复发,并且SCT治疗后4个月以上没有复发。但其随访期相对较短,为30个月。此外,异基因SCT治疗PBL的经验仅限于病例报道。
尽管有病例报道报告了HIV阳性患者在HAART治疗后PBL的自发消退,或自身免疫性疾病患者的免疫抑制减轻,但大多数患者仍需要全身抗肿瘤治疗。目前不推荐单独HAART和减少免疫抑制作为PBL的标准治疗。
基于有限的可用数据,建议对晚期患者使用6个周期的EPOCH±硼替佐米。对于早期疾病的患者,推荐4个疗程的EPOCH±硼替佐米,随后30Gy巩固放疗。如果可行,可考虑对CR1高危患者进行自体SCT。高危疾病包括HIV阴性、IPI评分高和存在MYC基因重排。反应评估应遵循目前对侵袭性淋巴瘤的建议。应对所有HAART未暴露HIV+患者增加HAART治疗,或对CD4+计数低或HIV载量高的HIV+患者改用更有效的联合治疗。对于复发,推荐针对侵袭性淋巴瘤设计的方案,并考虑合并硼替佐米、达雷妥尤单抗或来那度胺,然后对化疗敏感疾病进行自体SCT治疗。提出的治疗策略如图3所示。
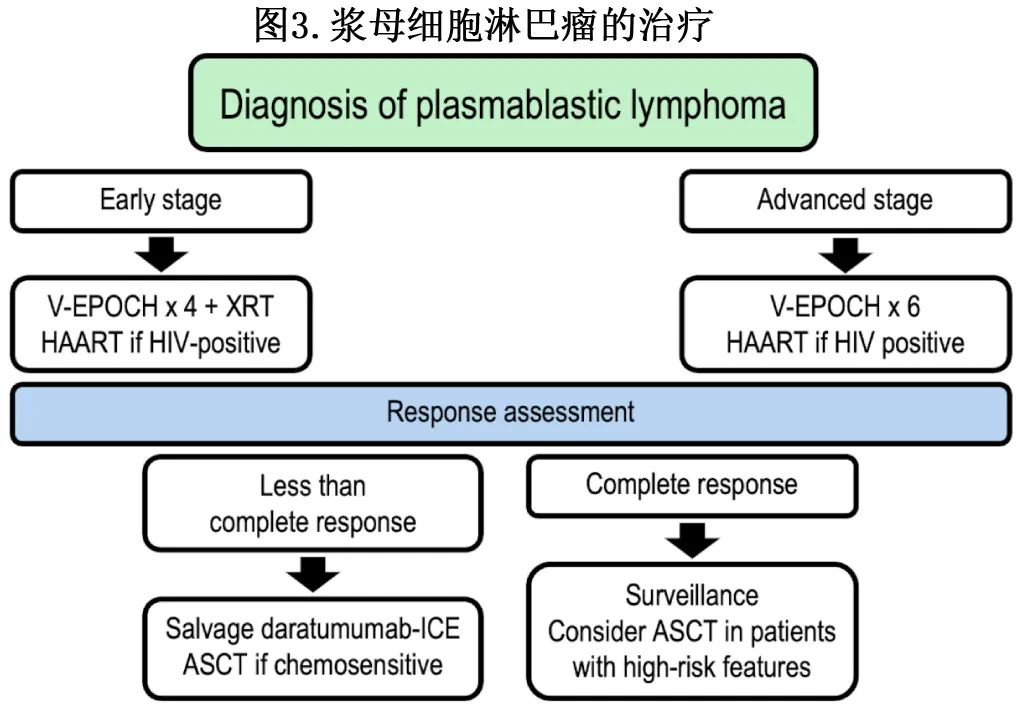
对于衰弱患者、CNS受累患者、心脏、肾脏或肝功能不全患者,目前的数据不足以提供具体建议,这些患者应根据目前的NCCN DLBCL指南和治疗医师的临床判断进行管理。
未来方向
达雷妥尤单抗是治疗PBL患者的一种创新方法。一项纳入7例患者的回顾性研究显示,在可评估的患者中,达雷妥尤单抗加EPOCH治疗的CR率为83%,2年OS率为57%。达雷妥尤单抗联合ICE(异环磷酰胺、卡铂和依托泊苷)治疗4例复发性PBL患者有效,其中2例在达雷妥尤单抗+ICE后行ASCT,报告发表时有三例仍存活。
考虑到细胞系,其他新治疗选择为免疫调节剂,如来那度胺或泊马度胺。一些病例报告支持在复发或难治性PBL患者中单独或联合使用来那度胺。在一线中,来那度胺与CHOP或环磷酰胺和地塞米松联合使用可诱导CR。在复发中,来那度胺与硼替佐米、达雷妥尤单抗或替雷利珠单抗联合治疗可诱导缓解。来那度胺单药治疗仅诱导短期缓解。一例患者在帕博利珠单抗治疗PBL失败后,泊马度胺治疗未成功。
高达30%的PBL表达CD30。维布妥昔单抗(BV)可用于治疗经典霍奇金淋巴瘤和表达CD30的T细胞淋巴瘤。只有少数病例报告BV对复发性PBL有效。
PD-1和PD-L1在PBL中也有过表达和生物活性。一例早期复发HIV-老年PBL患者在帕博利珠单抗加放射治疗后持久CR。其他病例报告了在复发性PBL患者中使用抗pd-1单克隆抗体的成功率较低。
CAR-T治疗PBL的经验有限,但前景广阔。一例年轻患者在接受免疫化疗和抗CD19 CAR-T治疗急性淋巴细胞白血病后发生PBL。对于PBL,患者接受硼替佐米和化疗,然后进行相合亲缘异基因SCT。在PBL复发时,患者暴露于含达雷妥尤单抗方案而无反应,后接受抗BCMA CAR-T(cilta- cell)并在CAR-T暴露后14个月持续CR。
其他对DLBCL或骨髓瘤有活性的药物,包括维泊妥珠单抗、赛利尼索、艾沙妥昔单抗 、CELMODS、PGRCD5双特异性抗体和CAR-T,在PBL的治疗中有一定关注。
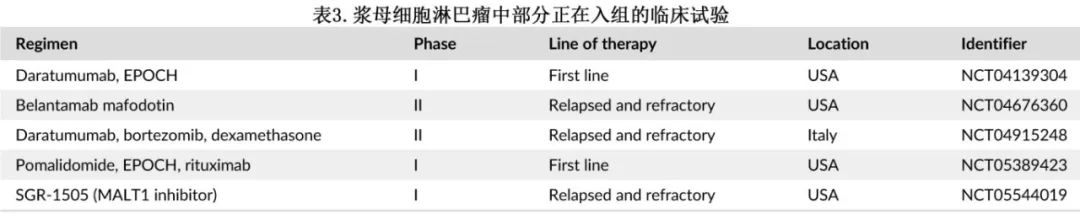
PBL患者应考虑在疾病的任何阶段进行临床试验。表3为部分正在进行的临床试验。
总结
PBL的诊断和治疗仍存在挑战,大多数患者使用标准治疗下生存时间短。添加非化疗药物,如硼替佐米、来那度胺和达雷妥尤单抗似乎可改善结局,但还需要前瞻性研究来证实这些初步观察结果,有些研究正在进行中。将PBL患者纳入临床试验至关重要。
参考文献
Ramirez-Gamero A, Martínez-Cordero H, Beltrán BE, Florindez J, Malpica L, Castillo JJ. Plasmablastic lymphoma: 2024 update on diagnosis, risk stratification, and management. Am J Hematol.2024;1‐9. doi:10.1002/ajh.27376


