赵东元院士团队ACS Nano: 近红外光触发的Janus介孔纳米马达在增强肿瘤穿透和光动力疗法中的应用
时间:2024-05-28 18:00:20 热度:37.1℃ 作者:网络
由于其出色的光电特性,能够在光激活过程中产生细胞毒性活性氧(ROS),二氧化钛(TiO2)纳米材料在光动力治疗(PDT)实体肿瘤方面展现出了巨大潜力。然而,TiO2基光敏剂和PDT激发源(紫外/可见光)在面对复杂的肿瘤微环境(TMEs)时,其有限的穿透深度仍然是一个巨大的挑战。在这里,复旦大学赵东元/李晓民&卡塔尔大学 Ahmed A. Elzatahry提出了一种H2O2驱动的黑色TiO2介孔纳米马达,具有近红外(NIR)光吸收能力和自主导航能力,这在NIR光触发的PDT中有效增强了实体肿瘤的穿透力。该纳米马达基于Janus介孔纳米结构合理设计和制造,由近红外光响应的黑色TiO2纳米球和酶修饰的周期性介孔有机硅(PMO)纳米棒组成,后者环绕在TiO2纳米球周围。过表达的H2O2可以在PMO域中催化酶的催化下驱动纳米马达在TME中运动。通过精确控制Janus纳米结构中TiO2和PMO隔室的比例,TiO2&PMO纳米马达可以实现最佳的自推进方向性和速度,增强细胞摄取并促进深层肿瘤穿透。此外,通过分解实体肿瘤内源性H2O2,这些纳米马达可以连续供应氧气,以实现在黑色TiO2的NIR光催化下高效产生ROS,从而加强PDT效果并有效抑制肿瘤。该研究题为“Black Titania Janus Mesoporous Nanomotor for Enhanced Tumor Penetration and Near-Infrared Light-Triggered Photodynamic Therapy”发表在《ACS Nano》

图1展示了Janus介孔H-TiO2−x&PMO-CAT (HTiPC)纳米马达的制造过程以及其在增强肿瘤穿透和近红外光触发的光动力疗法中的应用。该纳米马达由近红外光响应的H-TiO2−x纳米球和包裹其上的催化酶(CAT)修饰的周期性介孔有机硅(PMO)纳米棒组成,利用TME中过量的H2O2作为驱动力,在PMO区域的CAT催化下分解产生O2和H2O,为纳米马达提供动力。这种设计不仅增强了纳米马达在复杂肿瘤微环境中的穿透力,而且通过HTiO2−x亚单位的高效NIR光吸收和活性位点的最大化暴露,实现了高效的ROS产生,从而在NIR激光照射下,有效地促进了肿瘤细胞的氧化和凋亡。此外,HTiPC纳米马达通过分解实体瘤内的内源性H2O2,持续供应氧气,进一步增强了光动力疗法的效果,实现了有效的肿瘤抑制。
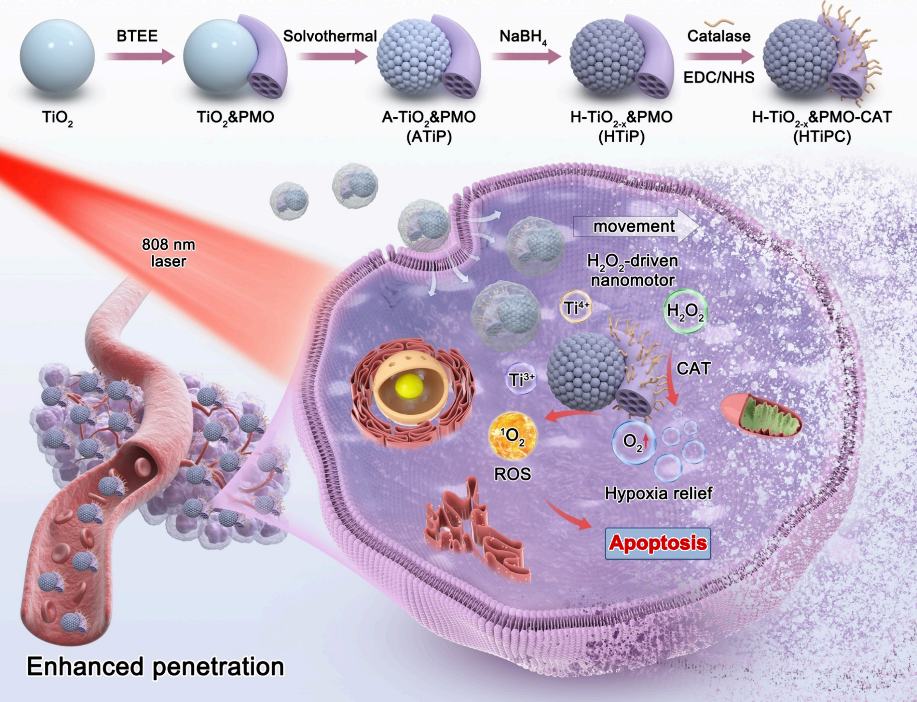
图1. Janus介孔H-TiO2−x&PMO-CAT (HTiPC)纳米马达的制造示意图以及纳米马达在增强肿瘤穿透力和近红外光触发光动力疗法中的应用。
【Janus HTiPC纳米马达的特性】
图2通过透射电子显微镜(TEM)图像,观察到PMO纳米棒以特定方式附着在TiO2纳米球上,形成了规则的Janus结构,并且PMO纳米棒具有高度有序的二维六角介孔结构。元素映射图像进一步确认了纳米复合材料的Janus几何结构和元素分布。氮气吸附-脱附等温线(D)和X射线衍射(XRD)图案表明,经过溶剂热处理后,非晶态TiO2转变为纯锐钛矿相,并且HTiP纳米复合材料显示出典型的IV型等温线和约425 m² g⁻¹的BET表面积。紫外-可见-近红外(UV−vis-NIR)吸收光谱显示,与原始的A-TiO2&PMO相比,HTiP纳米复合材料在可见光到近红外区域的光吸收得到了增强,带隙从2.91 eV降低到2.06 eV,这表明材料对NIR光有了响应性。此外,zeta电位分析(I)和傅里叶变换红外(FTIR)光谱测量证实了CAT酶在PMO区域的成功修饰。

图2.Janus HTiPC纳米马达的特性
【Janus HTiPC纳米马达的自推进运动分析】
图3通过调节BTEE与TiO2前驱体的比例,成功合成了三种不同H-TiO2−x和PMO体积比的Janus纳米马达(HTiPC-i, HTiPC-ii, HTiPC-iii),并通过TEM和SEM图像展示了它们的流体动力学尺寸和形态。利用轨迹分析系统研究了HTiPC纳米马达在不同浓度H2O2溶液中的自推进运动,观察到随着H2O2浓度的增加,纳米马达的运动方向性增强,这一点通过定义线性位移与总行程距离的比值作为方向性值来量化,并发现HTiPC-ii纳米马达在200 μM H2O2溶液中的方向性值可高达0.41。通过计算平均平方位移(MSD)与时间间隔(Δt)的关系,确认了纳米马达的运动可以通过MSD与Δt的线性关系来准确描述,表明了其有效的扩散系数(Deff)随H2O2浓度的增加而增加。此外,通过计算纳米马达在H2O2溶液中的平均速度(v),发现其速度随着H2O2浓度的增加而单调增加。比较了三种不同体积比的Janus HTiPC纳米马达在100 μM H2O2溶液中的运动行为,发现HTiPC-ii纳米马达展现出最显著的方向性运动,具有最高的Deff和平均速度,表明其具有最佳的自推进潜力。
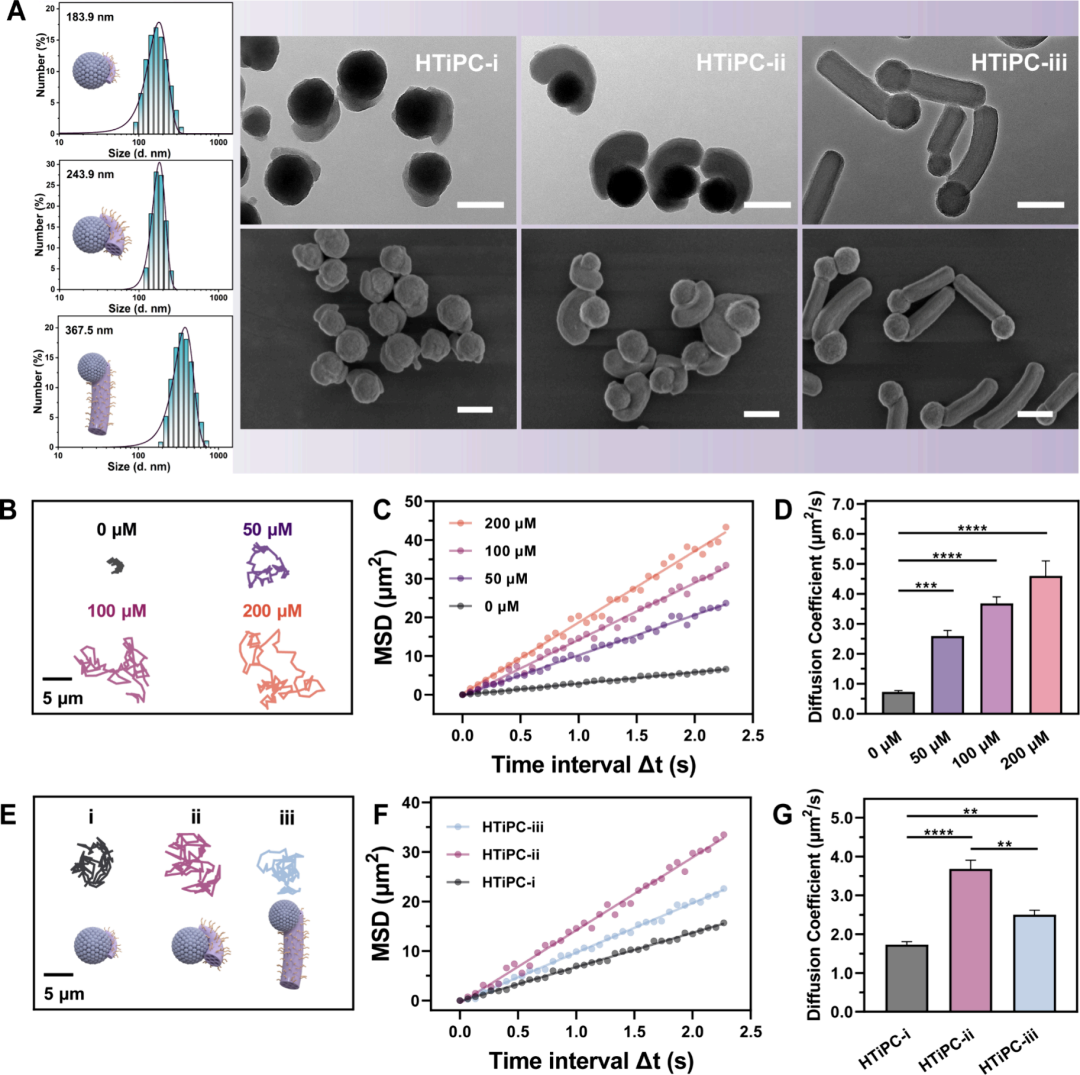
图3. Janus HTiPC纳米马达的自推进运动分析
【Janus HTiPC纳米马达的增强扩散行为】
图4通过感应耦合等离子体质谱(ICP-OES)定量分析了HTiPC-i、ii和iii纳米马达与HTiP-i、ii和iii纳米复合材料的细胞摄取效率,发现HTiPC-ii纳米马达展现出最高的细胞摄取效率,约为43.3%,而其他组的摄取效率则显著较低。共聚焦激光扫描显微镜(CLSM)图像显示,与缺乏表面修饰的HTiP纳米复合材料相比,HTiPC纳米马达具有更强的绿色荧光信号,表明其通过内吞作用进入细胞的效率高。此外,通过LysoTracker Red和Hoechst 33342的染色,研究了纳米马达在细胞内化后的分布情况,发现HTiPC纳米马达具有逃避溶酶体吞噬的能力,这通过Pearson相关系数的降低得到了证实,表明其在逃避溶酶体吞噬方面具有显著效果。最后,通过建立3D CT26肿瘤球体模型并用FITC标记的HTiPC纳米马达进行孵育,观察到与缺乏自推进力的HTiP纳米复合材料相比,HTiPC纳米马达在整个3D MTSs中显示出显著增强的荧光信号,证明了其在三维肿瘤模型中具有优越的穿透能力。
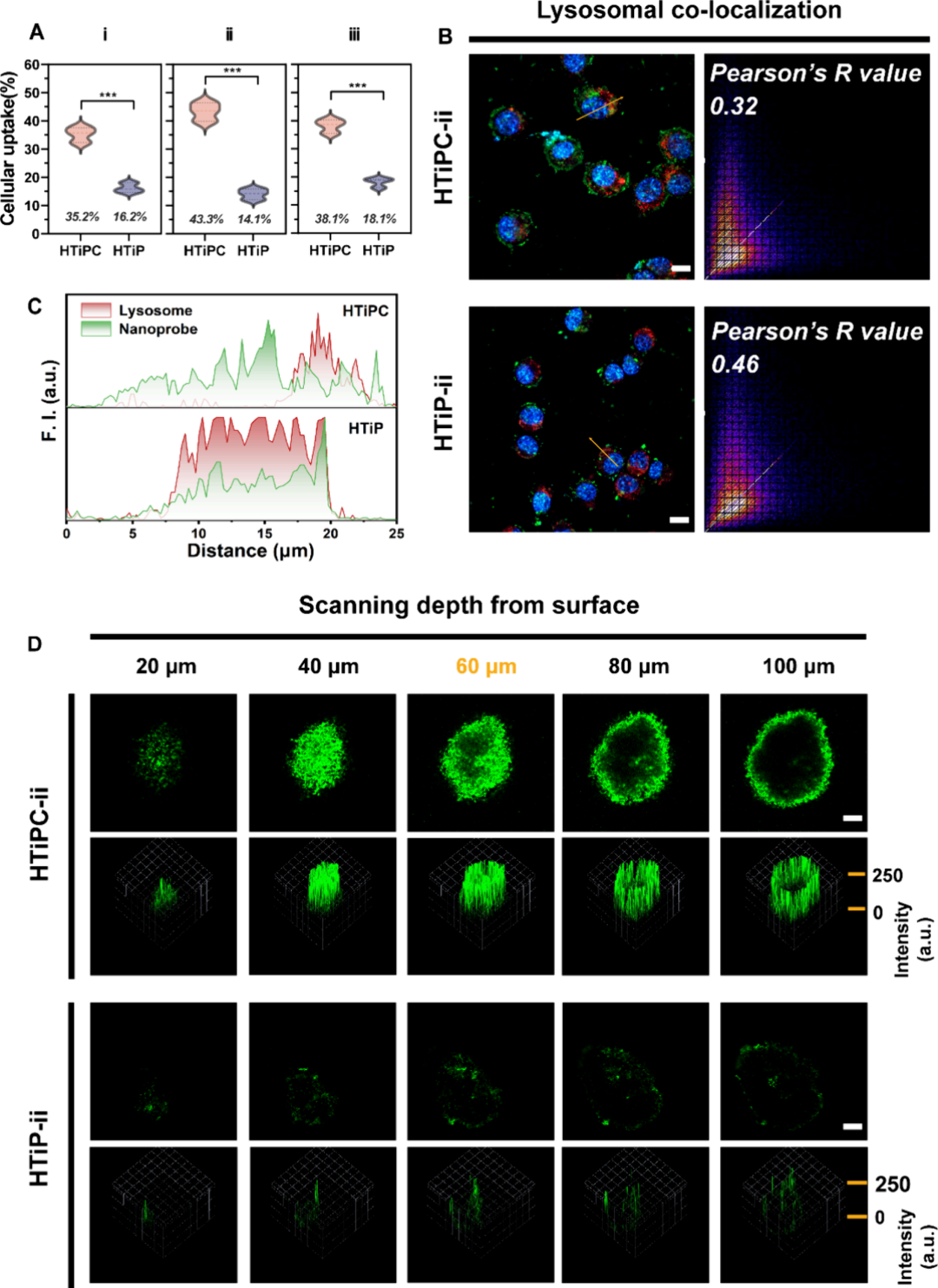
图4. Janus HTiPC纳米马达的增强扩散行为
【Janus HTiPC纳米马达的体外活性氧(ROS)检测】
图5通过电子自旋共振(ESR)谱图确认了HTiPC纳米马达在808 nm NIR激光辐照下能够产生单线态氧(1O2),表现出典型的1:1:1三重峰模式。使用1,3-二苯基异苯并呋喃(DPBF)作为分子探针,通过监测410 nm处的吸收强度变化来评估NIR辐射下激活的ROS生成效率,结果表明含有HTiP或HTiPC的DPBF水溶液在808 nm辐照下与对照组相比显示出显著降低的吸收,证实了1O2的产生。此外,通过分析不同时间点DPBF在410 nm处的统计吸收强度,发现在H2O2存在的情况下HTiPC的ROS生成效率显著高于无H2O2时,表明HTiPC纳米马达上的CAT酶分解H2O2生成大量O2,增强了光敏剂的ROS生成能力。在低氧条件下(在氩气氛围中)评估HTiPC的ROS生成能力,结果显示最终没有显著降低,这进一步证实了HTiPC纳米马达在NIR激发下依赖O2增强的ROS生成能力。同时,通过测定H2O2溶液中溶解O2水平来评估固定在纳米马达上的CAT的活性,结果显示HTiPC纳米马达具有约35.2 ppm/(μg CAT·min)的O2生成速率,与游离CAT相比降低了约35%,表明CAT活性在纳米马达表面得到了良好的保持。
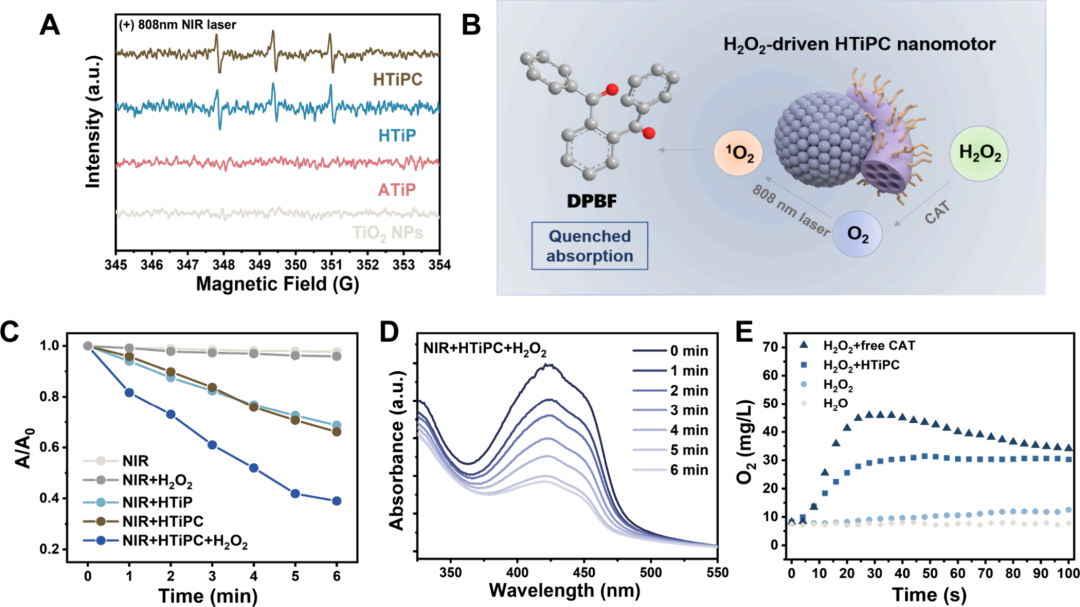
图5. Janus HTiPC纳米马达的体外活性氧(ROS)检测
【Janus HTiPC纳米马达的体外抗肿瘤治疗和细胞内ROS检测】
图6通过细胞计数试剂盒-8(CCK-8)法评估了HTiPC纳米马达和HTiP纳米复合材料对4T1和CT26细胞的毒性,结果显示即使在较高剂量下,它们也显示出良好的生物相容性和非毒性。CT26细胞经过不同处理后,通过NIR激光辐照的HTiPC纳米马达展现出了优越的抗肿瘤能力,导致的死亡率约为81.9%,显著高于缺乏表面功能化CAT的HTiP纳米复合材料(约56.8%),而其他对照组的治疗效果低于10%。使用2,7-二氯二氢荧光素二乙酸酯(DCFH-DA)作为荧光探针检测了细胞内ROS的生成,CLSM图像和相应的流式细胞仪分析显示,仅NIR激光或HTiPC纳米马达单独处理时细胞内氧化DCFH的绿色荧光非常弱,而HTiPC处理的CT26细胞在NIR激光辐照下显示出最强烈的荧光信号,表明细胞内ROS水平迅速上升。此外,活/死染色和定量分析进一步证实了对照组中活细胞的存在比例更高。通过Annexin V-FITC和碘化丙啶(PI)对细胞凋亡进行分析,结果表明,使用HTiPC纳米马达进行的PDT处理导致早期和晚期凋亡率分别显著提高至9.9%和22.0%,远高于其他组。这些令人满意的抗癌效果可以归因于HTiPC纳米马达增强的内吞作用能力,从而提高了PDT活性。
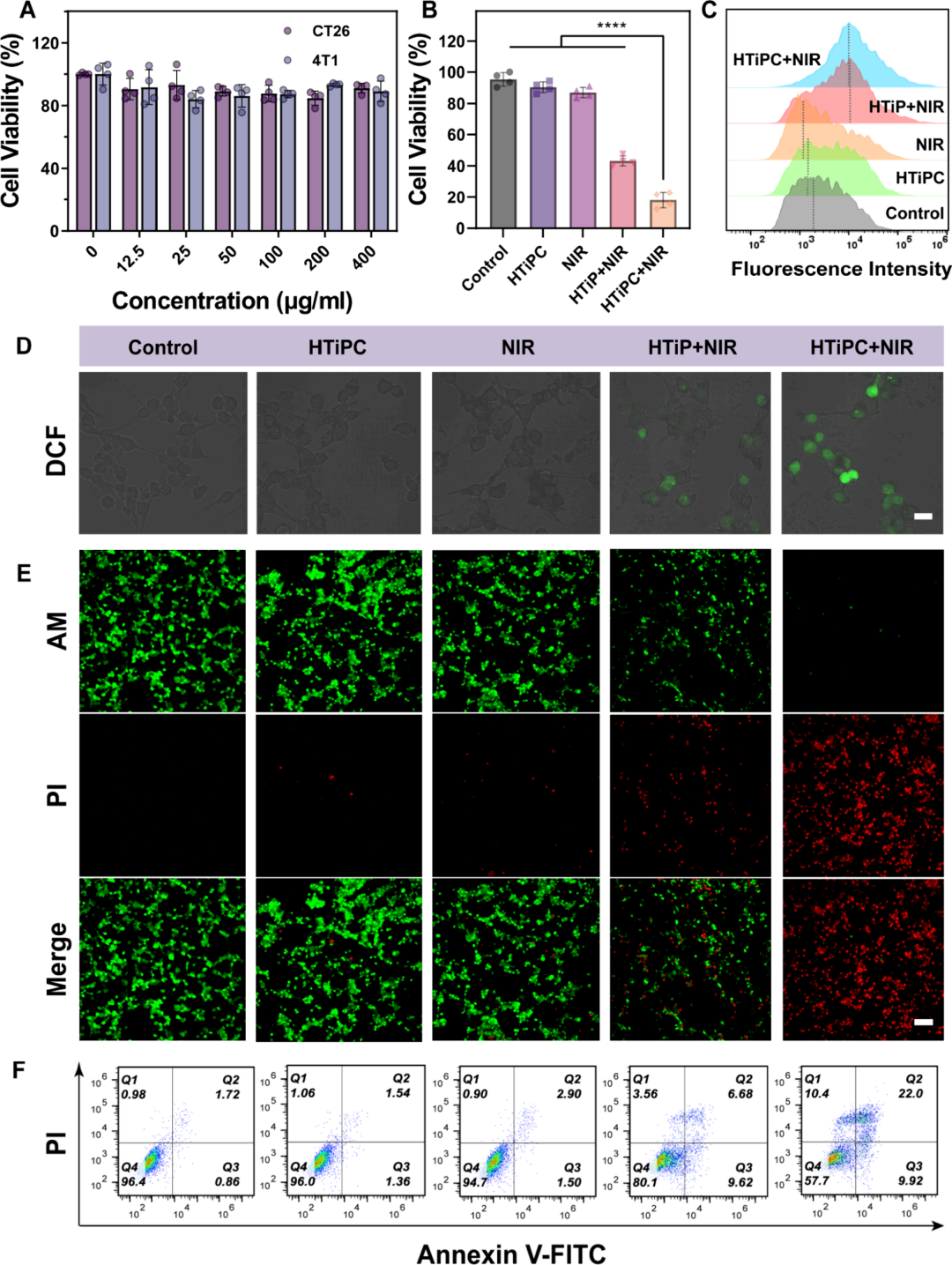
图6. Janus HTiPC纳米马达的体外抗肿瘤治疗和细胞内ROS检测
【Janus HTiPC纳米马达在CT26肿瘤携带小鼠体内的光动力治疗效果】
图7通过建立小鼠皮下肿瘤模型并进行NIR光触发的PDT治疗的示意图,观察了HTiPC纳米马达在主要器官和肿瘤中的生物分布,通过感应耦合等离子体质谱(ICP-OES)基于钛浓度的定量分析,发现纳米马达在注射后1.5小时内主要积累在肝脏和肺部,然后在所有器官中的浓度在注射后48小时逐渐下降。根据动态生物分布结果,确定NIR辐照的最佳治疗时间点约为8小时。治疗期间每2天监测一次小鼠肿瘤大小和体重变化,结果显示经过14天治疗后,接受PBS(对照组)、HTiPC纳米马达(无NIR)或单独NIR辐照的组治疗效果有限,相对肿瘤体积分别增加到12.61、10.56和10.15。相比之下,HTiPC纳米马达展现出最有效的PDT治疗效果,最终相对肿瘤体积约为0.30,对应肿瘤抑制率超过90%。此外,通过免疫组化分析,观察到HTiPC纳米马达在NIR辐照下处理的肿瘤组织中细胞核浓缩,TUNEL染色表明实验组PDT治疗的肿瘤细胞凋亡水平最高,而其他对照组观察到的损伤最小。
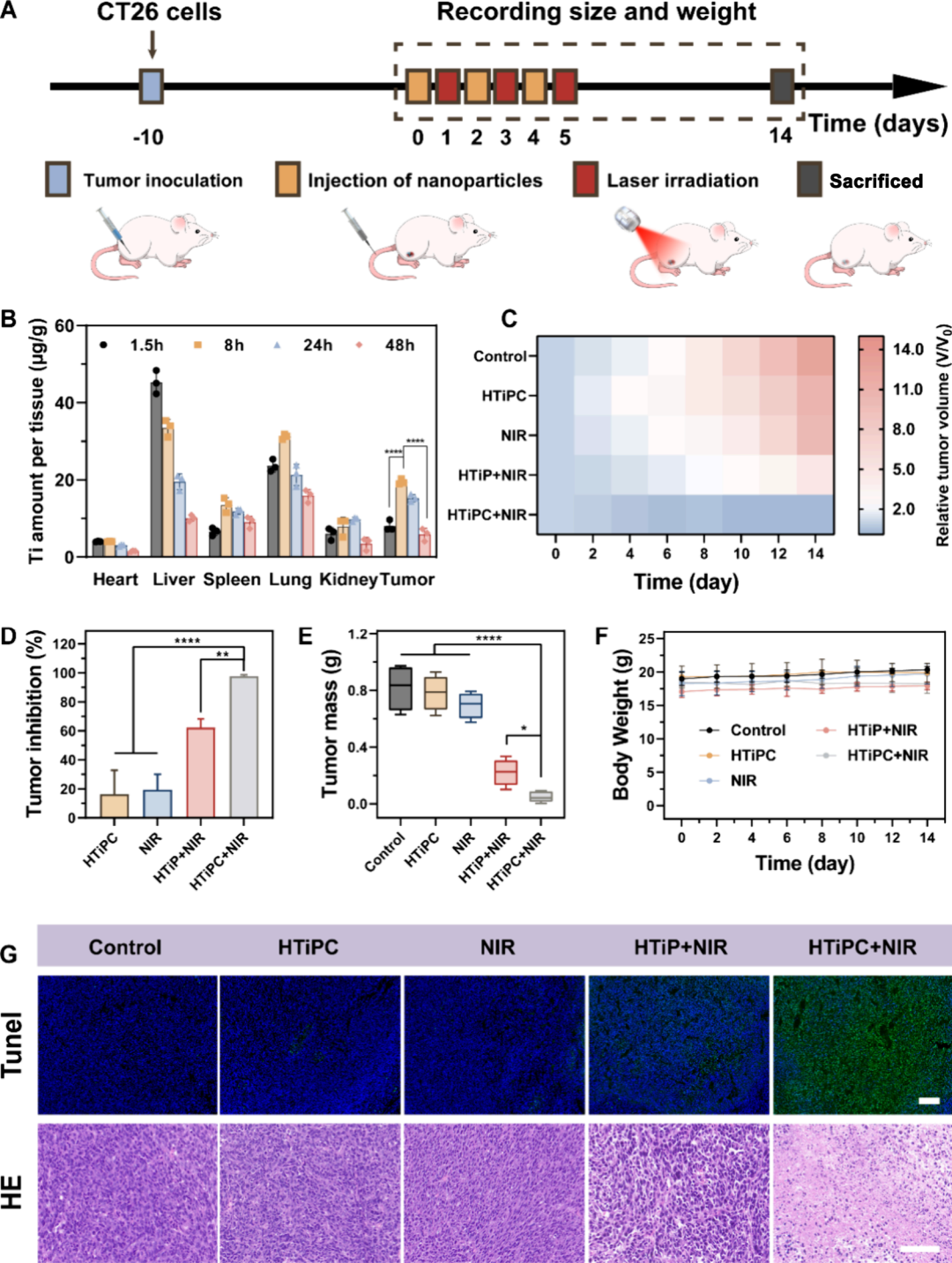
图7. Janus HTiPC纳米马达在CT26肿瘤携带小鼠体内的光动力治疗效果
【小结】
该研究开发了一种H2O2驱动的介孔Janus HTiPC纳米马达,该马达具备通过自扩散光致运动实现深层组织穿透和缓解缺氧的多功能自主导航能力,以实现近红外响应的光动力疗法。TiO2和PMO纳米复合材料的不对称几何结构可以轻松调节,得到三种类型的纳米马达HTiPC-i、ii和iii。其中,具有最大轴向不对称特性的HTiPC-ii纳米马达表现出更强的定向性和自推进力,从而在H2O2溶液中实现了最高的平均速度18.71 μm/s。HTiPC-ii纳米马达在2D细胞和3D MTSs上的强化细胞内摄取和溶酶体逃逸能力得到了系统研究的确证。体外ROS检测验证了HTiPC纳米马达通过酶反应有益地产生O2,以产生1O2。因此,HTiPC纳米马达可以通过分解实体瘤内源性H2O2,不断补充氧气,实现强化的光动力治疗效果。从体内抗肿瘤实验来看,近红外触发的HTiPC纳米马达组在肿瘤抑制方面展现了明显的优势。这项工作提供了一种合理设计和制造基于二氧化钛的介孔纳米马达,这些纳米马达能够有效地治疗深层组织中的肿瘤。
原文链接:
https://doi.org/10.1021/acsnano.4c03652


