【论著】褪黑素对脑缺血-再灌注损伤大鼠大脑皮质细胞毒性水肿的影响研究
时间:2024-05-31 16:01:12 热度:37.1℃ 作者:网络
李振
摘要:目的 探讨褪黑素对大鼠脑缺血-再灌注损伤(CIRI)后大脑皮质细胞毒性水肿的影响及其机制。 方法 将60只成年健康无特定病原体雄性Sprague Dawley大鼠完全随机分为假手术组(Sham组,12只)、CIRI组24只、褪黑素治疗组(24只)。采用改良的Zea-Longa线栓法建立大鼠CIRI模型,其中褪黑素治疗组在建模前、后30 min腹腔注射褪黑素(5 mg / kg);CIRI组在建模前、后30 min经腹腔注射等量的等渗盐水。Sham组分离右侧颈总动脉后缝合皮肤,并于假手术前、后30 min注射等量的等渗盐水。建模后2、6、12、24 h及72 h,3组大鼠(每组6只)均行活体MRI T2加权成像(T2WI)、扩散加权成像(DWI)检查,结合表观扩散系数(ADC)图,动态分析褪黑素干预后CIRI大鼠脑梗死体积百分比、脑水肿百分比及大脑皮质相对ADC(rADC)值的变化。建模后6、24 h及72 h,采用脱氧核苷酸末端转移酶介导的2′-脱氧尿苷5′-三磷酸盐介导的缺口末端标记(TUNEL)法观察褪黑素对CIRI大鼠缺血侧大脑皮质细胞凋亡的影响;免疫荧光双标法观察褪黑素干预对星形胶质细胞水通道蛋白4(AQP4)和钠-钾-氯协同转运蛋白1(NKCC1)的影响;免疫荧光染色结合蛋白质印记,探讨褪黑素对离子钙接头蛋白抗原(Iba-1)标记的小胶质细胞活化的影响。建模后24 h,苏木素-伊红(HE)染色观察褪黑素对CIRI大鼠缺血侧大脑皮质细胞形态学的影响,酶联免疫吸附测定(ELISA)方法测定褪黑素对炎性因子白细胞介素1β(IL-1β)和肿瘤坏死因子α(TNF-α)的影响。采用Pearson相关性分析结合一般线性回归分析对建模后各时点CIRI组与褪黑素治疗组大鼠缺血侧大脑皮质Iba-1 +细胞数差值与胶质纤维酸性蛋白(GFAP +)/ AQP4 +及GFAP + / NKCC1 +细胞数差值进行相关性分析。 结果 T2WI和DWI扫描结果显示,Sham组大鼠脑组织信号均匀,未见异常信号。建模后24 h,CIRI组见大范围异常信号脑损伤区,缺血侧大脑半球水肿,大脑中线向对侧移位;褪黑素治疗组脑损伤区范围较CIRI组减小,大脑中线向对侧移位减轻。建模后2、6、12、24 h及72 h,与CIRI组比较,褪黑素治疗组大鼠各时点脑梗死体积百分比、脑水肿百分比显著减少,大脑皮质rADC值显著增高(均P < 0. 05)。HE染色结果显示,Sham组大脑皮质细胞形态规则、排列整齐;建模后24 h,CIRI组缺血侧大脑皮质细胞形态不规则、排列紊乱,而褪黑素治疗组大脑皮质细胞形态较规则、排列较整齐。TUNEL 检测及免疫荧光染色结果显示,Sham 组大脑皮质见少量TUNEL +、GFAP + / AQP4 +和GFAP + / NKCC1 +、Iba-1 +细胞表达,小胶质细胞胞体大小适中,呈高度分枝状;建模后24 h,CIRI组缺血侧大脑皮质TUNEL +、GFAP + / AQP4 +、GFAP + / NKCC1 +、Iba-1 +细胞数较Sham组增多,小胶质细胞突起消失,形态呈现阿米巴样,褪黑素治疗组缺血侧大脑皮质TUNEL +、GFAP + / AQP4 +、GFAP + / NKCC1 +、Iba-1 +细胞数较CIRI组减少,小胶质细胞胞体变小,突起较长。建模后6、24 h 及72 h,与CIRI 组比较,褪黑素治疗组大鼠各时点缺血侧大脑皮质TUNEL +、GFAP + / AQP4 +、GFAP + / NKCC1 +、Iba-1 +细胞数均显著减少(均P < 0. 05)。蛋白质印迹及ELISA方法分析结果显示,建模后24 h,褪黑素治疗组Iba-1蛋白表达、IL-1β及TNF-α水平较CIRI组显著降低(均P < 0. 01)。建模后6、24、72 h,褪黑素治疗组与CIRI 组缺血侧大脑皮质GFAP + /AQP4 +及GFAP + / NKCC1 +细胞数差值与Iba-1 +细胞数差值呈极强正相关(r 值分别为0. 937、0.963),差异均具有统计学意义(均P < 0. 01)。 结论 褪黑素可下调CIRI 大鼠缺血侧大脑皮质星形胶质细胞AQP4 及NKCC1 蛋白的表达,改善细胞毒性水肿,减轻CIRI,其机制可能与抑制小胶质细胞活化有关。
缺血性卒中严重危害中老年人生命健康。早期静脉溶栓或血管内介入取栓治疗,虽可挽救濒死的神经细胞,但常可导致脑缺血-再灌注损伤(cerebral ischemia-reperfusion injury,CIRI)。脑水肿是CIRI后重要的病理改变之一,早期脑水肿类型为细胞毒性水肿,早于血-脑屏障发生破坏之前,是后期血管源性水肿的驱动力,因此,对于细胞毒性水肿阶段的关注及干预对改善患者预后具有重要意义。
扩散加权成像(DWI)-MRI 的定量参数表观扩散系数(apparent diffusion coefficient, ADC)值可反映细胞毒性水肿引起的水分子扩散限制程度,细胞内水积聚会导致细胞毒性水肿区ADC 值降低,因而,DWI-MRI 对于急性期脑水肿具有较高的敏感性。星形胶质细胞肿胀是CIRI 早期细胞毒性脑水肿状态最重要的组成部分。由于星形胶质细胞是哺乳动物大脑中最丰富的细胞类型,并且,其细胞质膜上存在大量涉及水通量的水通道蛋白4(aquaporin 4,AQP4)及钠-钾-氯协同转运蛋白1(Na + -K + -2Cl - -cotransporter 1,NKCC1)等通道和载体蛋白,CIRI 早期细胞外水进入细胞内,引发细胞肿胀,进一步可使细胞膜破裂,导致细胞裂解和死亡,因此,星形胶质细胞水肿是细胞毒性水肿的重要原因和标志。
小胶质细胞是中枢神经系统的常驻巨噬细胞,在维持神经稳态及功能方面扮演着重要角色。小胶质细胞在CIRI早期即可被激活,其持续活化会引发炎症级联反应,加重神经损伤。及早干预小胶质细胞活化,可能有助于减轻CIRI。褪黑素具有抑制炎性反应、减轻细胞凋亡和改善脑水肿等生物学功效,在脑缺血性疾病治疗中的作用及机制具有极高的研究前景。本课题组前期研究结果显示,褪黑素可抑制炎性因子的释放,减轻神经损伤,但褪黑素能否通过调控小胶质细胞活化以改善细胞毒性水肿,目前尚不清楚。因此,本研究采用MRI活体成像结合组织学方法,动态监测褪黑素对CIRI大鼠大脑皮质细胞形态学、细胞凋亡及膜通透性相关蛋白AQP4、NKCC1 表达的影响,并分析小胶质细胞活化的变化,以探讨其可能的机制,为褪黑素在脑损伤疾病的临床应用提供科学的理论依据。
1 材料与方法
1. 1 主要试剂及仪器
褪黑素、4′,-二脒基-2苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)荧光封片剂(Sigma,美国);苏木素-伊红(HE)染色试剂盒、二辛可宁酸蛋白浓度测定试剂盒(北京索莱宝科技有限公司,中国);脱氧核苷酸末端转移酶介导的2′-脱氧尿苷5′-三磷酸盐介导的缺口末端标记(terminal deoxynucleotidyl transferase-mediated 2′-deoxyuridine 5′-triphosphate Nick-end labeling, TUNEL)染色试剂盒(武汉博士德生物工程有限公司,中国);白细胞介素1β(IL-1β)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒、肿瘤坏死因子α(TNF-α)ELISA试剂盒(北京博奥森生物技术有限公司,中国);鼠抗胶质纤维酸性蛋白(glial fibrous acidic protein,GFAP)一抗(Cell Signaling Technology,美国);鼠抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3 -phosphate dehydrogenase,GAPDH)一抗、兔抗AQP4一抗、兔抗NKCC1一抗(Proteintech,中国);兔抗离子钙接头蛋白抗原(Ionized calcium binding adapter molecule 1,Iba-1)一抗(Wako,日本);Alexa Fluor 594 标记的山羊抗大鼠荧光二抗、Alexa Fluor 488 标记的山羊抗兔荧光二抗(北京中杉金桥生物有限公司,中国)。
7. 0 T高场强小动物磁共振成像仪(Bruker,德国);正置光学显微镜(Olympus,日本);正置荧光显微镜(ZEISS,德国);石蜡包埋机(Leica,德国);石蜡切片机(Thermo,美国);酶标仪(上海科华实验系统有限公司,中国);高性能成像系统(Protein Simple,美国)。
1. 2 大鼠CIRI模型建立及分组
健康无特定病原体成年雄性Sprague Dawley大鼠,体质量240 ~ 270 g,购自济南朋悦实验动物繁育有限公司,许可证号为SCXK(鲁)20190003,合格证号: 370726210101035736。本实验方案已通过潍坊医学院实验动物伦理委员会审批(伦理号:2020SDL052)。实验大鼠按照随机数字表法分为:假手术组(Sham组,12 只)、CIRI 组(24 只)、褪黑素治疗组(Mel组,24只);其中CIRI组及Mel组根据建模后时间,分为6、24 h及72 h 3个亚组。光照/黑暗交替12 h环境下喂养大鼠7 d后,采用改良Zea-Longa线栓法制备大鼠CIRI 模型:10 g / L 戊巴比妥钠(50 mg / kg)腹腔麻醉大鼠,仰卧位固定,于颈部正中切开皮肤,暴露并分离右侧颈总动脉、颈外动脉和颈内动脉,结扎颈外动脉,于颈总动脉插入顶端直径为(0. 34 ± 0. 02)mm 的线栓,线栓头部进入颈内动脉,距离颈总动脉分叉处约18. 0 mm 处有阻塞感时停止进线,结扎颈总动脉,缺血2 h 后拔出线栓。Mel组在建模前、后30 min 经腹腔注射褪黑素(5 mg / kg),CIRI组在建模前、后30 min经腹腔注射等量的等渗盐水。Sham组分离右侧颈总动脉后缝合皮肤,并于假手术前、后30 min经腹腔注射等量的等渗盐水。
建模后2 h,依据Longa评分法评估建模后大鼠行为学:0分,无神经功能受损表现,即正常;1分,悬吊大鼠尾部,左前肢不能充分伸展;2 分,无法直行并向左侧倾斜,转大圈;3分,行走时向左侧倾倒,转小圈;4分,无法行走和意识障碍。选择评分为1 ~3 分者,纳入为研究对象。本研究共计使用大鼠69 只,其中建模失败及实验中途死亡大鼠9 只,按步骤重新随机选取大鼠补入,直至每亚组完成扫描并取材的大鼠数量达到实验设计只数,最终60只大鼠纳入实验。18只(每组6只)大鼠于建模后2 、6、12、24 h 及72 h 进行T2 加权成像(T2 weighted imaging,T2 WI)及DWI活体动态扫描,扫描完成时留取组织学标本,其中建模失败及扫描中途死亡4 只,纳入最终实验18 只;其余大鼠于建模后2 h(判断建模是否成功)及取材时间点(确定ADC 值降低区域)进行MRI扫描,其中建模失败及中途死亡5 只,纳入最终实验42 只。各组织学实验纳入大鼠只数见表1。
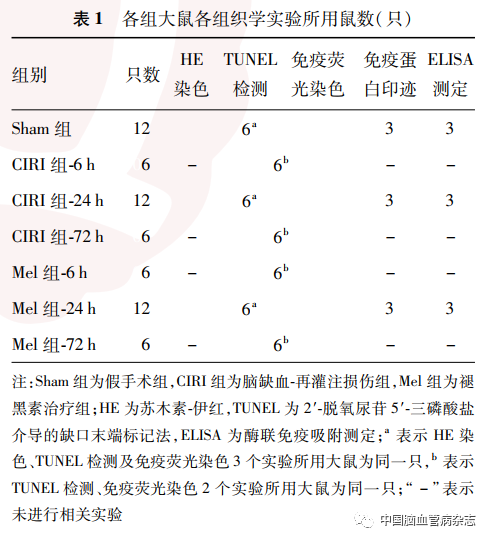
1. 3 MRI图像采集及分析
1. 3. 1 T2WI扫描及脑梗死、脑水肿百分比分析:3 组各6只大鼠异氟烷吸入麻醉(诱导浓度4%,持续浓度1. 5%),俯卧位固定于线圈中,呼吸心电监护仪进行生命体征监测。建模后2、6、12、24 h及72 h,行T2WI-MRI扫描,扫描层厚:0. 5 mm;层间距:0 mm,回波时间:34 ms,重复时间:3 000 ms;矩阵:160 × 150。将获得的DICOM格式图像在Image J 1. 6. 0软件中进行处理,勾勒高信号脑梗死区和总脑面积。根据以下公式计算:梗死体积百分比=梗死体积/总脑体积×100% =(A1 + A2 + A3 +…An)t /(A总1 + A总2 + A总3 +…A总n)t × 100%,其中A代表梗死面积,A总代表每个截面的总脑面积,t代表截面厚度。使用ImageJ 1. 6. 0分别测量并计算两侧大脑半球的体积,通过半球体积的差异量化脑水肿的情况。使用以下公式计算:脑水肿百分比= 100 ×[1 -(V1 / V2)],其中V1和V2分别代表对侧和同侧脑半球的体积。
1. 3. 2 DWI扫描及相对ADC(relative ADC,rADC)值分析:建模后2、6、12、24 h及72 h,行DWI-MRI扫描,DWI扫描层厚:0. 8 mm;层间距:0. 2 mm;回波时间:22 ms;重复时间:3 000 ms;矩阵:128 × 128;b值为0、1 000 s / mm2。使用小动物MRI工作站图像后处理软件进行图像处理,生成ADC图。选择侧脑室最大层面,于缺血侧大脑皮质异常信号区及对侧镜像区分别选择3 个面积为2 mm2 的感兴趣区,测量感兴趣区的ADC值,计算各组大鼠动态时间点大脑皮质的rADC 值,即病变部位与对侧镜像区ADC值的比值,并求其平均值。
1. 4 HE染色
MRI扫描后,各组大鼠心脏灌注,断头取脑,梯度乙醇脱水,石蜡包埋,制成厚度4 μm的脑组织石蜡切片。将切片置于65 ℃恒温烘箱中烤片1 h,经二甲苯脱蜡、梯度乙醇水化,依次行苏木素染核,伊红染浆,无水乙醇脱水,二甲苯透明,中性树胶封片并晾干。于正置光学显微镜下观察缺血侧大脑皮质细胞形态改变。
1. 5 TUNEL检测
常规脱蜡、水化石蜡切片,过氧化氢封闭15 min,磷酸盐缓冲液冲洗,按照TUNEL试剂盒说明完成操作。于正置光学显微镜下观察并拍照,计数缺血侧大脑皮质TUNEL阳性(TUNEL +)细胞数(个/ mm2)。
1. 6 GFAP/ AQP4、GFAP/ NKCC1、Iba-1免疫荧光染色
脱蜡、水化石蜡切片,水浴热修复法修复抗原,山羊血清37 ℃封闭30 min,按需加入兔抗AQP4(1∶1 000)和鼠抗GFAP(1∶300)一抗混合液,或兔抗NKCC1(1∶80)和鼠抗GFAP(1∶300)一抗混合液,或兔抗Iba-1(1 ∶300)一抗稀释液,4 ℃冰箱过夜。次日,分别滴加山羊抗兔IgG和山羊抗鼠IgG(1∶200)荧光二抗混合液,或山羊抗兔IgG(1∶200)荧光二抗,室温避光孵育1 h,用含DAPI 的荧光封片剂封片。于正置荧光显微镜下观察并拍照,计数缺血侧大脑皮质GFAP+/ AQP4 +、GFAP+/ NKCC1+和Iba-1+细胞数(个/ mm2),并观察Iba-1+细胞的形态学变化。
1. 7 蛋白质印迹法(Western Blot,WB)
建模后24 h处死各组大鼠,分离缺血侧大脑皮质,采用二辛可宁酸法测定Iba-1 蛋白浓度。经电泳、转膜、封闭后,将条带分别孵育至兔抗Iba-1(1∶500)一抗、鼠抗GAPDH(1∶ 10 000)一抗中,4 ℃孵育过夜。次日,分别加入山羊抗兔二抗或山羊抗鼠二抗(1∶1 000),室温孵育2 h。采用高性能成像系统曝光并拍照,使用ImageJ1.6.0软件分析Iba-1蛋白相对表达量。
1. 8 ELISA检测
建模后24 h,分离各组大鼠缺血侧大脑皮质0. 5 g,研磨破碎,4 ℃下以3 000 r / min 离心15 min(离心半径为8. 5 cm),取上清液。按照ELISA试剂盒说明书操作,使用酶标仪测定450 nm波长下的吸光度,检测各组大鼠缺血侧大脑皮质组织IL-1β 和TNF-α水平,并根据标准曲线进行统计学分析。总体实验流程图见图1。
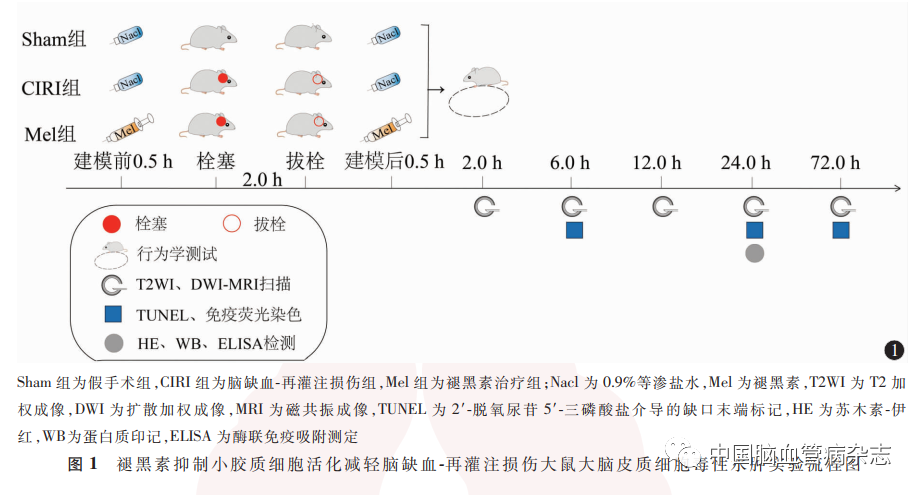
1. 9 统计学分析
应用SPSS 22. 0 软件进行统计学分析。使用Shapiro-Wilk分析对计量资料进行正态性检验,符合正态分布的计量资料以x- ± s表示,3 组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验;两组间不同时间点各指标的比较采用重复测量方差分析。相关性分析采用Pearson相关性分析结合一般线性回归分析。相关系数(r)为正数表示正相关,负数表示负相关,其中| r | = 0. 00 ~ 0. 10 可忽略相关性,0. 10 ~ 0. 39为弱相关性,0. 40 ~ 0. 69 为中等相关性,0. 70 ~ 0. 89为强相关性,0. 90 ~ 1. 00为极强相关性。以P <0. 05为差异具有统计学意义。
2 结果
2. 1 褪黑素减轻CIRI大鼠脑损伤
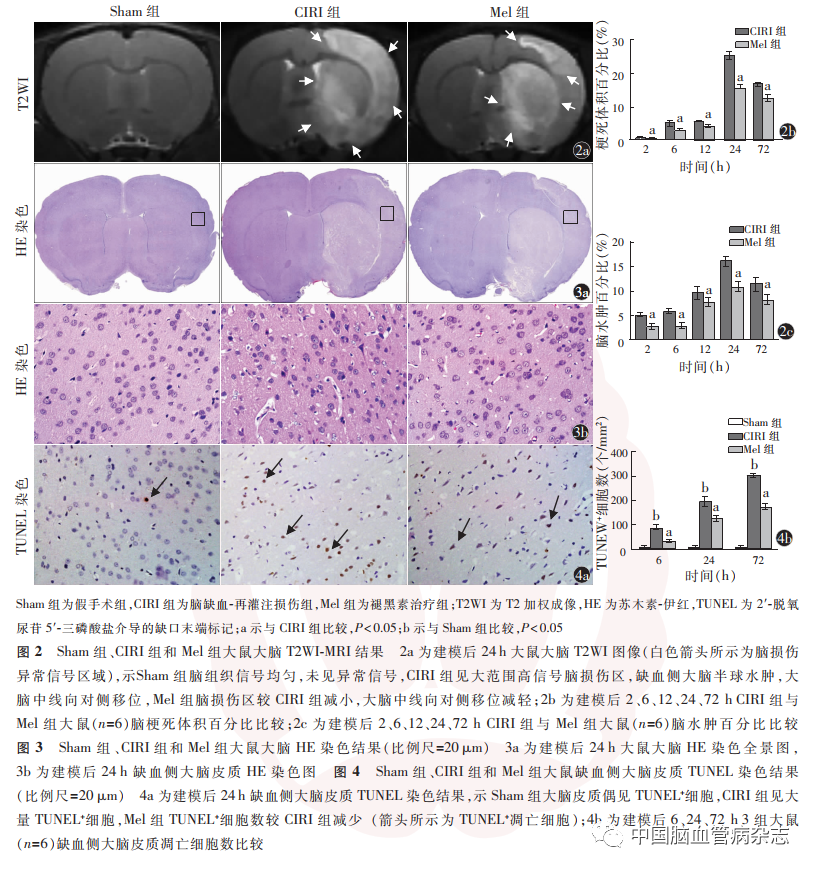
2. 1. 1 T2WI-MRI 扫描结果:T2WI-MRI 扫描结果显示,Sham组大鼠脑组织信号均匀,未见异常信号。建模后2 h,CIRI组大鼠缺血侧大脑半球出现脑梗死异常高信号区;建模后24 h,CIRI组见大范围高信号脑损伤区,缺血侧大脑半球水肿,大脑中线向对侧移位,Mel组脑损伤区较CIRI组减小,大脑中线向对侧移位减轻(图2a)。
脑梗死体积百分比比较结果显示,CIRI组建模后2、6、12、24 h,脑梗死体积百分比呈逐渐上升趋势,于建模后24 h 达较高值,建模后72 h,脑梗死体积百分比较建模后24 h 明显减少(F = 74 662. 819,P < 0. 01);CIRI 组与Mel 组大鼠建模后各时点脑梗死体积百分比差异有统计学意义(时间效应F = 6308. 900,P < 0. 01;组别效应F = 305. 987,P <0. 01;交互效应F = 263. 800,P < 0.01),Mel 组较CIRI组均明显降低(均P < 0. 05)。见图2b。
CIRI组建模后2、6、12、24 h,脑水肿百分比呈增加趋势,于建模后24 h 达较高水平,而建模后72 h,脑水肿百分比较建模后24 h显著降低(F = 238. 745,P < 0. 01)。CIRI 组与Mel 组大鼠建模后各时点脑水肿百分比差异有统计学意义(时间效应F =569. 689,P < 0. 01;组别效应F = 97. 467,P < 0. 01;交互效应F = 6. 261,P = 0. 018),Mel组大鼠脑水肿百分比较CIRI组均明显降低,差异均具有统计学意义(均P <0. 05)。见图2c。
2. 1. 2 HE染色结果:HE染色结果显示,Sham组大脑皮质细胞形态规则、排列整齐。建模后24 h,CIRI组缺血侧大脑皮质细胞形态不规则、排列紊乱、结构疏松,部分胞核深染;Mel组缺血侧大脑皮质细胞形态较规则、排列较整齐,偶见胞核深染。见图3a,3b。
2. 1. 3 TUNEL 检测结果:TUNEL 检测结果显示,Sham组大脑皮质偶见TUNEL +细胞;建模后24 h,CIRI组大鼠缺血侧大脑皮质见大量TUNEL +细胞,Mel组TUNEL +细胞数较CIRI组少(图4a)。
TUNEL +细胞计数比较结果显示,建模后6 h,CIRI大鼠缺血侧大脑皮质可见TUNEL +细胞,建模后24 h,TUNEL + 细胞进一步增多,建模后72 h,TUNEL +细胞达较高水平(F = 339. 058,P < 0. 01)。建模后6、24、72 h,各组大鼠缺血侧大脑皮质细胞凋亡数差异均具有统计学意义(F 值分别为137. 647、275. 810、1 665. 603,均P < 0. 05);与Sham组比较,各时点CIRI 组大鼠缺血侧大脑皮质TUNEL +细胞数均显著增多(均P < 0. 05);与CIRI 组比较,各时点Mel 组 TUNEL + 细胞数均显著减少(均P <0.05)。见图4b。
2. 2 褪黑素对CIRI大鼠细胞毒性水肿的影响
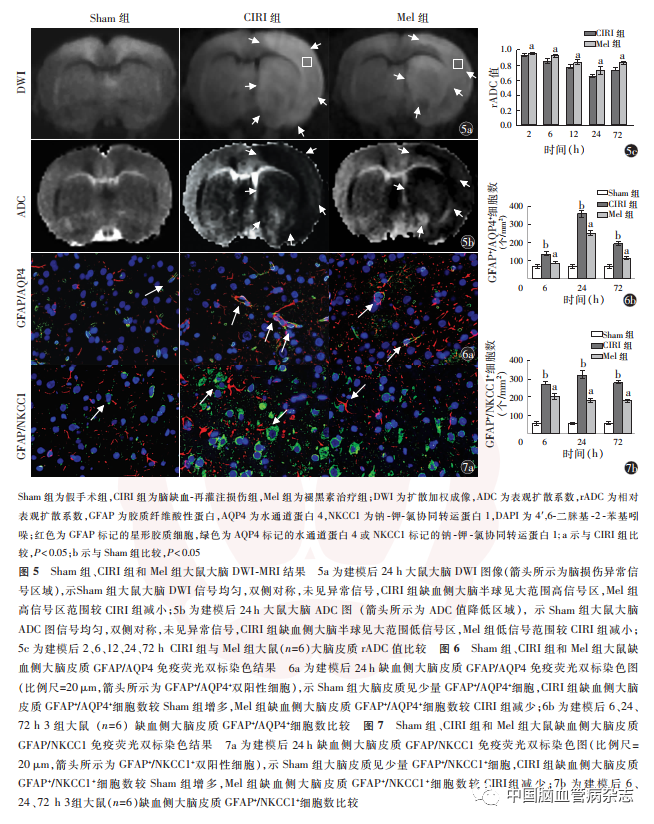
2. 2. 1 DWI-MRI和ADC 扫描结果:DWI-MRI结合ADC图显示,Sham组大鼠大脑DWI和ADC 图均信号均匀,双侧对称,未见异常信号;建模后2 h,CIRI组大鼠缺血侧大脑半球体积增大,大脑皮质可见ADC值降低区;建模后24 h,DWI 显示,CIRI 组大鼠缺血侧大脑半球见大范围高信号区,Mel组高信号区范围较CIRI组减小(图5a),而ADC图显示,CIRI组缺血侧大脑半球见大范围低信号区,Mel 组低信号区范围较CIRI组减小(图5b)。
CIRI组建模后2、6、12、24 h,大脑皮质rADC 值呈下降趋势,于建模后24 h 达较低水平,而建模后72 h,大脑皮质rADC值较建模后24h增加(F =92.130,P < 0. 01)。CIRI 组与Mel 组大鼠建模后各时点大脑皮质rADC 值差异有统计学意义(时间效应F =223. 580,P < 0. 01;组别效应F = 61. 632,P < 0. 01;交互效应F = 12. 141,P = 0. 002),Mel 组大鼠大脑皮质rADC值较CIRI 组均明显升高,差异均有统计学意义(均P < 0. 05)。见图5c。
2. 2. 2 免疫荧光染色结果:免疫荧光双标染色结果显示,Sham 组大脑皮质见少量GFAP + / AQP4 + 和GFAP + / NKCC1 +双阳性细胞;建模后24 h,CIRI 组缺血侧大脑皮质GFAP + / AQP4 +、GFAP + / NKCC1 +双阳性细胞较Sham组增多,Mel 组缺血侧大脑皮质GFAP + / AQP4 +、GFAP + / NKCC1 + 双阳性细胞较CIRI组减少。见图6a,7a。
CIRI组建模后24 h,缺血侧大脑皮质GFAP + /AQP4 +和GFAP + / NKCC1 + 细胞均较建模后6 h 增加,建模后72 h较建模后24 h 均显著减少(GFAP + /AQP4 + 细胞数:F = 397. 959,P < 0. 01;GFAP + /NKCC1 +细胞数:F = 20. 369,P < 0. 01)。建模后6、24、72 h,各组大鼠缺血侧大脑皮质GFAP + / AQP4 +细胞数和GFAP + / NKCC1 +细胞数差异均具有统计学意义(GFAP + / AQP4 + 细胞数:F 值分别为86.739、589. 909 和274. 773,均P < 0. 05;GFAP + /NKCC1 +细胞数:F 值分别为504. 633、475. 572 和1 300. 930,均P < 0. 05);与Sham组比较,CIRI各组大鼠缺血侧大脑皮质GFAP + / AQP4 + 和GFAP + /NKCC1 +细胞数明显增多(均P < 0. 05);与CIRI 组比较,Mel各组大鼠缺血侧大脑皮质GFAP + / AQP4 +和GFAP + / NKCC1 +细胞数明显减少(均P < 0. 05)。见图6b,7b。
2. 3 褪黑素抑制CIRI大鼠大脑皮质小胶质细胞活化及炎性因子IL-1β、TNF-α的分泌
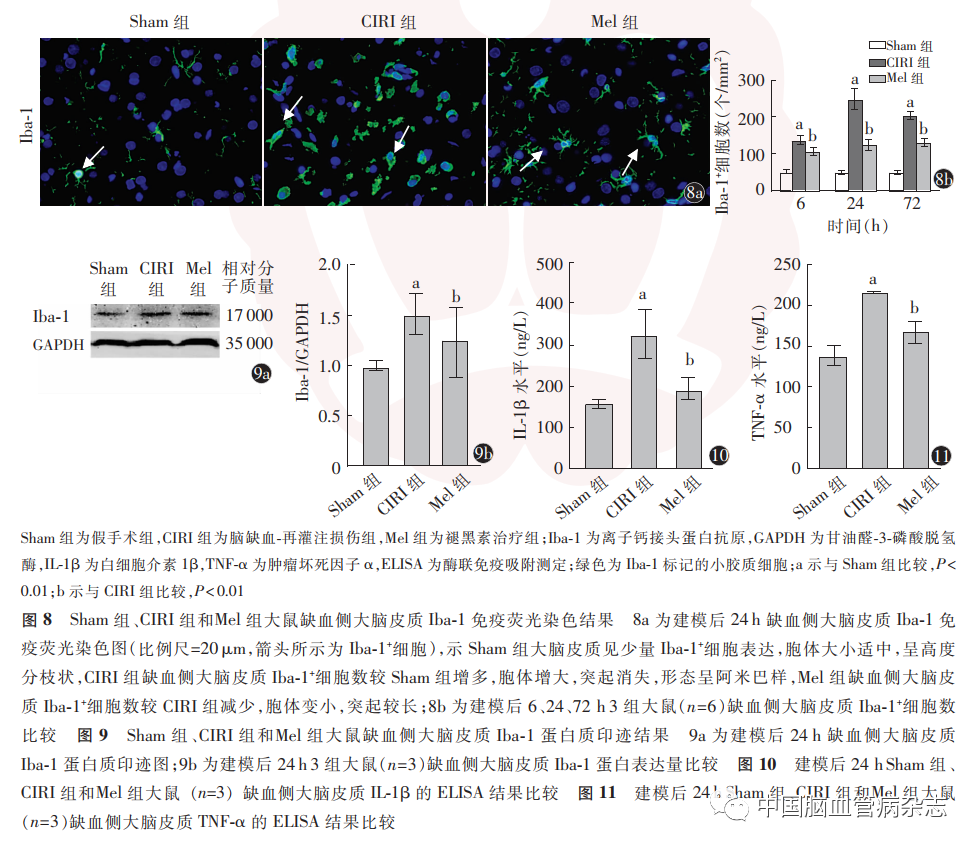
2. 3. 1 免疫荧光染色结果:免疫荧光染色结果显示,Sham组大脑皮质仅见少量Iba-1 +表达,小胶质细胞胞体大小适中,呈高度分枝状。与Sham 组比较,CIRI后各时间亚组缺血侧大脑皮质小胶质细胞形态变化明显,建模后6 h,CIRI组缺血侧大脑皮质小胶质细胞胞体增大,突起变粗变短,Iba-1 +细胞数显著增多;建模后24 h,CIRI组缺血侧大脑皮质小胶质细胞突起消失,形态呈现阿米巴样,Iba-1 +细胞数达较高水平,而Mel组缺血侧大脑皮质小胶质细胞胞体变小,突起较长,Iba-1 +细胞数较CIRI 组减少(图8a);建模后72 h,CIRI组Iba-1 +细胞数显著少于建模后24 h(CIRI组建模后6、24、72 h Iba-1 +细胞数比较:F = 54. 326,P < 0. 01)。建模后各时间点,各组大鼠缺血侧大脑皮质Iba-1 +细胞数差异均有统计学意义(F 值分别为114. 797、172. 725 和357. 635,均P < 0. 01);与Sham 组比较,各时点CIRI组Iba-1 +细胞数明显增多(均P < 0. 01);与CIRI组比较,各时点Mel组Iba-1 +细胞数明显减少(均P < 0. 01)。见图8b。
2. 3. 2 WB结果:WB测定结果显示,建模后24 h,3组大鼠缺血损伤侧大脑皮质Iba-1 蛋白表达量总体比较,差异有统计学意义(F = 11. 734,P < 0. 01)。与Sham组比较,CIRI组Iba-1蛋白表达量明显增加(P < 0. 01);与CIRI组比较,Mel组Iba-1 蛋白表达量明显降低(P < 0. 01),见图9a,9b。
2. 3. 3 ELISA结果:ELISA结果显示,建模后24 h,3组总体IL-1β和TNF-α比较,差异均有统计学意义(F值分别为17. 888、25. 377,均P <0. 01)。与Sham 组比较,CIRI 组大鼠缺血损伤侧大脑皮质IL-1β 和TNF-α水平显著增加(均P < 0. 01);与CIRI 组比较,Mel 组IL-1β和TNF-α表达水平均明显降低(均P <0. 01)。见图10,11。
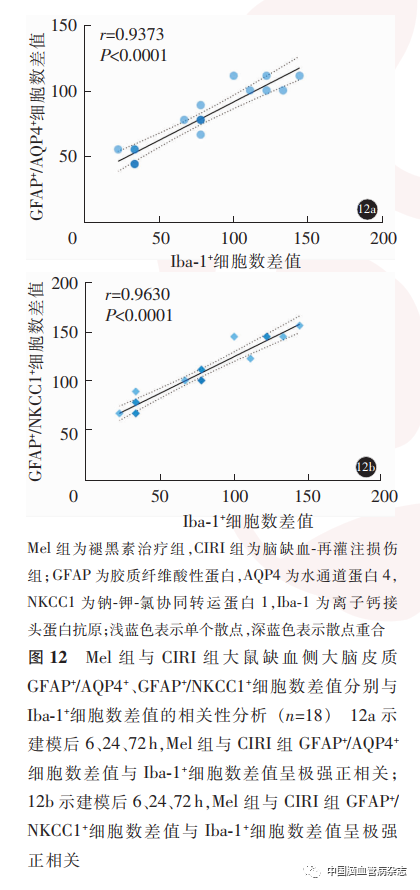
2. 4 Mel 组及CIRI 组缺血侧大脑皮质细胞毒性水肿与小胶质细胞活化相关性
Pearson 相关性分析及一般线性回归结果显示,建模后6、24、72 h,Mel 组与CIRI 组的GFAP + /AQP4 +、GFAP + / NKCC1 +细胞数差值与Iba-1 +细胞数差值(个/ mm2)均呈极强正线性相关(相关系数r 值分别为0. 937、0. 963,均P < 0. 01)。见图12。
3 讨论
缺血性卒中是国内外高发病率、高致残率及高致死率的疾病之一,溶栓或取栓的再灌注治疗已成为各国指南推荐的首选方法,但再灌注后发生脑水肿可加重神经功能损害。研究表明,尽早接受影像学检查并进行干预治疗对于缺血性卒中患者的预后具有重要意义。因此,如何早期发现CIRI细胞毒性水肿并进行神经保护治疗是目前亟待解决的科学问题。
本研究采用影像学结合组织学方法监测大鼠CIRI 的疾病进程。MRI 扫描发现,建模后2 h,CIRI大鼠缺血侧大脑半球出现脑梗死异常信号及脑水肿,大脑皮质rADC 值降低;建模后24 h,脑梗死体积百分比及脑水肿百分比达较高水平,后逐渐下降,而rADC 值达较低值,后逐渐上升。HE 染色结果亦显示,建模后24 h,CIRI 大鼠缺血侧大脑皮质细胞形态不规则、排列紊乱。TUNEL 检测显示,CIRI 大鼠缺血侧大脑皮质凋亡细胞数随再灌注时间的延长逐渐增多,于建模后72 h 达到较高水平,与文献报道一致。以上均表明,本研究CIRI 模型建立成功,脑缺血位置、范围及趋势具有均一性。
褪黑素是松果体分泌的一种内源性激素,可用于各种神经疾病的治疗。Sinha 等发现,褪黑素治疗可减轻CIRI 大鼠脑梗死,但缺乏远期时间点的动态观察及机制探讨。本研究于建模后动态时间点行T2WI 动态扫描发现,褪黑素治疗可降低大鼠脑梗死体积百分比及脑水肿百分比,DWI 扫描显示,褪黑素治疗后各组大鼠大脑皮质rADC 值均高于CIRI 组,提示褪黑素可减轻CIRI 大鼠细胞毒性水肿,T2WI 结合DWI-MRI 可动态监测CIRI 后细胞毒性水肿的变化,为脑缺血性疾病的诊疗提供依据。AQP4 主要表达于星形胶质细胞,是中枢神经系统最丰富的水通道蛋白,在维持大脑中的水平衡、渗透调节、能量代谢及CIRI 后细胞毒性水肿中起关键作用;NKCC1 亦为星形胶质细胞体积调节的重要转运蛋白,其激活会使细胞内渗透性溶质蓄积,共转运水分子进入细胞内,导致细胞毒性水肿。本研究采用GFAP / AQP4 及GFAP / NKCC1 免疫荧光双重染色观察褪黑素对CIRI 大鼠大脑皮质细胞毒性水肿的影响,结果显示大鼠CIRI 后缺血侧大脑皮质星形胶质细胞AQP4 及NKCC1 表达增加,24 h 达较高水平,与文献报道一致;而褪黑素可通过减少缺血侧大脑皮质星形胶质细胞AQP4 及NKCC1 表达,抑制细胞毒性水肿。同时,HE 染色结果显示,褪黑素治疗后CIRI 大鼠缺血侧大脑皮质细胞形态较规则、排列较整齐;TUNEL结果表明,褪黑素治疗可减轻CIRI大鼠缺血侧大脑皮质神经细胞凋亡。上述结果均提示,褪黑素可下调脑水肿相关蛋白AQP4 和NKCC1的表达,改善CIRI 后细胞毒性水肿,减轻CIRI大鼠神经细胞凋亡,发挥神经保护作用,但其机制尚不清楚。
小胶质细胞是中枢神经系统的第一道防线,在维持中枢神经系统稳态及脑功能方面扮演着重要角色。正常情况下,小胶质细胞呈高度分枝状,监测大脑微环境稳态;CIRI 后,小胶质细胞迅速被激活,其活化状态与脑损伤部位的严重程度密切相关。小胶质细胞的数量和形态学改变以及促炎因子的产生是其活化的重要标志,并且,研究提出,小胶质细胞和星形胶质细胞之间的串扰是触发神经炎性反应的基础,可导致继发性脑损伤。本研究结果表明,Sham组大鼠大脑皮质小胶质细胞呈分枝状的静息状态;CIRI 后,缺血侧大脑皮质小胶质细胞数量增多,胞体增生肥大,突起变粗变短,形态转变为圆形或阿米巴状,于造模后24 h达较高水平,并释放炎性因子IL-1β和TNF-α;而褪黑素治疗可显著抑制其数量增加、形态学变化及炎性因子的表达,与文献报道一致。炎性反应在CIRI后细胞毒性水肿中发挥着关键作用,且IL-1β和TNF-α等炎性因子的释放可上调AQP4 和NKCC1 的表达。但褪黑素抑制星形胶质细胞AQP4 及NKCC1表达是否与减轻小胶质细胞活化有关,目前尚不清楚。为进一步验证这一推测,我们分别对CIRI组与Mel 组大鼠缺血侧大脑皮质的GFAP+/AQP4+、GFAP+/ NKCC1+细胞数差值与Iba-1+细胞数差值进行相关性分析,结果显示,造模后各时间点,各组大鼠缺血侧大脑皮质GFAP+/AQP4+、GFAP+/ NKCC1+细胞数差值与Iba-1+细胞数差值呈极强正线性相关,提示褪黑素可能通过抑制小胶质细胞的活化,发挥神经修复和神经保护作用。
综上所述,CIRI 早期可导致细胞毒性脑水肿,且以星形胶质细胞毒性水肿为主,DWI-MRI可活体监测CIRI 大鼠早期细胞毒性水肿;褪黑素可下调CIRI 大鼠缺血侧大脑皮质星形胶质细胞AQP4、NKCC1的表达,改善细胞毒性水肿,减轻CIRI,其机制与其抑制小胶质细胞活化有关。此外,CIRI后小胶质细胞M1、M2 表型的极化变化尚有待后续更深入的研究。


