孔大陆教授组稿|王捷夫:5-FU通过细胞核内3-磷酸甘油酸脱氢酶(PHGDH)调控肿瘤细胞干性影响结直肠癌化疗耐药的机制研究
时间:2024-06-08 06:00:21 热度:37.1℃ 作者:网络
编者按:结直肠癌(colorectal cancer, CRC)是常见的恶性肿瘤,发病率居全球恶性肿瘤第三位,2020年全球估计新发CRC人数超过193万例;死亡率居第二位,估计死亡人数达93.5万例,约占全球新发癌症病例和癌症相关死亡人数的10%。
本期「专家组稿」由天津医科大学肿瘤医院孔大陆教授担任执行主编,他将与王捷夫医生在第二期内容中分享5-FU通过细胞核内3-磷酸甘油酸脱氢酶(PHGDH)调控肿瘤细胞干性影响结直肠癌化疗耐药的机制研究,为医者和患者提供更多参考。
题目:5-FU通过细胞核内3-磷酸甘油酸脱氢酶(PHGDH)调控肿瘤细胞干性影响结直肠癌化疗耐药的机制研究
◾ 王捷夫 孔大陆
5-氟尿嘧啶是结直肠癌治疗的核心药物,耐药是降低其临床效益的主要因素
全国肿瘤登记中心公布的2015年我国CRC新发病例为39万,发病率居全国恶性肿瘤第三位,2020年我国估计新发病例达55万,发病率跃居第二位。因此,除了预防和早期诊断之外,针对CRC有效治疗策略的开发也迫在眉睫。早期和局部进展期CRC的治疗以手术切除为主,晚期CRC主要采用以5-氟尿嘧啶(5-FU)为主的药物治疗,而5-FU耐药是CRC患者死亡的主要原因。因此,提高5-FU的临床效益是CRC治疗领域迫切需要解决的问题。深入了解CRC患者对5-FU耐药的分子机制,对于提高患者生存率,以及开发精准、高效的联合治疗策略具有重要意义。
肿瘤干细胞激活富集是CRC对5-FU耐药的重要原因
肿瘤干细胞是一小群不断自我更新并分化成异质细胞的肿瘤细胞,与肿瘤的耐药、复发和转移密切相关。大量研究表明,大部分的化疗药物虽然能够有效的清除分化的肿瘤细胞,但是对肿瘤干细胞作用不大,而且由肿瘤干细胞再生导致的肿瘤耐药性更强。长时间的化疗药物刺激,反而会促进肿瘤细胞增强干性,激活肿瘤干细胞增殖再生。如紫杉醇可以诱发乳腺癌干细胞的富集,导致三阴乳腺癌的耐药、复发和转移。在肺癌、卵巢癌、胰腺癌等化疗治疗中也存在相同的现象。因此,研究肿瘤干细胞的化疗耐药机制将有助于改善化疗方案并提升整体的化疗效果。
目前已经有多项靶向肿瘤干细胞药物和化疗药物联合应用的临床前和临床试验正在进行中,并取得了可观的效果。这表明,通过探究肿瘤干细胞的化疗耐药机制,并以此确定有效的靶点,开发联合治疗策略,提高化疗临床效益是可行的。临床研究显示CRC患者的肿瘤组织中肿瘤干细胞标志物的表达水平与化疗后总生存期呈负相关,表明CRC肿瘤干细胞与化疗耐药有关。
近期研究进一步证实5-FU可激活和富集CRC中的肿瘤干细胞,抑制5-FU诱导的CRC肿瘤干细胞激活和富集可有效改善5-FU的耐药。然而,5-FU通过激活和富集CRC肿瘤干细胞增强耐药的关键调控机制尚未被完全揭示。前期我们发现天然产物齐墩果酸的衍生物(CP0371)可以有效杀伤肿瘤干细胞。
为深入阐释其抗肿瘤干细胞的药理机制,我们利用小分子探针化学生物学的手段鉴定CP0371的靶点蛋白,发现CP0371共价结合3-磷酸甘油酸脱氢酶(PHGDH)蛋白的Cys281和Cys369位,抑制PHGDH的代谢酶活性,并诱导PHGDH蛋白降解,是一个新型的别构抑制剂,同时也提示PHGDH可能在肿瘤干细胞的自我更新和增殖中具有重要的调控作用,是一个潜在的抗肿瘤干细胞药物靶点。
PHGDH维持肿瘤干细胞的自我更新与增殖
PHGDH是丝氨酸生物合成途径中唯一限速酶,其主要作用是将糖酵解产生的3-磷酸甘油醛(3-PG)氧化为3-磷酸羟基丙酮酸(3-PHP)最终进入一碳循环,从而维持相应的物质稳态。同时,不同的应激条件、代谢酶的表达水平、亚细胞定位和酶活性的改变,可以使代谢酶以精准高效的方式调控细胞信号转导和基因表达等生理过程,发挥非代谢酶的生物学功能。PHGDH通过调控线粒体氧化还原稳态而维持乳腺癌干细胞干性,促进乳腺癌的肺转移。在甲状腺癌干细胞中,PHGDH能够调控肿瘤干细胞相关转录因子的表达,包括SOX2、KLF4、OCT4和NANOG。
在肝癌中,索拉菲尼通过上调PHGDH而增强肿瘤细胞的干性和耐药性,耐药的肿瘤细胞中PHGDH表达较高。最新研究也证实,在肝癌干细胞中,KIF15与PHGDH相互作用,提高PHGDH蛋白的稳定性,调控干细胞相关因子的表达。在探究PHGDH在CRC肿瘤干细胞中的生物学功能中,我们发现与普通CRC细胞相比,CRC肿瘤微球中PHGDH在转录和蛋白水平表达增加,但在流式分选的静息状态的CRC肿瘤干细胞中无显著差异,表明PHGDH可能调控CRC肿瘤干细胞的激活和增殖。在CRC细胞中敲除PHGDH可显著抑制CRC细胞肿瘤微球的形成。因此,前期报道以及我们的预实验结果提示PHGDH在肿瘤干细胞的自我更新和增殖的生物学过程中发挥重要作用,但具体的分子机制尚不清楚。
5-FU通过促进CRC肿瘤干细胞中PHGDH核转位导致耐药的机制
外源和内源丝氨酸促进CRC细胞的增殖以及5-FU的耐药,敲除丝氨酸合成途径中的PSAT1基因或除去培养环境中的丝氨酸可以抑制CRC细胞中核苷酸的合成,增加DNA损伤,增加对5-FU的敏感性。PHGDH促进CRC细胞的肝转移,肝转移患者的原发瘤中PHGDH的表达高于无转移患者,且肝转移瘤中的表达高于其原发瘤。但目前尚没有研究报道PHGDH在CRC肿瘤干细胞及CRC肿瘤干细胞对5-FU耐药中的作用。5-FU通过Wnt信号通路激活和富集CRC肿瘤干细胞,而后耐药的CRC肿瘤干细胞转移并在肝脏增殖分化,形成转移瘤。
同时研究证实,在乳腺癌干细胞中,Wnt信号通路的激活促进合成代谢相关基因的表达,PHGDH的表达显著上调。我们因此猜测5-FU可能对特定亚型的CRC细胞中的PHGDH具有调控作用,比如肿瘤干细胞。为证实这一猜想,我们用5-FU处理从HCT-116细胞中分离的肿瘤干细胞,结果显示5-FU上调了PHGDH蛋白的表达并促进其核转位。但5-FU对HCT-116和CT-26细胞中PHGDH的蛋白表达量和亚细胞定位没有显著影响。在临床病理标本中,与原发瘤相比,5-FU耐药后肝转移瘤组织中PHGDH的表达量显著增加,而且部分细胞的细胞核内PHGDH蛋白也显著增加。因此,预实验结果表明5-FU可促进CRC肿瘤干细胞中PHGDH的表达和核转位。
为了明确PHGDH代谢酶活性与细胞核内的PHGDH在CRC肿瘤干细胞中的作用,我们分别用特异性酶抑制剂NCT-503和别构抑制剂CP0371处理肿瘤干细胞。肿瘤微球实验结果显示,5-FU和NCT-503未能有效地杀死肿瘤干细胞,仅轻微抑制微球细胞的增殖,而CP0371(可诱导PHGDH蛋白降解)可有效地杀伤5-FU耐药的CRC肿瘤干细胞。敲除PHGDH基因显著抑制肿瘤微球的形成。在小鼠CRC移植瘤模型中,CP0371与5-FU的联用可以显著地抑制5-FU的耐药。因此,细胞核内PHGDH的非代谢酶功能可能在CRC肿瘤干细胞自我更新中起关键性的调控作用, 而PHGDH的代谢酶功能可能只是部分影响肿瘤干细胞的增殖。
近期研究发现葡萄糖缺失的条件会促使胰腺癌细胞中PHGDH Ser371被p38磷酸化,从而促使PHGDH核转位。而多项研究证实5-FU会激活CRC细胞中p38。我们后续拟进一步通过多种手段探究5-FU是否通过激活p38或其他蛋白激酶进而磷酸化PHGDH Ser371,促进其核转位,并发挥转录调控功能,进而调节肿瘤干细胞相关基因的表达,激活和富集CRC肿瘤干细胞,导致耐药。为此,我们分析了TCGA数据库中CRC患者组织中PHGDH和干细胞转录因子等基因表达的相关性,发现PHGDH的表达与干细胞转录因子SOX2的表达具有正相关性。
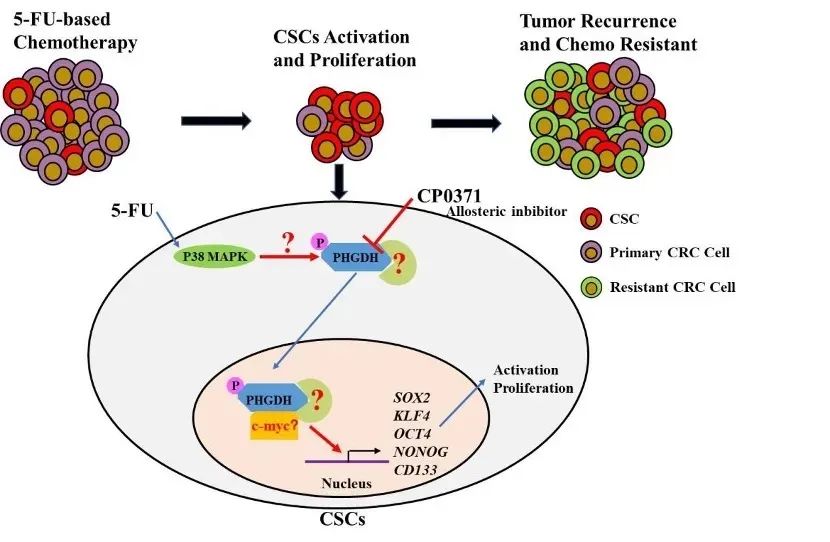
图1 研究假设模式图
综上,基于国内外研究现状以及我们前期研究结果,我们提出科学假设:5-FU改变PHGDH的亚细胞定位,促使其在细胞核内发挥非典型代谢酶生物学功能调控干细胞相关基因的表达,激活和富集肿瘤干细胞,进而导致化疗耐药现象(如图1)。本项目拟通过深入研究5-FU对CRC肿瘤干细胞中PHGDH亚细胞定位的调节机制以及通过其细胞核内生物学功能激活和富集CRC肿瘤干细胞的调节机制和信号转导通路等,并利用CRC动物模型和临床病例mini PDX等实验进一步阐明抑制PHGDH与5-FU联合治疗的临床转化意义。本项目的顺利实施,有望深入揭示5-FU对CRC肿瘤干细胞中PHGDH的调控关系,以及PHGDH非典型代谢酶生物学功能激活和富集肿瘤干细胞的机制,强调代谢酶的非酶学功能在肿瘤发生发展中的作用,并为5-FU临床联合治疗策略的开发提供新的思路,进而改善患者预后,具有重要的科学研究和临床指导意义!


