俄亥俄州立大学郑庆飞JACS:组蛋白单胺化的生物正交标记和富集,揭示其在癌细胞染色质中的积累和调控功能
时间:2024-06-11 18:00:32 热度:37.1℃ 作者:网络
组蛋白单胺基化(即血清素基化和多巴胺基化)是一种新出现的表观遗传学标记,发生在H3 N-末端尾部的第五个谷氨酰胺(Q5)残基上,在基因转录中起着重要作用。目前组蛋白单胺基化的分析主要基于位点特异性抗体和质谱法,存在着分辨率低和耗时的问题。
在本研究中,俄亥俄州立大学郑庆飞等人报道了用于生物正交标记和富集组蛋白血清素化和多巴胺化的化学探针的开发。这些探针成功应用于体外生化测定、细胞和组织样品的单胺化分析。探针对单胺化组蛋白的富集进一步证实了H3Q5单胺化和H3K4甲基化之间的串扰。最后,结合基于所开发探针的离体和体外分析,研究表明组蛋白血清素化和多巴胺化在过表达转谷氨酰胺酶2(TGM2)并调节细胞染色质三维结构的肿瘤组织中高度富集。相关工作以“Bioorthogonal Labeling and Enrichment of Histone Monoaminylation Reveal Its Accumulation and Regulatory Function in Cancer Cell Chromatin”为题发表在JACS。

【文章要点】
在作者团队之前的研究中,已经报道了一系列细胞微环境驱动的组蛋白后翻译修饰(PTM)作为新的表观遗传学标记,由肿瘤微环境(TME)中的化学反应性代谢产物诱导。这些修饰对基因转录和染色质三维结构有直接影响,包括由还原糖分子引起的非酶糖化,如甲基乙二醛(MGO)、乙二醛、核糖、和葡萄糖。肿瘤细胞中较高的糖酵解率和MGO的富集使组蛋白MGO糖基化成为癌症的标志。此外,作者也已阐明了另一种有趣的微环境驱动的组蛋白PTM的生化机制,即组蛋白H3(H3Q5)的N-末端谷氨酰胺残基上的单胺基化。这种修饰的动力学,包括其安装、移除和替换,由一种单一的酶,即谷氨酰胺转胺酶2(TGM2),通过可逆的转氨基反应进行调节。为了研究先前报道的培养细胞样品中的组蛋白单胺基化(即H3Q5血清素基化),作者用5-丙基色胺(5-PT)处理细胞,并利用Cu(i)催化的叠氮化物-炔烃环加成(CuAAC)进一步用叠氮化物-荧光团或生物素标记引入的炔烃基团。然而,5-PT的应用需要外源性喂养以与细胞中的内源性血清素竞争。此外,阻断5-羟色胺(19)的关键功能羟基可能会影响读取器蛋白与修饰的H3尾部的结合,这对于下游功能研究来说不是组蛋白血清素化的理想模拟物。由于这些局限性,作者进一步设计了能够通过生物正交反应与组蛋白的修饰残基特异性反应的化学生物学探针(图1)。
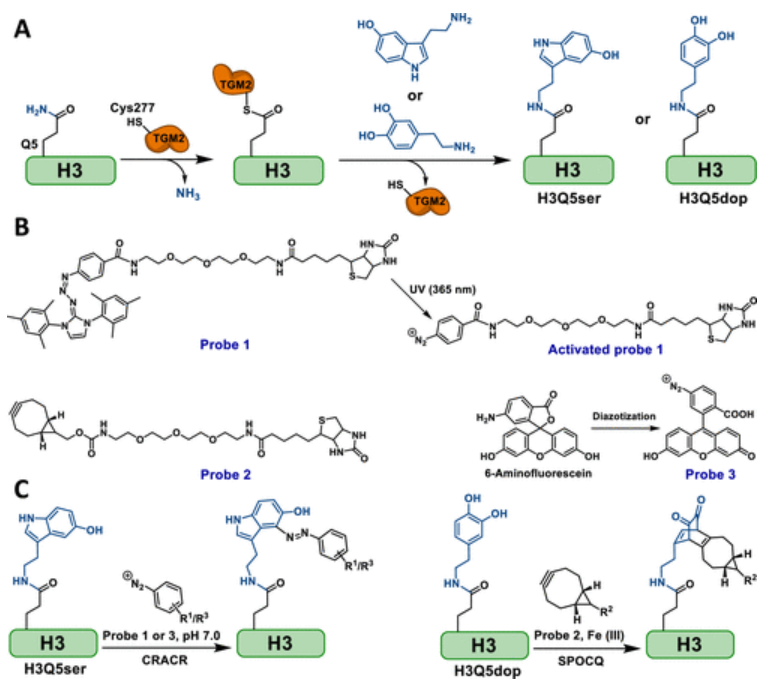
图1 组蛋白单胺化的生物正交标记和富集策略
如图2所示,作者设计并开发了重氮和双环烯(BCN)探针,通过pH控制的化学选择性快速偶氮偶联反应(CRACR)和菌株促进的氧化控制的环辛烯-1,2-醌环加成(SPOCQ),分别标记和富集组蛋白血清酮化(H3Q5ser)和多巴胺化(H3Q5dop)。利用这些强大的化学工具,作者成功地发现组蛋白H3Q5单胺基化在乳腺癌和结直肠癌癌症组织中富集,可以通过影响H3K4甲基化和染色质致密状态来发挥调节功能。
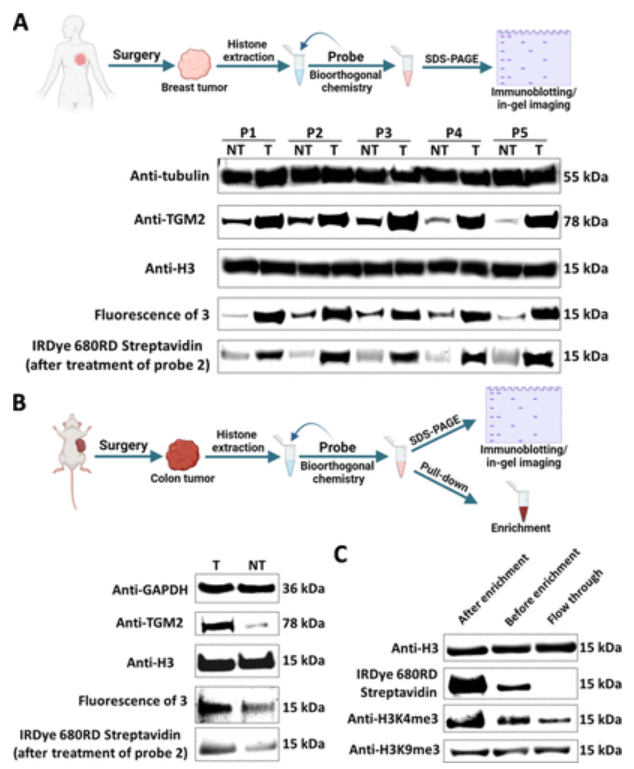
图2 对体内研究的单胺化组蛋白进行免疫印迹和凝胶内荧光成像分析
原文链接:
https://pubs.acs.org/doi/10.1021/jacs.4c04249


