【Hematol Oncol】张会来团队基于代谢通路亚型,揭示影响DLBCL结局的微环境状态
时间:2024-06-12 18:01:46 热度:37.1℃ 作者:网络
DLBCL的代谢通路
弥漫性大 B 细胞淋巴瘤 (DLBCL) 是一种生物学和临床异质性疾病,需要个性化的临床治疗。将患者分配至不同的风险类别以及细胞遗传学异常和基因突变组,已在DLBCL 的预后分层得到广泛应用。此外越来越多的证据表明,代谢过程失调也有助于 DLBCL 的发生和进展。肿瘤微环境内的代谢竞争也会影响免疫细胞代谢,但尚未确定代谢和免疫相关的风险分层。
天津市肿瘤医院张会来教授团队通过分析多个DLBCL队列的DNA数据,根据84种不同的代谢通路成功鉴定和验证DLBCL的三种代谢亚型,具有较高的预后价值,可能影响治疗决策,该研究也是首次基于代谢通路进行DLBCL分型。研究结果近日发表于《Hematological Oncology》。

研究结果
该研究纳入来自GSE10846的414例患者、来自GSE31312的489例患者、来自GSE87371的223例患者(共1126例)作为训练队列,以及天津医科大学肿瘤医院(TMUCIH)的160例患者作为验证队列。
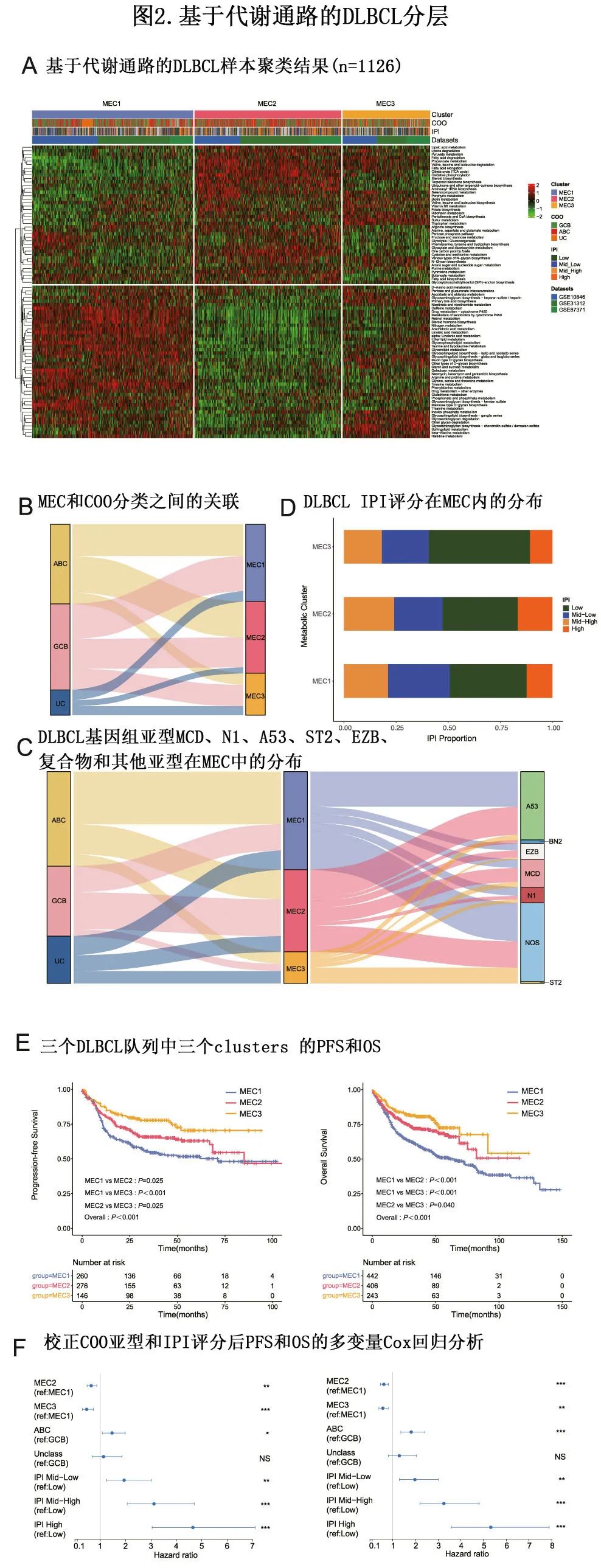
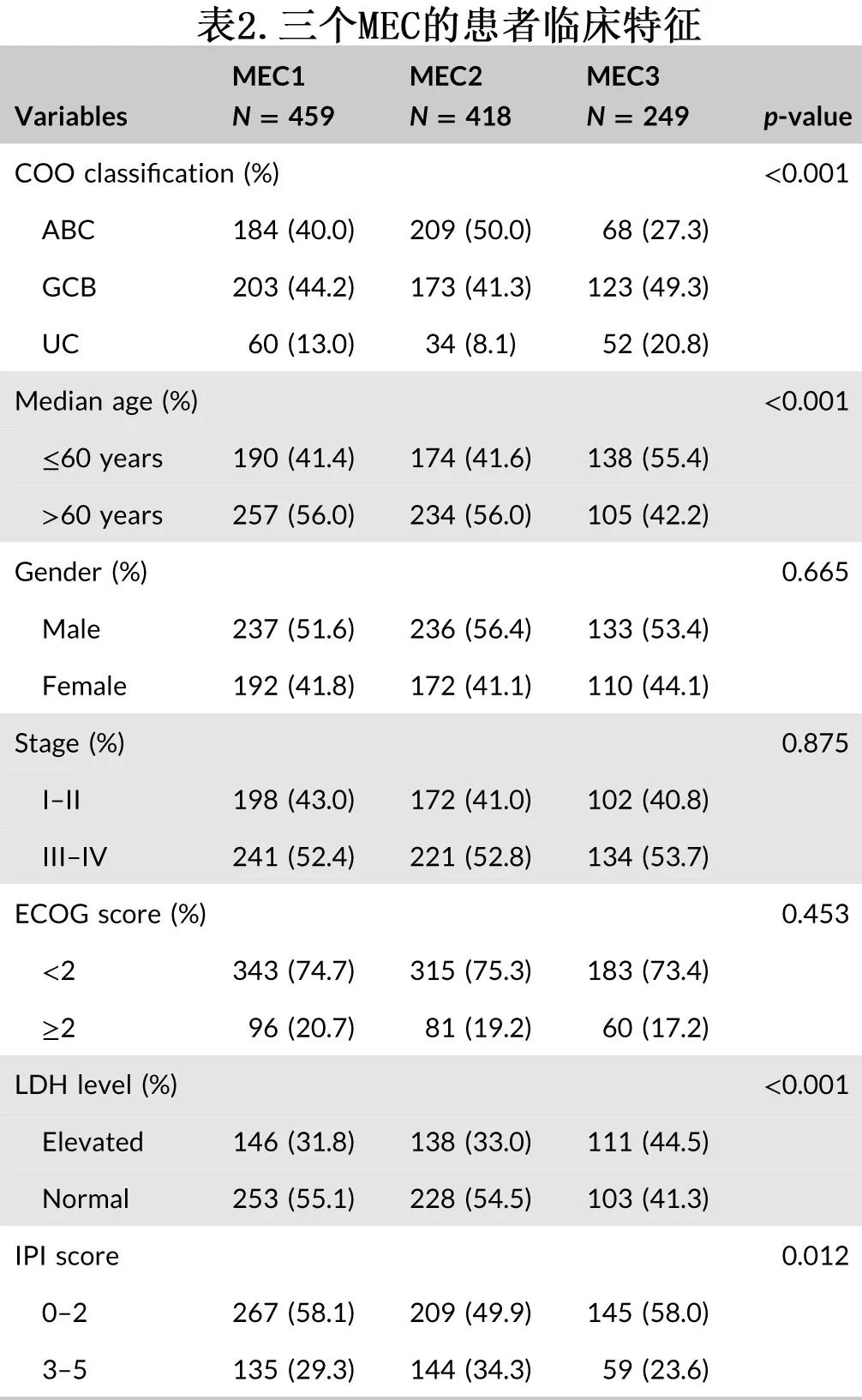
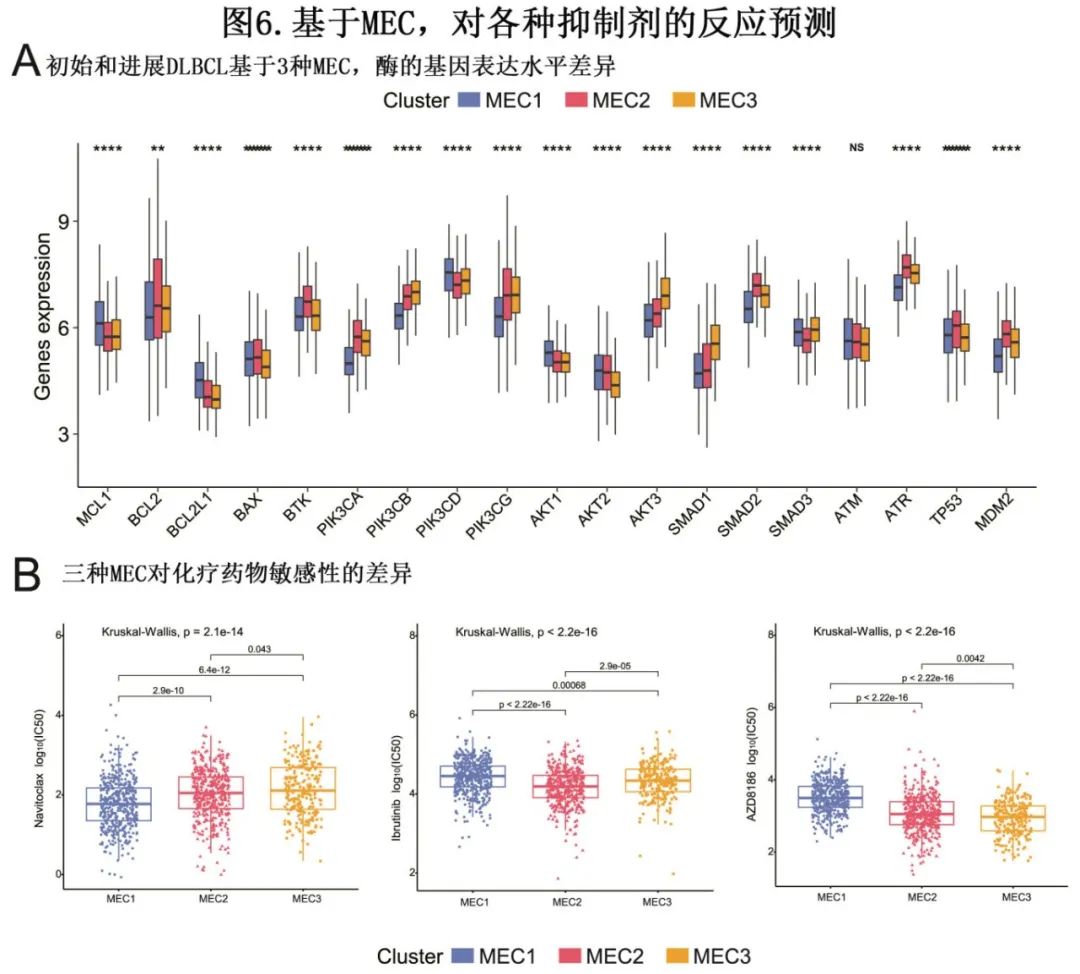
作者选择并检测了参与84条代谢通路的1660个基因,建立 DLBCL 的三个代谢clusters (MEC)。MEC1(占所有肿瘤的40.8%)的特征为部分代谢通路相对上调,包括半乳糖代谢、酪氨酸代谢和苯丙氨酸代谢。MEC2(占所有肿瘤的37.1%)以其他代谢途径相对上调为特征,包括脂肪酸降解、氧化磷酸化和氨基酰-tRNA 生物合成。MEC3(占所有肿瘤的22.1%)命名为混合亚型,以各主要类别的差异失调为特征。三个MEC具有不同的代谢基因表达特征、基因组驱动因素、生存结局和对各种抑制剂的敏感性,且MEC 可区分不同的生存结局,MEC1患者的无进展生存期(PFS) (p<0.001)和总生存期(OS) (p<0.001)显著低于其他两组患者。MEC可独立于 COO 分型和 IPI 评分而预测 DLBCL 患者的预后。此外,MEC与DLBCL分子亚型之间的关联可能揭示DLBCL代谢异质性的决定因素,并为DLBCL分类提供生物学意义。
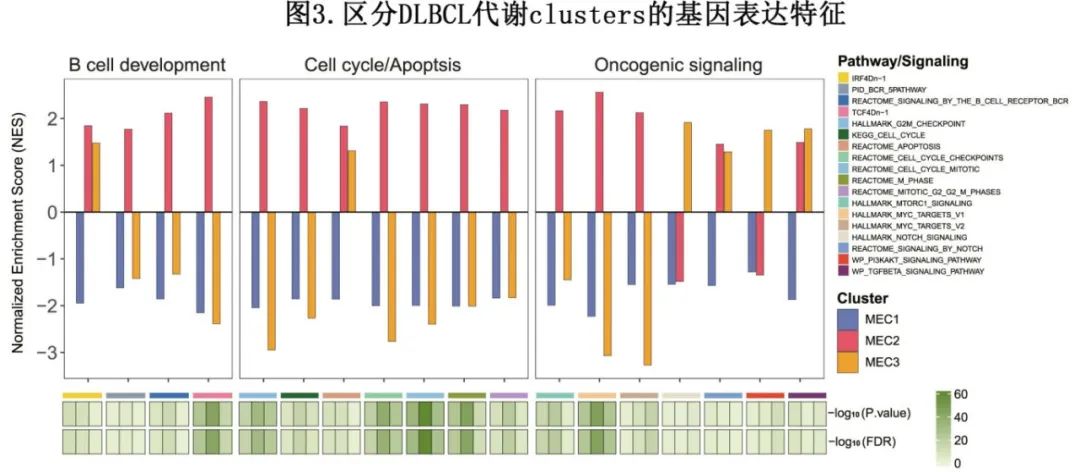
淋巴瘤和其他癌症中许多常见的致癌途径协调增殖与细胞代谢的重编程,以满足生长和细胞分裂的合成代谢需求。因此作者使用 RNA 测序数据,使用 B 细胞发育、细胞周期、细胞凋亡和致癌信号的基因表达特征探索了 DLBCL MEC 之间的表型差异。
FAT3和 HIST1H1B 突变在 MEC1 中显著富集;而PIM1、P2RY8、HLA‐B、KMT2C、FBN2和 CBLC 突变在 MEC2 中显著富集;HIST1H1B突变在 MEC3 中显著富集。但三个MEC之间的肿瘤突变负荷未观察到显著差异。

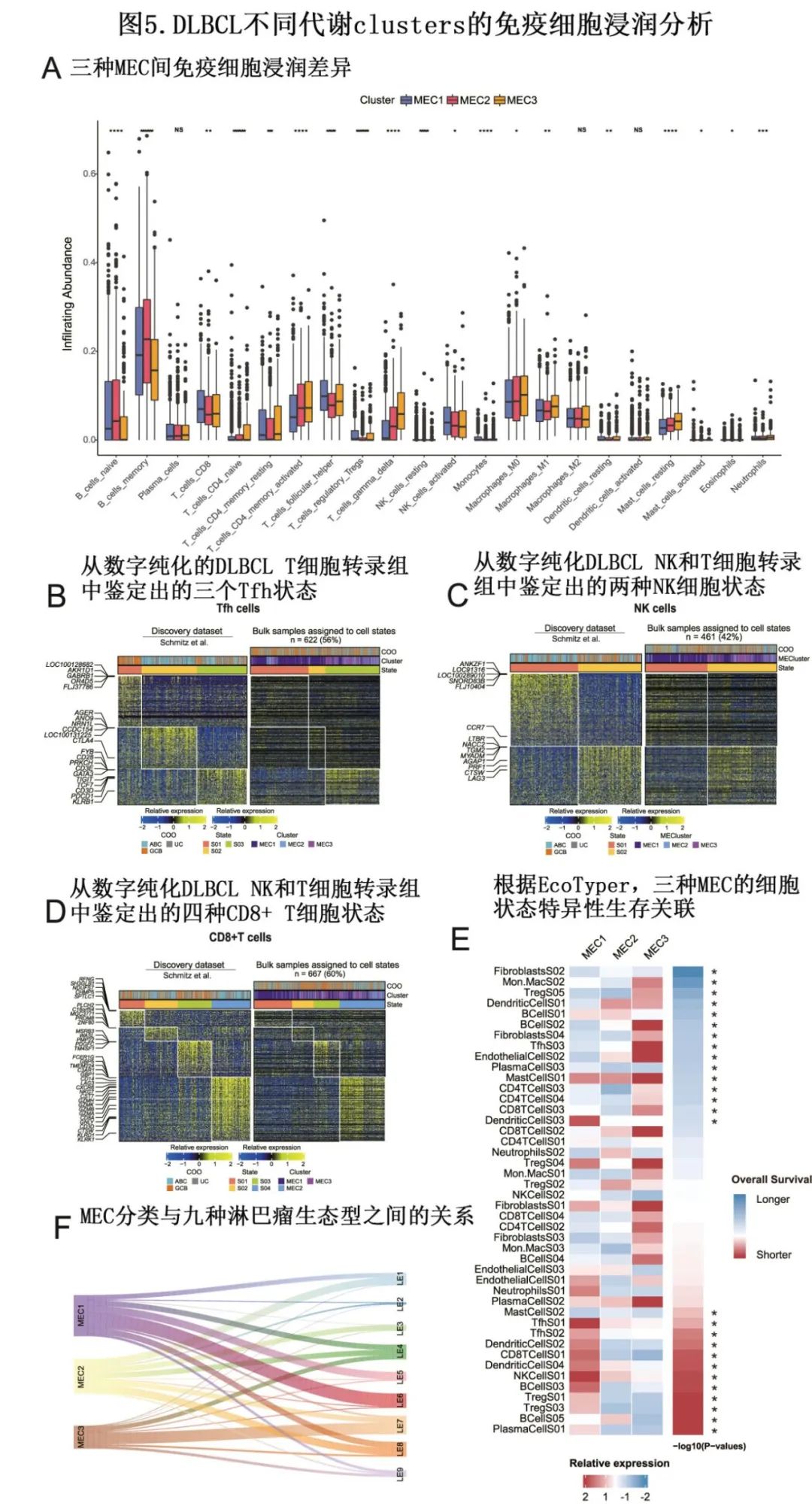
作者应用 CIBERSORT 算法和 EcoTyper,分别定量不同 MEC间组成肿瘤微环境的13个谱系的免疫细胞类型的相对丰度,鉴定细胞状态的变异。Tfh 细胞分为3种状态,预后各不相同;与Tfh‐S02状态相比,Tfh‐S01和Tfh‐S03状态预后更优。NK 或 CD8 T 细胞浸润通常与疾病预后改善相关。尽管 NK 细胞和 CD8+ T 细胞在 MEC1 中富集,但富集的细胞状态并不能改善不良预后。因此,代谢分型与免疫浸润细胞的相互作用影响 DLBCL 患者的预后。
差异基因表达分析结果发现,多个基因在 DLBCL 中有明显作用:MEC1中MCL1、BCL2L1、PIK3CD和 AKT1 的表达水平显著增高,MEC2表现出较高的 BTK、PIK3CA、SMAD2、ATR、TP53和 MDM2 表达水平,MEC3显示PIK3CB、AKT3和 SMAD1 表达富集。因此,对于MEC1患者,BCL‐2抑制剂可能是除了R‐CHOP之外的有益治疗,而MEC2患者的建议替代治疗为BTK抑制剂,此外PI3K抑制剂更适用于MEC3患者。
总结
该研究揭示了 DLBCL 的代谢异质性,并确定了三种具有不同代谢特征的MEC亚型,有助于预测预后和选择基于 R-CHOP 的 DLBCL 患者治疗策略。新型免疫相关MEC对DLBCL具有良好的临床预后价值。
参考文献
Wang X, Liu H, Fei Y, et al. Metabolic pathway‐based subtyping reveals distinct microenvironmental states associated with diffuse large B‐cell lymphoma outcomes. Hematol Oncol. 2024;e3279. https://doi.org/10.1002/hon.3279


