从系统免疫全局来看待癌症
时间:2024-06-13 22:00:35 热度:37.1℃ 作者:网络
前言
癌症是一种系统性疾病,长期炎症是癌症的主要标志之一。这种炎症是引发肿瘤发生还是支持肿瘤生长取决于环境,但最终在肿瘤进展过程中,肿瘤以外的全身免疫景观会发生显著改变。
肿瘤免疫学领域主要关注肿瘤微环境(TME)中的局部免疫反应,然而免疫是跨组织协调的。如果不与外周持续沟通,局部抗肿瘤免疫反应就无法存在。此外,几乎每一个免疫细胞亚群都与癌症生物学有关。因此,对癌症免疫反应的透彻理解必须包括整个外周免疫系统以及TME内的所有免疫细胞谱系。
肿瘤负荷引起的扰动
许多人类癌症和小鼠癌症模型会导致造血功能的广泛破坏。这种破坏最显著地表现为肿瘤宿主外周未成熟的中性粒细胞和单核细胞的扩增,然后这些细胞进入TME并导致局部免疫抑制。
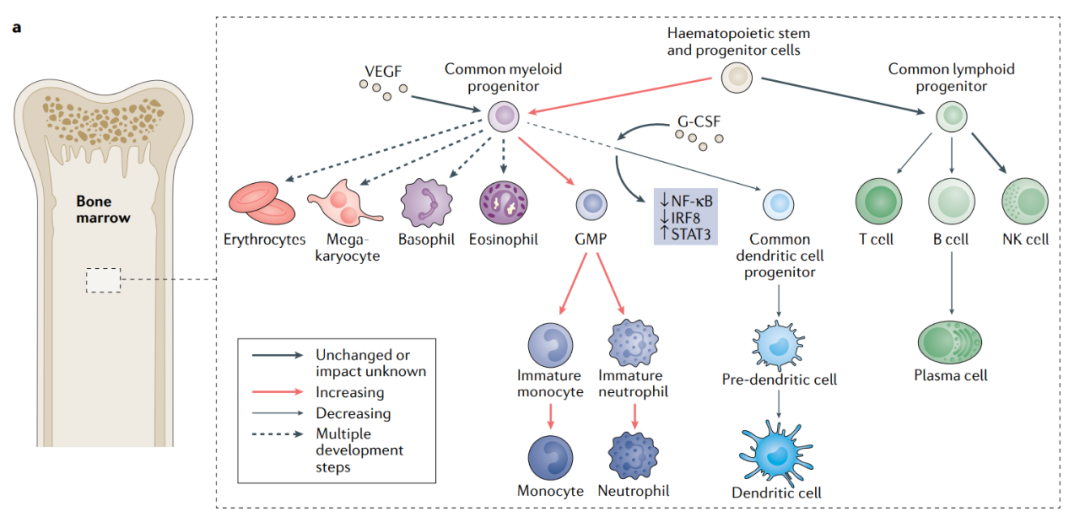
造血干细胞和祖细胞被动员到单核细胞和粒细胞系的增殖和分化中,导致未成熟免疫抑制性中性粒细胞,包括多形核骨髓源性抑制细胞(PMN-MDSCs)、单核细胞(M-MDSCs)和巨噬细胞的外周扩增和肿瘤内积聚。对40000多名患者进行的综合荟萃分析发现,血液中的中性粒细胞频率升高,通过中性粒细胞与淋巴细胞比率测定,与间皮瘤、胰腺癌、肾细胞癌、结直肠癌、胃食管癌、非小细胞肺癌(NSCLC)、胆管癌和肝细胞癌患者的不良预后相关。
除了通过异常造血过度产生单核细胞和中性粒细胞外,在肿瘤负荷宿主的外周还观察到树突状细胞的扰动。这对抗肿瘤免疫反应的发展具有重要意义,因为树突状细胞在许多情况下是CD8+和CD4+T细胞启动、分化和增殖的关键协调器。与健康对照相比,癌症患者的外周血中DC细胞减少。
研究最多的癌症中T细胞的扰动是外周抑制性CD4+调节性T(Treg)细胞的扩增及其向肿瘤的浸润。最近的研究表明,癌症患者血液中的Treg细胞与肿瘤内T细胞具有相同的表型和TCR谱,这表明相当一部分肿瘤内抑制性Treg细胞来源于自然产生的胸腺Treg细胞,而不是通过肿瘤诱导的幼稚CD4+T细胞分化。
另一个在肿瘤进展中起作用的抑制性淋巴细胞是调节性B细胞,其特征在于产生抗炎细胞因子IL-10。与Treg细胞类似,在胃癌和肺癌患者的外周血中观察到调节性B细胞的扩增,而总B细胞的频率保持不变。
此外,自然杀伤(NK)细胞是抗肿瘤免疫的另一个重要组成部分。乳腺癌患者的外周NK细胞也具有改变的表型,其特征是激活受体的表达减少,包括NKp30、NKG2D、DNAM-1和CD16,在胃肠道间质瘤患者中,外周NK细胞显示激活受体NKp30的表达水平降低,NKp30交联后脱颗粒受损。
传统治疗引起的免疫系统变化
癌症的传统治疗策略,包括化疗、放疗和手术,也会扰乱了全身免疫景观。了解这些系统性免疫后果对于设计增强而不是阻碍抗肿瘤免疫反应的策略非常重要。
化疗和放疗
化疗和放疗旨在通过在分裂期间破坏细胞完整性来靶向癌细胞。然而,这些药物也可以诱导免疫重塑,从而阻碍或增强整体治疗效果。
化疗和放疗对免疫系统的影响在很大程度上取决于环境。在非小细胞肺癌中,标准的长时间低剂量放疗会导致髓系细胞扩增、抗原递呈细胞功能降低和T细胞反应受损。宫颈癌患者在联合化疗和放疗后也观察到类似的免疫影响。
化疗可以增强全身抗肿瘤免疫,同时破坏癌细胞分裂。最近的研究表明,对三阴性乳腺癌(TNBC)术前新辅助化疗的有效反应诱导新的T细胞克隆招募到TME,而非原有细胞的扩增。此外,不同的乳腺癌亚型对化疗表现出不同的免疫反应,反映在外周CD8+T细胞的功能上。雌激素受体阳性(ER+)乳腺肿瘤患者循环中PD1+CD8+T细胞的功能下降,ER+HER2+乳腺肿瘤患者在该亚组中则完全丧失功能。相反,TNBC患者表现出高功能的PD1+CD8+T细胞升高,产生效应细胞因子,包括IFN-γ、TNF和颗粒酶B,并有克隆扩增的证据。
肿瘤切除
最近的几项研究表明,系统性创伤愈合诱导髓系免疫细胞重塑。切除或不依赖于原发肿瘤切除的创伤可触发愈合,提高循环IL-6、G-CSF和CCL2,并最终将髓系亚群推向免疫抑制状态。
然而,有证据表明,原发性肿瘤可能是系统免疫重塑的主要驱动因素。在乳腺癌和结肠癌小鼠模型中成功切除原发性瘤足以在很大程度上恢复正常的系统免疫组织,使免疫细胞与健康对照小鼠的相当。
因此,手术可能对系统免疫系统产生有害和有益的影响。术后早期伤口愈合触发的免疫抑制机制可能为癌细胞的生长提供了一个机会窗口。然而,原发性肿瘤负担的减少最终可以恢复系统免疫能力,从而产生强烈的适应性反应。发现癌症类型,尤其是疾病阶段如何影响手术后的免疫重建以及由此产生的转移潜能,将是非常重要的。
免疫治疗中的系统反应
癌症免疫治疗有效性的主流观点围绕着在TME内重振细胞毒性效应器的概念,但该领域对有效抗肿瘤免疫的基本系统性的认识正在增长。最近的研究表明,免疫检查点抑制剂(ICIs)依赖系统免疫机制实现有效的抗肿瘤反应。此外,微生物组正在成为免疫系统的有效调节剂。

完整的外周免疫对免疫治疗效果至关重要
完整的外周免疫功能、通讯和转运是ICI产生疗效所必需的。全身化疗可能会破坏外周免疫完整性,从而阻碍PD-1阻断的治疗效果,导致全身淋巴耗竭并消除长期免疫记忆。相比之下,局部化疗可以避免损害外周免疫,与PD-1阻断协同诱导树突状细胞浸润到肿瘤中并克隆扩增抗原特异性效应T细胞。
CD103+树突状细胞通过CCR7依赖性机制从肿瘤迁移到dLN将肿瘤抗原转运到外周免疫系统,然后这些树突状细胞也可以激发肿瘤特异性T细胞。新启动的肿瘤特异性T细胞随后从淋巴结流向肿瘤,而这一循环是自然和治疗诱导抗肿瘤免疫中的一个重要过程。
有效的免疫疗法驱动新的免疫反应
抗肿瘤反应最终需要TME内的功能性效应淋巴细胞介导癌细胞杀伤。然而,随着时间的推移,肿瘤内T细胞可能产生耗竭,使其无法发挥关键效应器功能。
为了克服局部免疫功能失调,有效的免疫疗法会驱动新的外周免疫反应,最终导致新的效应T细胞浸润。一些报告现已表明,PD-1和PD-L1阻断可将新的T细胞克隆驱动到TME中,这些克隆在治疗之前并不存在。此外,抗CTLA-4也被证明能显著增加黑色素瘤患者的外周T细胞反应性,表明新的T细胞启动是一种作用机制。
总之,这些结果支持这样的观点,即不仅外周免疫参与了新的抗肿瘤反应,而且具有新抗原特异性的额外幼稚T细胞的从头启动也有助于有效的免疫治疗。
小结
除了癌症中免疫系统的重组外,越来越多的证据表明,肿瘤负荷的免疫状态与未受干扰的免疫系统的功能不同。从外周协调的从头抗肿瘤免疫反应的发展对于免疫治疗效果至关重要。肿瘤免疫系统中的任何功能异常都可能导致免疫治疗效果不佳。因此,对于我们有必要对癌症中系统免疫全局进行更加深入的研究,这将有助于我们对肿瘤免疫药物的开发和新靶点的发现。
参考文献:
1.Systemic immunity in cancer. Nat Rev Cancer.2021; 21(6): 345–359.


