Cell子刊:南京大学魏嘉/李劼:基于糖工程的抗PD-1-iRGD肽偶联物通过T细胞结合增强抗肿瘤功效
时间:2024-06-14 20:00:25 热度:37.1℃ 作者:网络
尽管近年来免疫检查点抑制剂取得了重要突破,但客观有效率仍然有限。
2024年6月5日,南京大学魏嘉及李劼共同通讯在Cell Reports Medicine 在线发表题为“Glycoengineering-based anti-PD-1-iRGD peptide conjugate boosts antitumor efficacy through T cell engagement”的研究论文,该研究表明基于糖工程的抗PD-1-iRGD肽偶联物通过T细胞结合增强抗肿瘤功效。该研究通过糖工程方法合成程序性细胞死亡蛋白-1 (PD-1)抗体-iRGD环肽偶联物(aPD-1-(iRGD)2)。
除了增强组织渗透外,aPD-1-(iRGD)2通过双靶向同时作用于肿瘤细胞和PD-1+ T细胞,从而介导肿瘤特异性T细胞的活化和增殖,对非特异性T细胞有轻微影响。在多个同基因小鼠模型中,aPD-1-(iRGD)2可有效抑制肿瘤生长,并具有良好的生物安全性。此外,流式细胞术和单细胞RNA-seq结果显示,aPD-1-(iRGD)2重塑了肿瘤微环境,并扩大了表达干细胞和记忆相关基因(包括Tcf7、Il7r、Lef1和Bach2)的“更好效应”CD8+肿瘤浸润T细胞群。

近年来,以免疫检查点抑制剂(ICIs)为代表的癌症免疫治疗为晚期癌症患者带来了显著的生存益处。尽管ICIs的适应症随着时间的推移而扩大,但在几种类型的实体肿瘤中,ORR仅为10%-30%,这促使研究人员开发具有更好抗肿瘤疗效的新型ICIs。双特异性T细胞接合物(bisspecific T cell engaggers,BiTEs)是一种新兴的免疫疗法,具有治疗癌症的潜力。由于其对T细胞和肿瘤细胞的亲和力,与天然抗体相比,BiTEs表现出接合效应,可以在较低剂量下介导有效的肿瘤控制。然而,传统的BiTEs含有一个或多个CD3结合域来实现T细胞接合,从而绕过T细胞受体(TCR)和肽-主要组织相容性复合体(pMHC)的相互作用,并可能诱导非选择性T细胞活化和严重的副作用。
内化RGD (iRGD, c(CRGDKGPDC))是一种很有前景的靶向给药工具,它通过与肿瘤血管上的αv整合素结合,促进药物外渗到肿瘤组织中随后,蛋白水解裂解暴露出一个CendR基序(CRGDK),允许iRGD与肿瘤细胞和内皮细胞上的神经肽-1 (NRP-1)相互作用。这种相互作用激活了胞吞作用过程,促进了细胞深入肿瘤的有效渗透。因此,iRGD的多步骤机制,包括血管结合和蛋白水解激活,强调了其在改善治疗药物靶向递送实体肿瘤方面的潜力。iRGD已被应用于通过与整合素和神经肽-1 (NRP1)相互作用向肿瘤组织输送药物,包括化疗药物、单链单克隆抗体和纳米颗粒。理论上,iRGD的附着也可以促进aPD-1的肿瘤渗透。然而,原生双链单克隆抗体(mAb)的iRGD修饰尚未见报道。传统上,iRGD修饰是通过质粒转染和随后的真核或原核表达进行的。原核系统不能表达双链单克隆抗体,而真核系统难以构建完全转化的iRGD环状结构(经常观察到部分环化)。
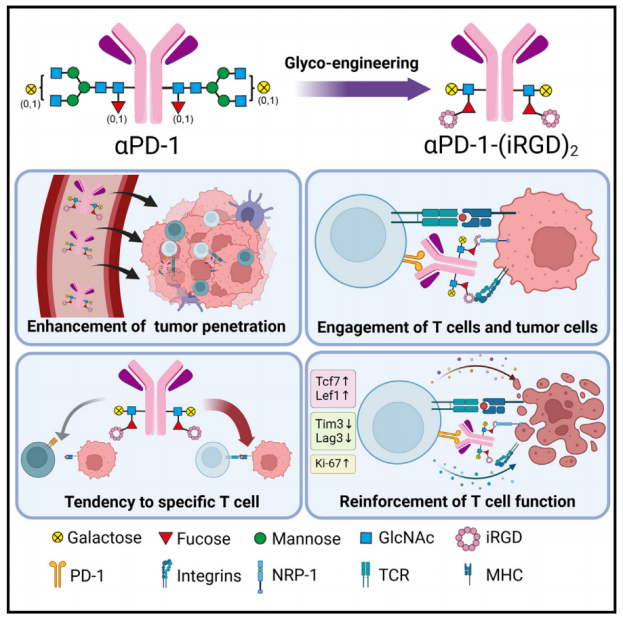
机理模式图(图源自Cell Reports Medicine )
该研究通过糖工程和生物正交反应制备程序性细胞死亡蛋白-1抗体-iRGD环肽偶联物(aPD-1-(iRGD)2)。与BiTEs类似,aPD-1-(iRGD)2与T细胞和肿瘤细胞结合,激活肿瘤特异性T细胞,促进肿瘤消除。在多种小鼠肿瘤模型中,全身给药aPD-1-(iRGD)2可引发肿瘤微环境(TME)调节和令人印象深刻的肿瘤生长控制。此外,aPD-1-(iRGD)2激活并扩增了表达干细胞和记忆相关基因(Tcf7、Il7r、Lef1和Bach2)的肿瘤浸润T细胞(TILs)亚群,这可能是通过肿瘤特异性T细胞与癌细胞结合而诱导的。综上所述,aPD-1-(iRGD)2是一种很有前景的抗体偶联治疗药物,超越抗体-药物偶联治疗癌症。
原文链接:
https://doi.org/10.1016/j.xcrm.2024.101590


