【衡道丨干货】病理技术——淋巴结组织冷冻切片技术分享
时间:2024-06-29 06:03:46 热度:37.1℃ 作者:网络
在术中对淋巴结进行冷冻切片检查,可以在短时间内确定手术范围,及时更改手术方案。但淋巴结通常被脂肪包裹,或本身脂肪化,同时多枚送检,加上制片时间限制,可能会导致冷冻制片质量参差不齐,甚至难以制片。淋巴结组织冷冻切片后,诊断医生要在淋巴细胞群中寻找肿瘤细胞,如果制片质量不佳,则很容易出现漏诊或误诊,因此,淋巴结冷冻切片的重切率在很多病理科高居榜首。
一、取材
通过手指触摸脂肪中较硬的结节,淋巴结手感为光滑圆形或者椭圆形,轻压易活动,剔除周围脂肪,暴露整个淋巴结。此步骤基本由取材医师完成,技术老师应提醒取材医师淋巴结取材注意事宜。
注意事项:
1、一定要保证取材台,取材刀和纱布是干燥的,减少人为带入水分,标本下最好垫上吸水纸,吸水纸可吸去部分脂肪,及时擦去手套上粘的脂肪,以免影响取材。
2、尽可能剔除淋巴结周围脂肪,不要破坏淋巴结被膜。
3、最大径大于5mm的淋巴结要对剖取材,对剖尽可能沿长轴对剖,暴露淋巴结的最大面。
4、淋巴结直径大于2cm时,需要按书页状切开取材。
5、每个冻头尽可能不超过3枚淋巴结。
6、淋巴结送检通常是多枚同时送检,取材时要注意区分部位。

多枚淋巴结同时送检
二、包埋
高质量包埋是决定淋巴结冷冻切片的关键。
通常滴加少许OCT于冷冻头上,轻轻放上淋巴结组织,待淋巴结四周包埋剂变白(冷冻完成)后使用冷冻锤轻压在组织表面,加速冷冻。对于淋巴结较小或者一个冻头包含数枚淋巴结时,要合理使用“冰垫”,即提前滴适量OCT部分冷冻,再将组织放在OCT上。多枚淋巴结包埋于一个冷冻头时,要沿着淋巴结长轴平行包埋,形同“川”字包埋。淋巴结常常是多枚统一送检,根据个人切片速度,包埋合适数量的冷冻头,冷冻太久会对细胞核造成不可逆的影响。个人经验,先冻两个,切完再冻两个,即切二冻二。
注意事项:
1.淋巴结包埋,要注意用OCT完全包裹淋巴结。
2.添加OCT时需要轻柔,避免反复挤压,空气倒流,胶内产生小气泡。
3.同一份标本,淋巴结大小或厚度不一致时,大的厚的先包埋,小的薄的后包埋。

冰垫

挤胶时形成气泡,需要及时用镊子刺破
三、切片与贴片
淋巴结组织由于细胞致密,纤维较少,切片时易有裂隙或发脆,切片时下刀要匀速、缓慢,贴片时要自然,尽量不要牵拉。
温度:通常组织的切片温度为-20℃,淋巴结宜稍高2-3℃。
厚度:4-6μm,切片机机箱的温度和切片手法对厚度影响较大,温度恒定,转速均匀,每张切片的厚度差别不大。
注:
在不同切面各取一张切片,即需要深切后再取一张切片,以减少漏诊,这一步很关键。
常见淋巴结类型分为如下五种:
边缘型、中央型、完全型、不对称型和多枚型。
1、边缘型(淋巴结和脂肪组织各在一边),这种是最常见的类型,淋巴结脂肪化的后果。切片只需要沿着淋巴结的长轴切片,一般可以获得质量较高的切片。
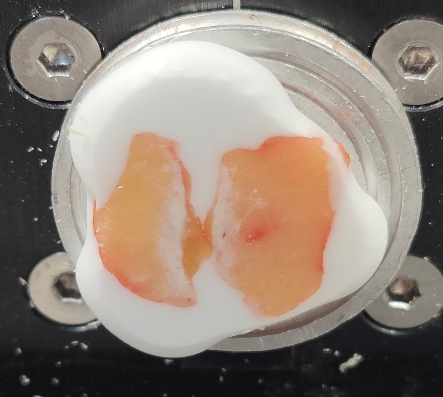
边缘型
2、中央型(淋巴结四周被脂肪包裹或淋巴结包裹脂肪),这种淋巴结往往切片难度较大,需要一定的技巧,否则易卷曲或折叠。文献报道的有抠出脂肪补胶法,挤压法,搭桥法等多种方法,无论哪种方法都是为了减少脂肪的干扰。我常用的是粘附法,方便快捷,无需额外操作。脂肪组织在-20℃时,仍然较软,却具有一定的粘附性,只需要缓慢转动手柄,用毛笔轻轻压住切片,保持不动,不可边切边牵拉,切脂肪时,脂肪在刀口少量残留,切淋巴结时,利用脂肪粘附性将淋巴结两边粘附在OCT上,再轻轻展开,贴片即可。
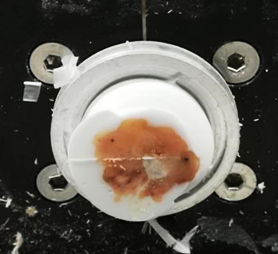
中央型

中央型切片手法
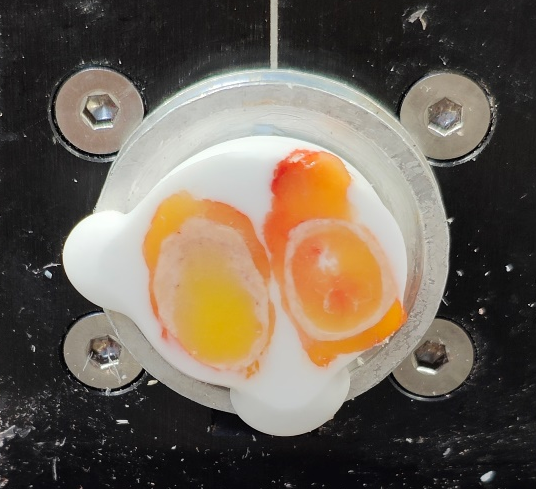
3、完全型(淋巴结周围无脂肪组织),这种常见于肺淋巴结和颈部淋巴结,送检淋巴结周围脂肪组织较少,容易寻找和脂肪易剔除,切片难度不大。
完全型
4、不对称型(淋巴结对剖之后,一半是淋巴结大部分,一半是淋巴结小部分或无淋巴结)这种淋巴结也十分常见。切片只需要关注淋巴结部分即可,切片易形成褶皱,可采用吸水纸挤压法,粗修暴露脂肪和淋巴结,用吸水纸轻轻挤压脂肪,使脂肪凹陷,切片时即可跳过脂肪,形成完整切片。

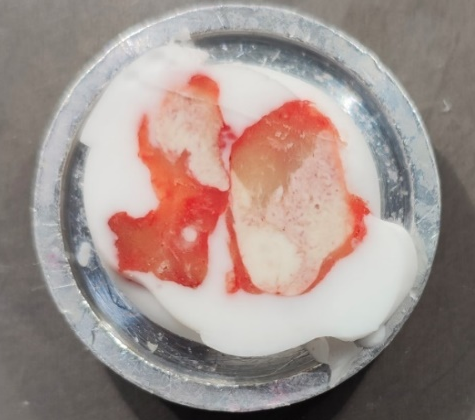
不对称型
5、多枚型(同一块组织中有两枚或以上淋巴结)这种比较少见,取材时,几枚淋巴结十分靠近,无法区分。切片时要平行切或者调整淋巴结的上缘在同一水平线,也可以参考中央型淋巴结的切片方法,能切出较理想的切片。
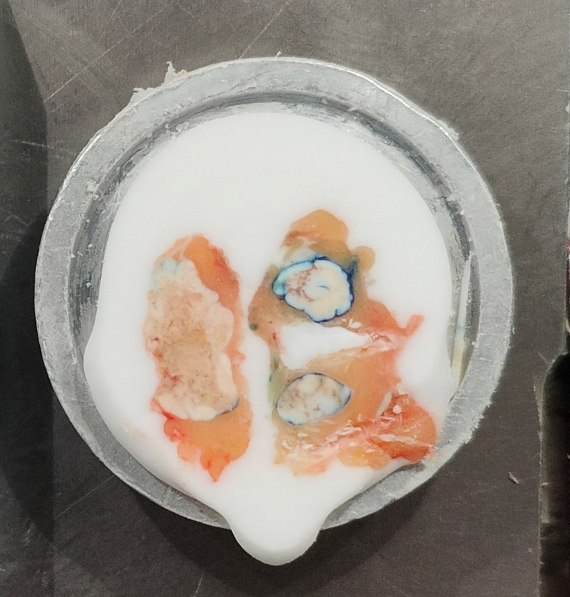

多枚型
四、固定
淋巴结中淋巴细胞密集排列,缺少纤维结缔组织,淋巴细胞缺少细胞质的保护,极易受到环境的影响,因此淋巴结一定要贴片后立即浸泡固定。固定的好坏直接影响染色质量,单纯固定液固定不少于1min,混合固定液固定不少于15s。冷固定和常温固定差别不明显,但常温固定试剂易挥发,浓度不可控,工作量较大的实验室推荐冷固定。常用的固定液有甲醇、95%乙醇和一些混合固定液(如乙醚酒精,AAF液等)。固定液大部分是透明液体,固定液浓度至关重要,要勤更换。日常工作中,混合固定液固定速度和效果普遍优于单纯固定液,尤其可缩短固定时间。但是混合固定液通常保存时间较短,各原材料的浓度会影响固定效果。
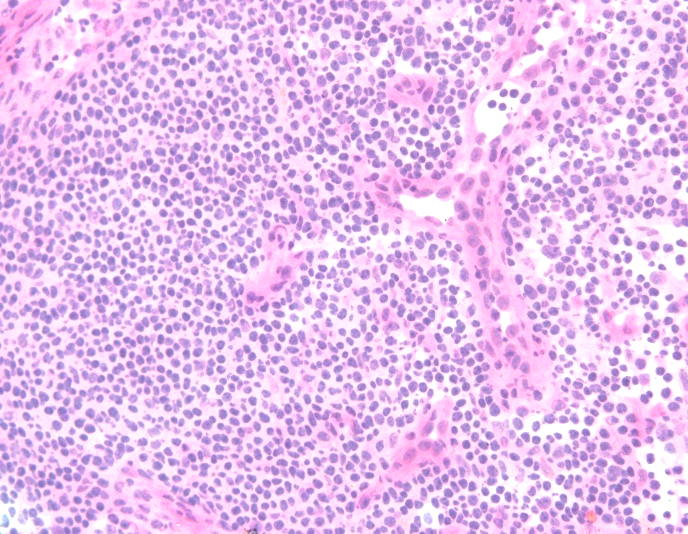
固定不佳。
左图为固定不及时,染色对比度差,细核呈灰蓝色;右图为甲醇固定30s,细胞核肿胀
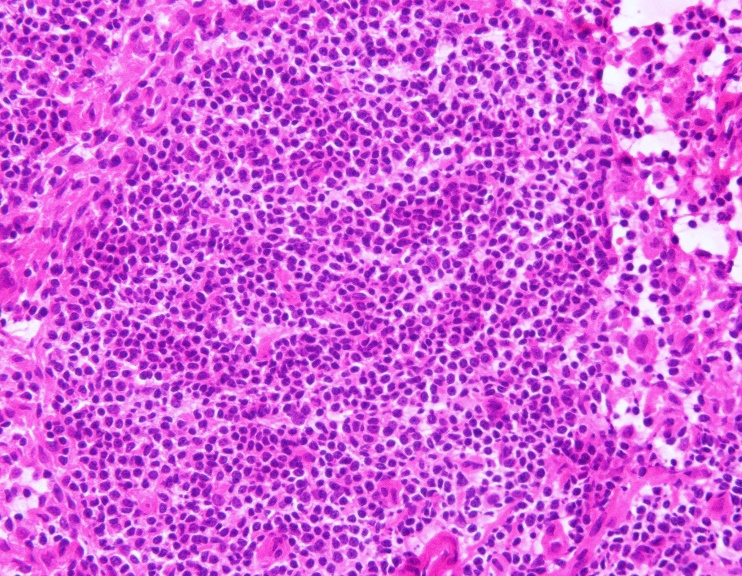
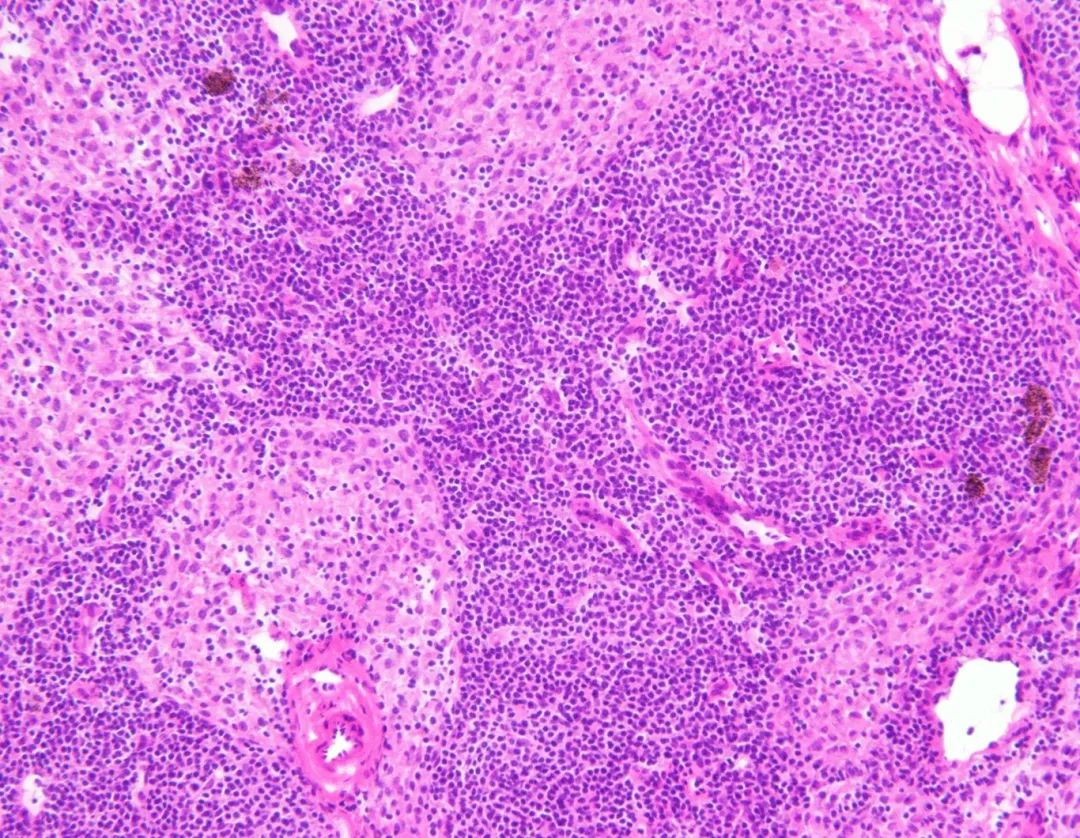
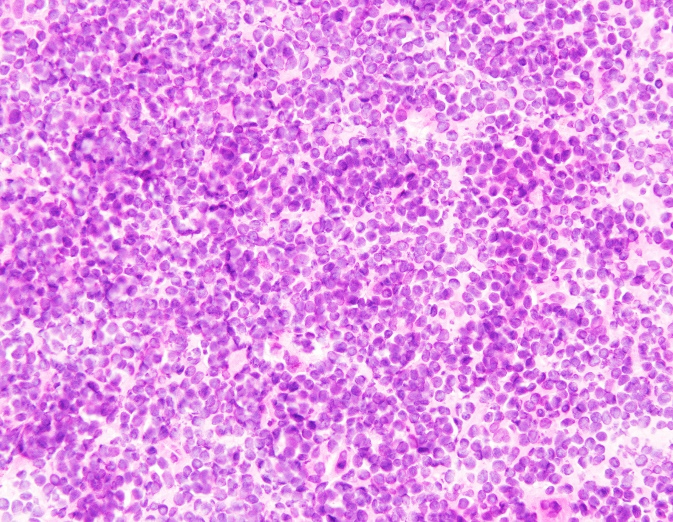
固定较好。
左图为甲醇固定1min;右图为AAF液固定15s
五、染色
淋巴结切片染色通常不必单独设置染色程序,但推荐增加分化步骤,部分实验室为了追求染色时间短,有可能省略分化步骤,在淋巴结切片中分化能让细胞核染色更透亮,核内颗粒更清晰,有助于诊断。
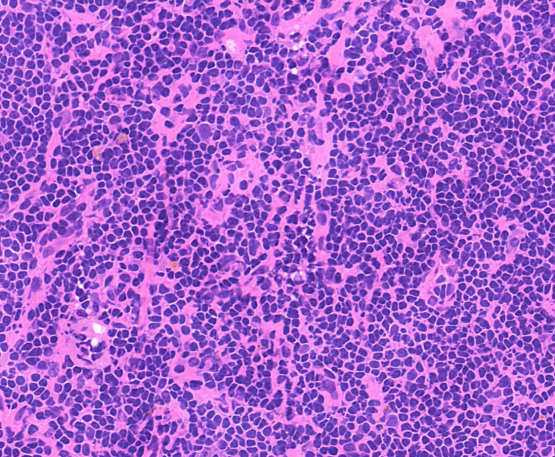
分化前
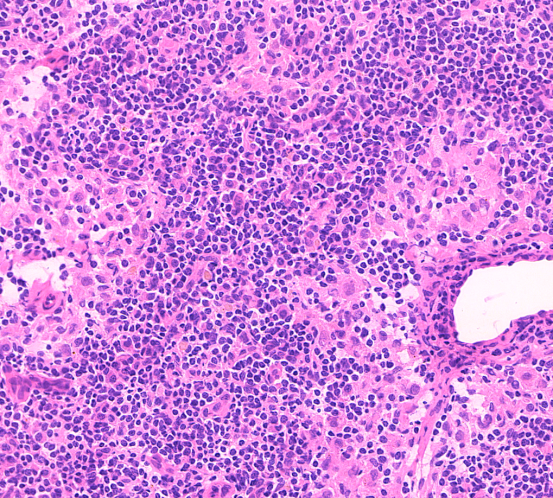
分化后
六、淋巴结切片中常见问题
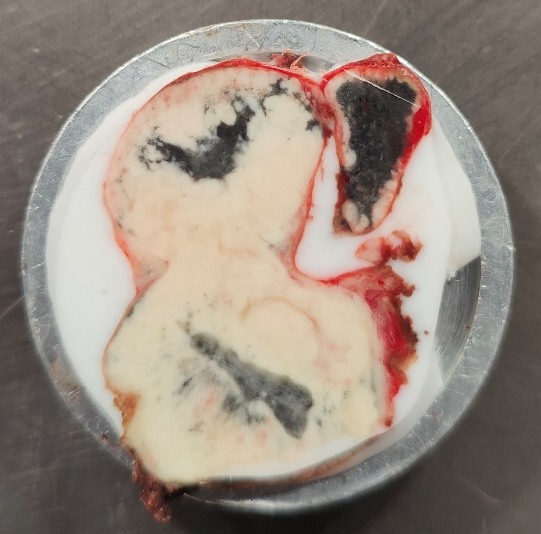
1、冰晶:冰晶是不可避免的,微小冰晶不影响组织细胞形态。
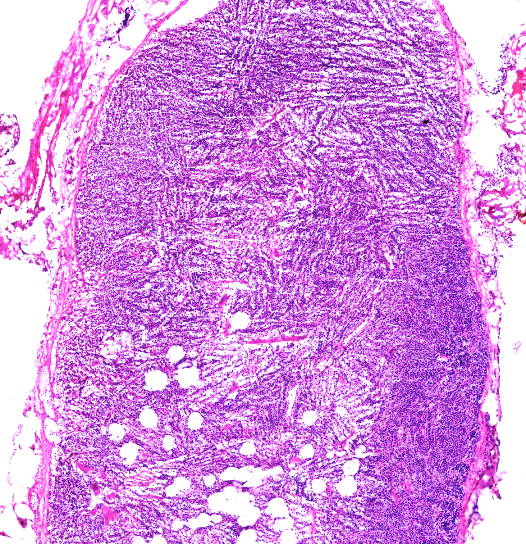
注:大冰晶破坏组织结构
2、不同程度掉片:
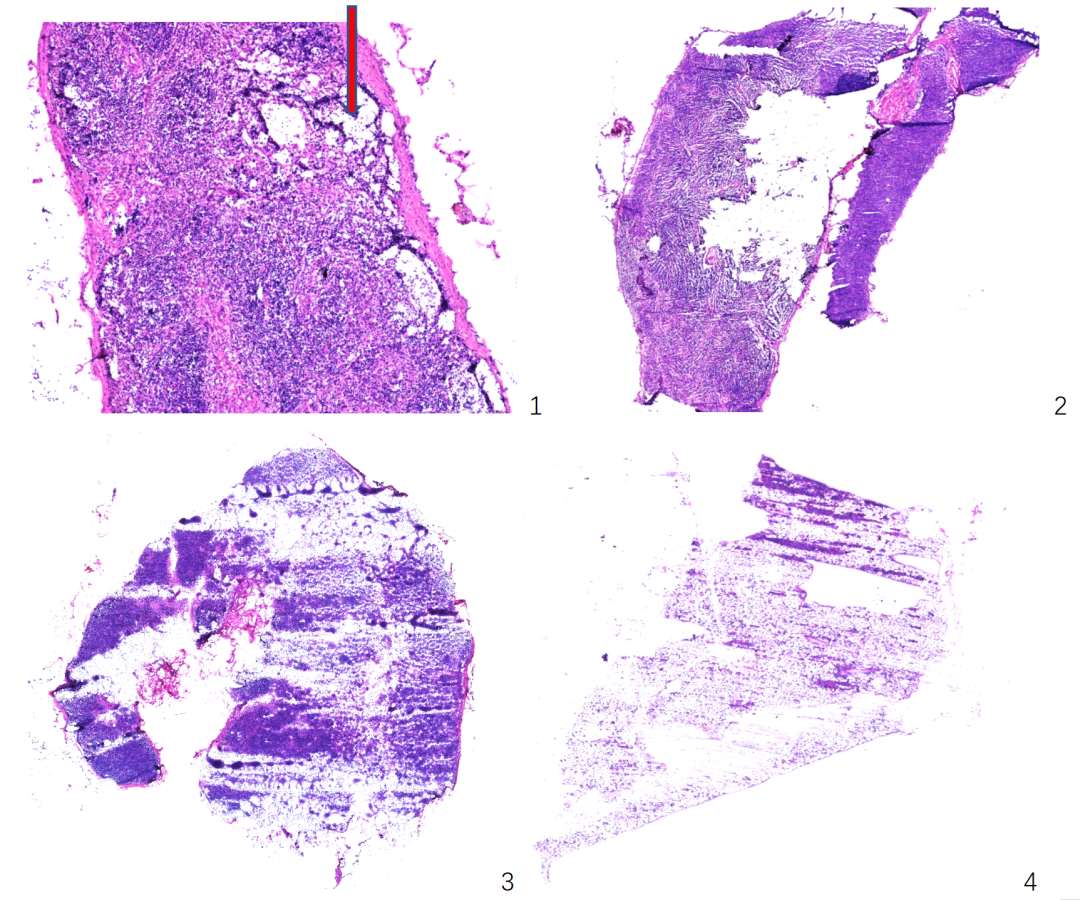
3、漏诊:
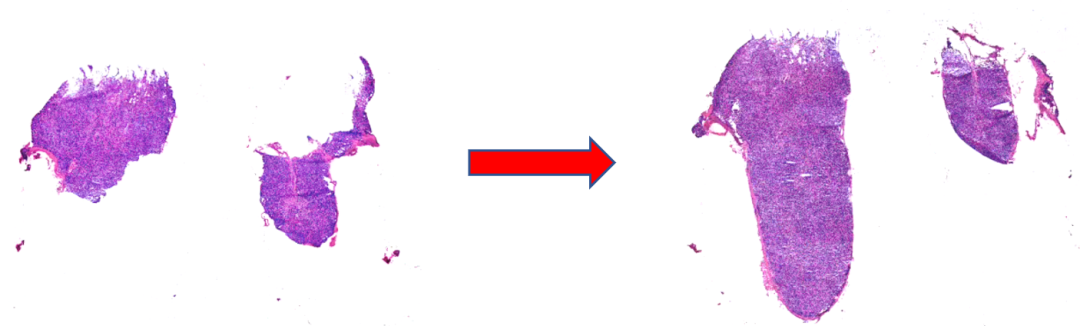
切片不完整是导致漏诊的主要原因
4、贴片牵拉:
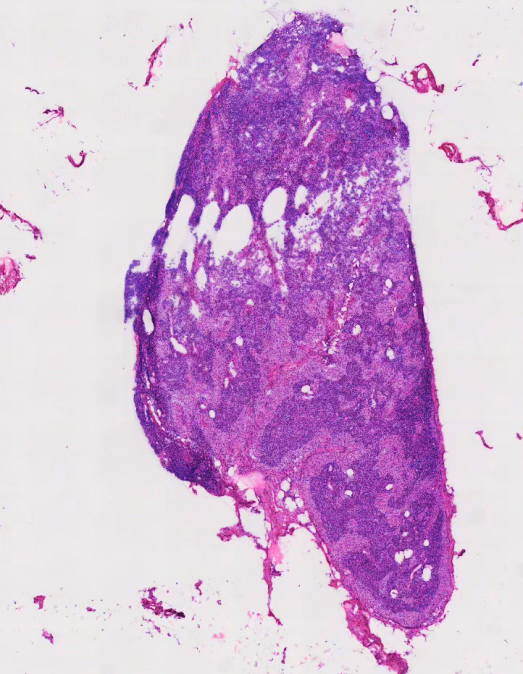
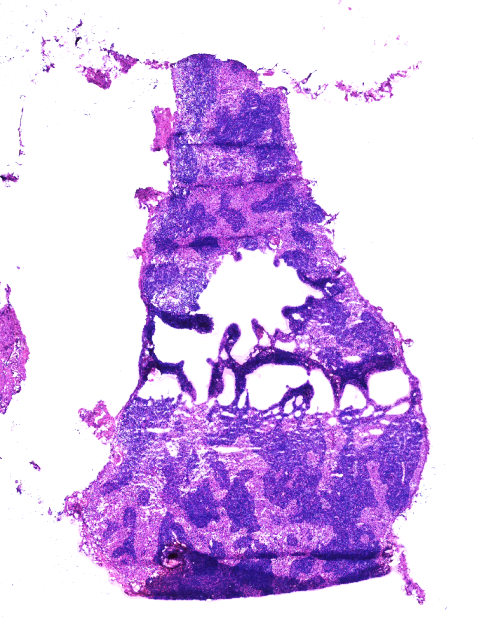
5、卷曲:
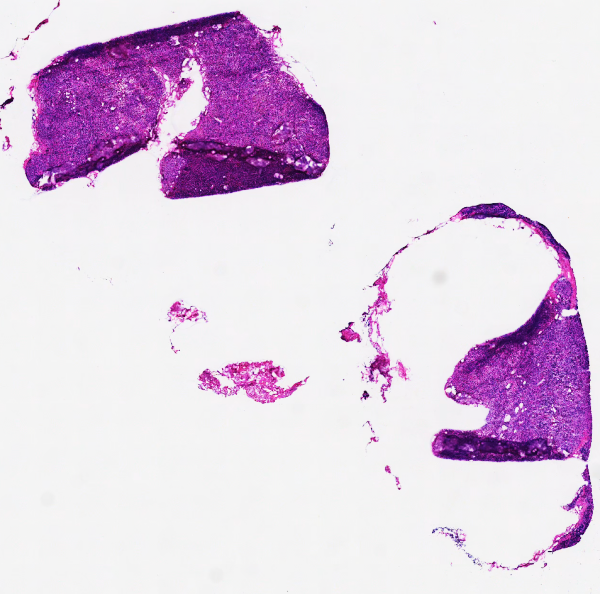
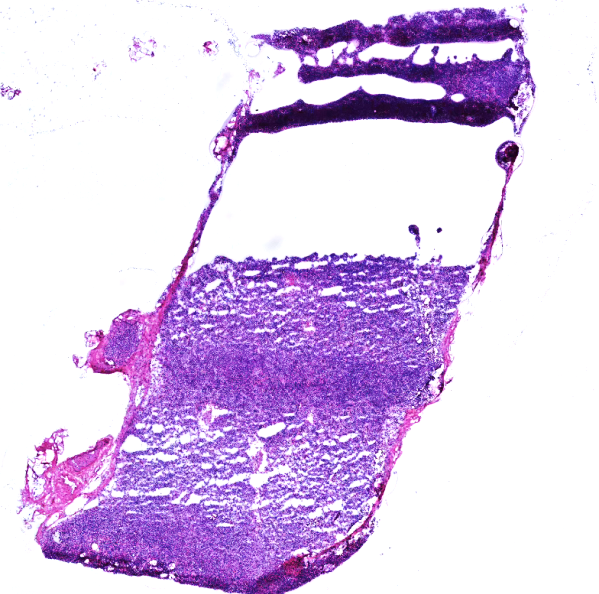
6、染色不佳:
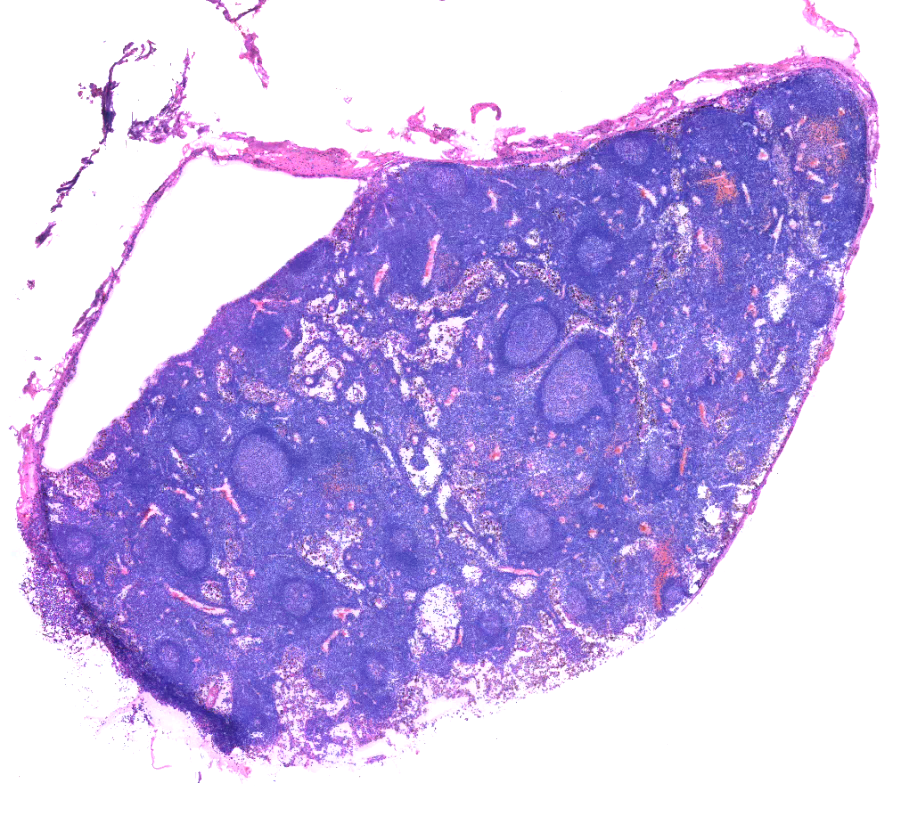
淋巴结最常见的染色不佳是伊红着色浅
7、包埋切片原因:
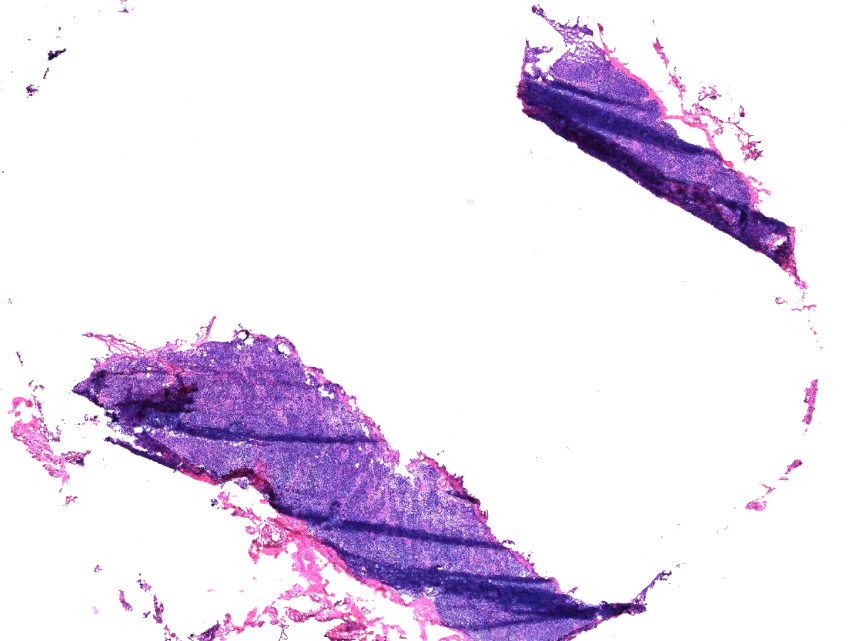

包埋不紧凑和切片角度选择错误导致切片质量不佳
8、裂隙:
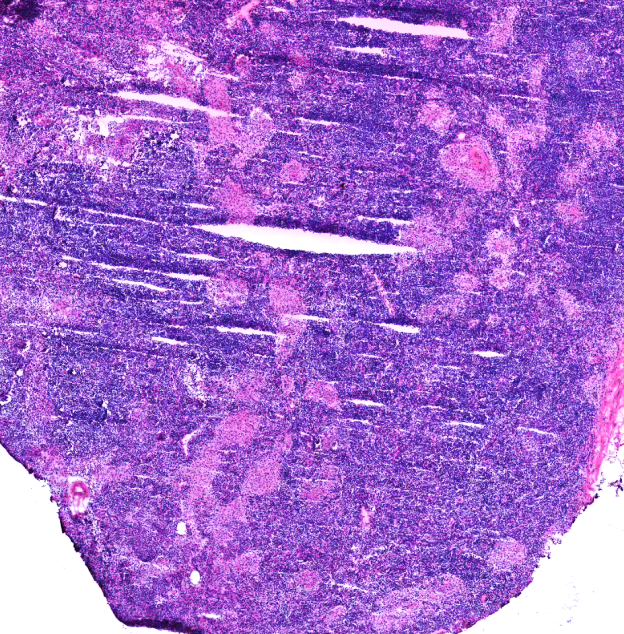
裂隙一般是由冷冻温度过低导致,也可见于切片速度过快
参考文献:
1.保乳标本乳腺切缘及前哨淋巴结的冷冻制片专家共识[J].临床与实验病理学杂志,2023,39(3):257-260.
2.张盛,王明伟,杨家莉,高少阳.介绍一种乳腺癌"孤岛"型前哨淋巴结冷冻制片方法[J].诊断病理学杂志,2023,30(10):1038,1042.DOI:10.3969/j.issn.1007-8096.2023.10.032.
3.刘菲菲,李雪.冷冻组织不同贴片方法对乳腺癌前哨淋巴结活检诊断的影响[J].诊断病理学杂志,2023,30(1):6-9,13.DOI:10.3969/j.issn.1007-8096.2023.01.002.


