【Cancer Lett】CAR-T诱发T细胞肿瘤的机制
时间:2024-07-04 21:01:43 热度:37.1℃ 作者:网络
CAR-T与T细胞肿瘤
FDA已要求所有在美国上市的CAR-T疗法加入黑框警告,需要关注继发性T细胞恶性肿瘤问题。但事实上,根据近期多篇报道及专家点评,认为无需过度担心CAR-T治疗后的第二肿瘤。那么CAR-T诱发T细胞肿瘤的潜在机制是什么?《Cancer Letters》近日发表文章进行剖析了两种假说,通讯作者为中南大学湘雅二医院药学部鲁琼教授。

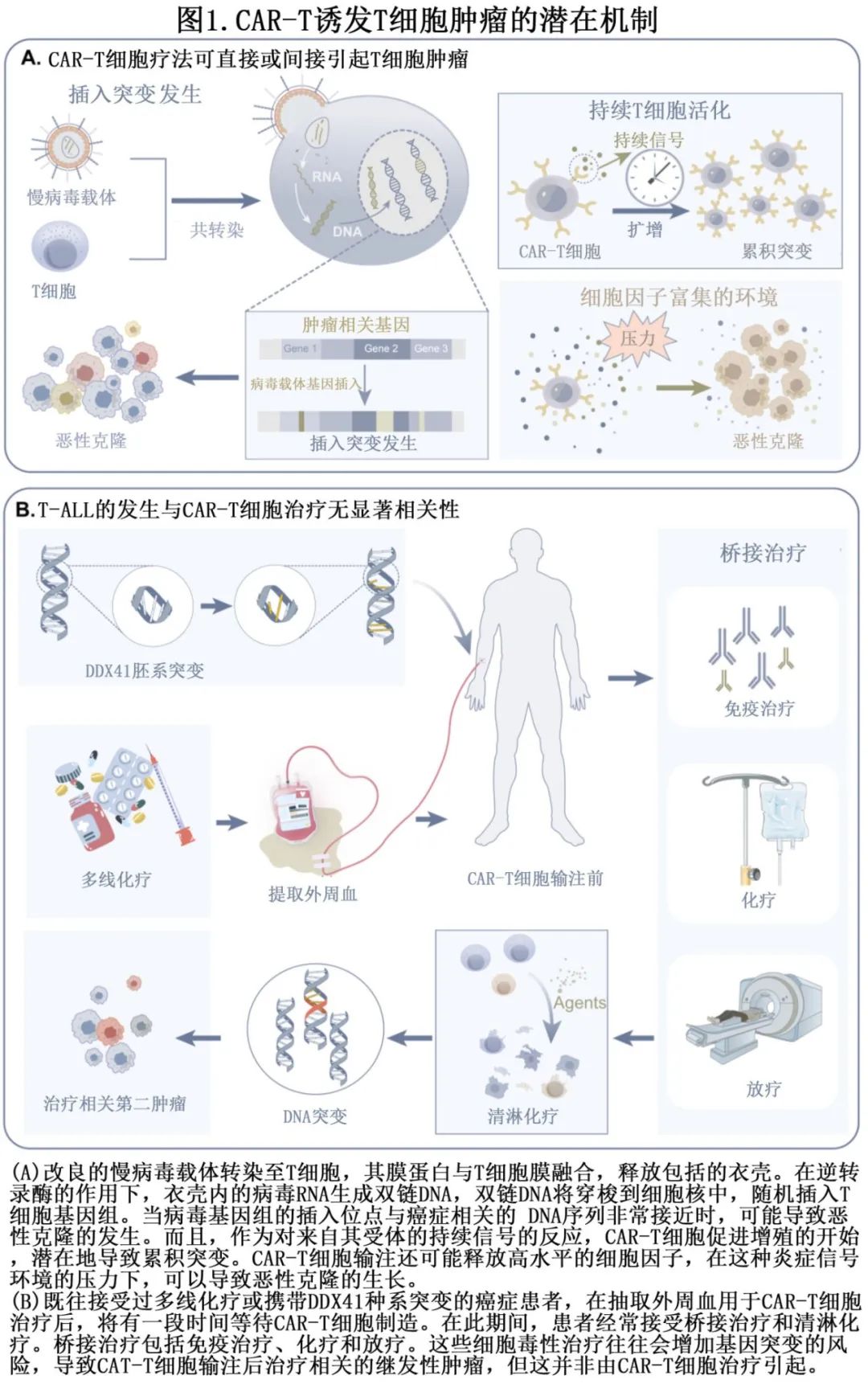
假说1:CAR-T细胞疗法可直接或间接引起T细胞肿瘤
插入突变
通过使用逆转录病毒或慢病毒载体对 T 细胞进行基因工程是使 T 细胞能够表达靶向分子的 CAR 受体的一种手段。为了提高安全性和降低原始病毒致病的能力,这两种病毒载体都经过专门的改造,将致病基因从病毒中移除,只留下使病毒能够包装和递送治疗基因所必需的基因,其主要功能是将 CAR 基因安全有效地递送至患者的 T 细胞。但这些病毒载体随机整合到细胞基因组中可能会干扰或激活控制细胞生长的基因,导致肿瘤细胞增殖失控。因此,与 CAR-T 细胞治疗相关的癌症风险可能源于其使用基因递送载体。这类病毒载体将基因组插入整合到宿主细胞基因组中,然后细胞继续分裂发挥抗肿瘤作用,但如果插入位点位于与癌症发生相关的 DNA 序列附近,则有可能引起癌症(图1A)。因此,大多数监管机构(如EMA和FDA)要求对载体产品和患者中的逆转录病毒/慢病毒载体进行广泛检测。
值得注意的是,利用全面的基因组分析可将特定的人类细胞状态与潜伏的病毒再激活事件联系起来。通过重新分析现有的测序数据集可以发现,一种地方性β疱疹病毒——人类疱疹病毒6型 (HHV-6) ,在标准CD4+ T细胞培养中重新激活。利用单细胞基因组学描述了一种罕见的 CAR-T 细胞状态,即在体外细胞培养和患者体内均高表达HHV-6。这些结果表明,在当前和未来的细胞治疗产品中,应广泛考虑细胞治疗中潜伏病毒再激活的潜力。在此,以 HHV-6 为例,越来越多的证据表明,CAR-T细胞治疗受者可能存在 HHV-6 再激活的风险。HHV-6 表现出通常与致癌病毒相关的特征,包括通过抑制 T 细胞的增殖反应和逃避免疫监视诱导免疫抑制状态的能力。HHV-6 还能够通过改变免疫因子的表达和下调 T 细胞表面受体来调节宿主的免疫反应,导致免疫失调和免疫抑制。此外,HHV-6可以整合在染色体的端粒附近,导致端粒定位的破坏和肿瘤发生的风险增加。
持续的T细胞活化和炎症相关的细胞因子富集环境
通过基因工程修饰 T 细胞上的 CAR 受体持续发出信号可能导致生成增殖的 T 细胞,随着时间的推移,可增加累积突变的风险。此外,持续的信号激活导致细胞因子释放无效,CAR-T细胞进入衰竭状态,抑制性受体上调,扩增能力降低,效应细胞分化过度,抗肿瘤活性受损。在干扰素调节因子4(IRF4) 缺陷的慢性淋巴细胞白血病小鼠中发现,T细胞耗竭是促进肿瘤免疫逃避的新机制,可以加速慢性淋巴细胞白血病发展。有趣的是,最近的一项研究证明,利用T细胞淋巴瘤自然发生的突变来改造 T 细胞是一种有希望的方法,可增强治疗性 T 细胞的抗肿瘤功效。
大多数患者在 CAR-T 细胞输注后会产生高水平的细胞因子,即CRS,但严重程度不同。Kitamura 等人表明 CAR-T 细胞输注后,骨髓微环境被破坏,骨髓中炎症相关细胞因子持续升高,与随后长时间的血细胞减少有关。持续的炎症相关细胞因子微环境是免疫抑制的纽带,导致肿瘤的启动、升级、恶性转化、侵袭和转移。此外,慢性炎症可导致致癌改变,如癌基因的激活、活性氧的产生和 DNA 的损伤。因此,CAR-T治疗后患者的炎症信号环境可能促进恶性克隆的生长(图1A)。
假说2:T细胞恶性肿瘤的发病率与CAR-T细胞治疗无显著相关性
在接受 CAR-T 细胞治疗的患者中发生的大多数继发性恶性肿瘤无法检测到 CAR 转基因。研究人员对接受获批的 CAR-T 细胞产品 ciltacabtagene autoleucel 治疗的患者进行长期随访发现,发生继发性肿瘤的患者并没有携带 CAR 基因的癌细胞。治疗开始前对这些患者样本的进一步分析显示,癌前细胞表现出与癌细胞相同的组成,表明之前的治疗可能已经升高了发生继发性肿瘤的风险。Steffin 等分析了340例接受病毒载体修饰的基因编辑免疫细胞治疗的患者的随访情况,包括 CAR-T 细胞,在16例发生继发性肿瘤患者的活检样本中未检测到 CAR 转基因。Ghilardi 等描述了1例 CD19 CAR-T 细胞治疗后发生T细胞淋巴瘤的患者,定量聚合酶链反应 (qPCR)发现患者为 CAR 阴性T细胞淋巴瘤。在28例接受自体抗 CD20/CD19 双特异性 CAR-T 细胞治疗患者的随访研究中,2例患者发生急性髓系白血病,1例患者发生 EB 病毒阳性T细胞淋巴瘤。肿瘤活检的 qPCR 证明 CAR 转基因为阴性。这些发现与之前评估逆转录病毒安全性的研究一致,在 CAR-T 细胞产品中尚未发现具有复制能力的逆转录病毒或慢病毒。
此外,Harrison等报告了1例接受 BCMA CAR-T 细胞治疗的多发性骨髓瘤患者,在5个月后发生继发性T细胞淋巴瘤。尽管在癌细胞中检测到 CAR 基因,但证明 CAR-T 细胞治疗与继发性T细胞淋巴瘤发生之间的关系仍具有挑战性。由于还发现了TET2 p.H1416R和JAK3 p.V722I变体的存在,这些具有恶性潜能的突变可能在 CAR-T 细胞治疗前就已经存在,部分促成体的存的发生。关于哪些因素导致继发性肿瘤的发生仍不清楚。
大量研究表明,CAR-T细胞治疗中的成熟 T 细胞似乎对病毒载体诱导的诱变具有抗性。事实上,尽管转基因(包括 CAR 转基因)可介导异常的基因表达,但 T 细胞未发生恶变。Ruella 等报告了1例男性 B 细胞急性淋巴细胞白血病患者接受 CD19 CAR-T 细胞治疗但出现表达 CAR 的 CD19-B 细胞白血病复发,最终死亡。然而值得一提的是,该病例是罕见事件,仅仅证实CAR 诱导的耐药性的发生,而非表明 CAR 转基因随机插入诱导的恶性转化效应。研究还表明,尽管 CAR 转基因的插入突变导致异常的 CAR-T 细胞扩增,但异常扩增的 T 细胞诱导白血病的持续缓解,而没有恶变。Micklethwaite 等利用 piggyBac 转座子生成 CD19 CAR-T 细胞,用于治疗难治性 B 细胞淋巴瘤。研究中的10例患者中有2例在 CAR-T 细胞治疗后出现CAR+ T细胞淋巴瘤。然而,进一步的研究报道 CAR 转基因没有整合到已知的癌基因中,T细胞的恶变可能源于研究中使用的独特的制备方法。因此,T细胞恶性肿瘤的发生与 CAR-T 细胞治疗可能无明显相关性。
部分患者可能携带 DDX41 等胚系突变,使其易患多种癌症类型,包括 CAR-T 细胞治疗后发生、但非由 CAR-T 细胞治疗引起的 T 细胞白血病(图1B)。
谨慎选择患者对于优化 CAR-T 细胞治疗的结果至关重要。大多数接受 CAR-T 细胞治疗的患者都为晚期、难治性,疾病较为严重。接受 CAR-T 细胞治疗的患者之前接受过长期、多线化疗。此外,在授权的治疗中心等待输注时,患者需要接受桥接治疗和清淋化疗。因此,患者往往免疫功能低下,这些遗传毒性方案可能通过引起 DNA 突变导致治疗相关的继发性肿瘤的发生(图1B)。
总结
CAR-T 治疗技术的发展是肿瘤患者治疗的划时代里程碑,其优势远远超过潜在风险。截至2023年12月底,FDA批准的CAR-T产品已在美国输注34000次。FDA已报道22例继发于CAR-T治疗的T细胞恶性肿瘤,其中3例检测到CAR转基因。Ghilardi 等进行了一项研究,探索商业 CAR T 细胞治疗后继发性原发性恶性肿瘤的风险。值得注意的是,恶性肿瘤(如继发于 CAR-T 治疗的T细胞淋巴瘤)的概率极低,无需过度关注;尽管在某些情况下确实在恶性 T 细胞克隆中检测到 CAR 阳性基因,提示可能存在因果关系。总体而言,CAR-T治疗后的继发性恶性肿瘤极为罕见。对于常规治疗无效的血液系统恶性肿瘤患者,CAR-T治疗是延长其生命的一种有价值的策略。
还需要继续探索CAR-T细胞治疗引发继发性T细胞肿瘤的潜在机制,以进一步确保CAR-T细胞治疗的安全性。同时,持续监测CAR-T细胞潜在未知的严重副作用,对于采取措施避免或减轻脱靶效应也必不可少。
参考文献
Zhou Z, Zhang G, Xu Y,et al. The underlying mechanism of chimeric antigen receptor (CAR)-T cell therapy triggering secondary T-cell cancers: Mystery of the Sphinx? Cancer Lett. 2024 Jun 24:597:217083. doi: 10.1016/j.canlet.2024.217083.


