【期刊导读】综述:IFNα治疗慢乙肝的机制和提高疗效的潜在途径
时间:2024-07-07 06:00:35 热度:37.1℃ 作者:网络
编者按
聚乙二醇干扰素α(PEG IFNα)作为目前慢乙肝治疗的重要手段之一,其作用机制以及如何进一步提升其治疗效果仍然是当前研究的重点和难点。阐明IFNα如何抑制HBV复制和调节病毒免疫应答将有助于合理优化IFNα治疗方案,以提高临床治愈率。
近日,美国Baruch S. Blumberg研究所郭巨涛教授团队在Antiviral Research期刊发表综述,详细阐述了IFNα抑制HBV复制、调节抗病毒免疫应答以及潜在的治疗优化方法等方面的最新研究成果。

1 IFNα通过多种机制抑制肝细胞内HBV复制
IFNα抑制HBV复制的机制已在多种细胞和动物模型中得到研究。早期研究表明,IFNα通过抑制pgRNA包装到核衣壳中或破坏含HBV RNA和DNA的核衣壳来有效抑制HBV复制。然而,近期的研究发现,IFNα主要通过降低HBV RNA水平或诱导cccDNA降解来发挥作用,但并未抑制新的cccDNA的合成。PEG IFNα治疗HBV感染的小鼠后,HBV pgRNA和总HBV RNA显著降低,cccDNA总量没有改变。IFNα在缺乏适应性免疫系统的HBV感染的小鼠中的强效抗病毒应答突显了其在HBV感染的肝细胞中的治疗重要性。
对慢乙肝患者的肝内转录组分析表明,对IFNα有应答且实现HBV DNA检测不和HBeAg或HBsAg血清学转换的患者表现出更多数量的上调干扰素刺激基因(ISG)。虽然已有许多ISG被发现可能在不同的HBV复制步骤中发挥作用,但仍有待验证。
有关IFNα诱导HBV RNA降解的机制,研究表明,IFNα诱导的抗病毒蛋白优先促进pgRNA的降解,IFNα诱导的cccDNA微染色体的表观遗传学改变则抑制了pgRNA和亚基因组病毒RNA的转录。此外,IFNα诱导蛋白MxB也可能在抑制HBV转录中发挥作用。IFNα诱导HBx减少的机制则可能与IFNα诱导蛋白TRIM5结合HBx并促进其泛素化依赖性蛋白酶降解有关。
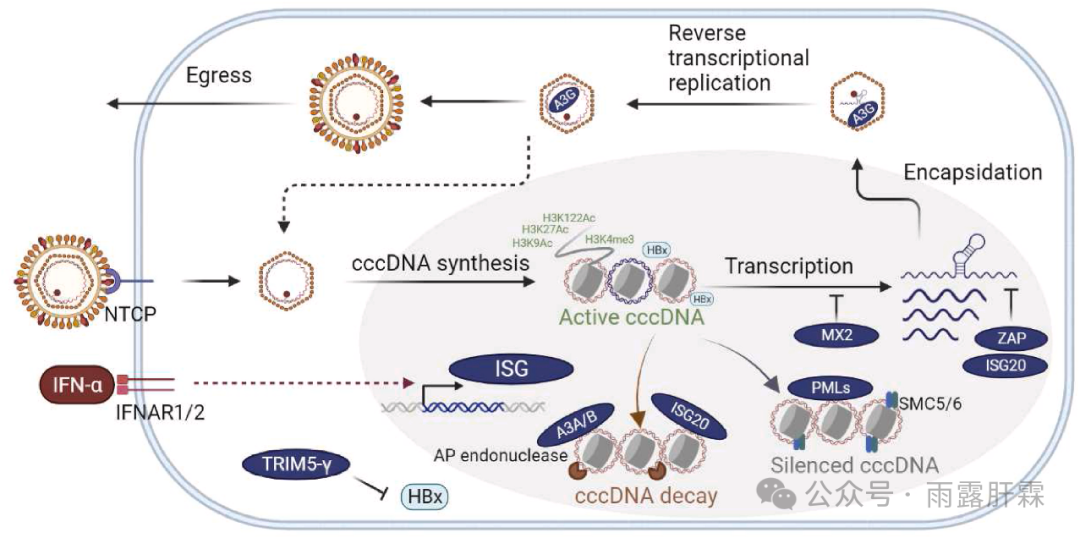
图1 IFN-α 抑制 HBV 复制的机制
2 IFNα对慢乙肝患者具有整体免疫调节作用
尽管IFNα在肝细胞中诱导的抗病毒应答通过多种机制抑制HBV复制,但仅靠这些作用难以彻底清除或永久性灭活肝脏中所有的cccDNA。实现慢乙肝的临床治愈,需要恢复HBV特异性的适应性细胞免疫和体液免疫应答,以对残留的HBV感染进行严密的免疫监控。作为宿主抗病毒免疫应答的关键调节剂,IFNα对多种免疫细胞具有广泛的影响。
2.1 特异性T细胞应答与IFNα的抗HBV作用有关
与急性HBV感染相比,慢乙肝患者的HBV特异性CD4+和CD8+T细胞频率降低且功能耗竭。HIV合并感染与IFNα治疗应答差、低CD4+ T细胞计数情况下的HBV频繁再激活相关,这表明功能性CD4+T细胞应答在IFNα控制HBV感染中至关重要。PEG IFNα治疗慢乙肝患者的CD8+T细胞绝对数量显著减少,尤其是高分化效应细胞,但对耗竭的HBV特异性CD8+T细胞的数量和功能影响不大。而在婴儿期感染乙肝的儿童中,拉米夫定/IFNα联合治疗显示,有应答者与无应答者相比,特异性T细胞增殖和CD8+ T细胞应答在治疗中更为活跃和广泛,且HBV DNA水平与特异性T细胞应答呈负相关,这可能是因为儿童的HBV特异性T细胞功能耗竭程度相对成人来说较轻,对IFNα治疗应答更好,同时,也可以解释为何7岁以下HBV携带者接受IFNα治疗的临床治愈率显著高于8-17岁患儿。
2.2 IFNα对体液免疫的调节有助于临床治愈
许多慢乙肝患者可检测到HBsAg特异性B细胞,但其抗体生成功能存在缺陷,这些B细胞表达高水平的PD-1等抑制性受体,并且可通过阻断PD-1部分恢复其功能。慢性HBV携带者外周血的HBsAg特异性B细胞频率明显低于接种过乙肝疫苗的健康人群,且基线时可检测到的HBsAg特异性B细胞与PEG IFNα治疗后较高的HBsAg血清学转换率相关。而HBsAg又是一种严格的T细胞依赖性抗原,B细胞向HBsAg特异性B细胞的分化及活化、IgG抗体的产生均需要CD40L+滤泡辅助T细胞(Tfh)的刺激,有研究显示,48周的PEG IFNα治疗显著增加了应答者中的CD40L+ Tfh数量。
2.3 IFNα介导的NK细胞扩增、功能激活与HBsAg持续下降有关
IFNα是NK细胞增殖和细胞毒性的重要激活剂。PEG IFNα治疗可使HBeAg阴性慢乙肝患者的CD56bright NK细胞显著扩增,并增强其激活标志物、激活受体、TRAIL和IFNγ的表达。早期TRAIL+ CD56bright NK的细胞扩增与肝脏炎症相关,而后期其数量增加则与病毒学应答的峰值一致,表明TRAIL+ CD56bright NK细胞直接参与了IFNα介导的抗病毒作用,其中,TRAIL介导的HBV感染肝细胞凋亡/坏死在IFNα治疗中发挥重要作用。一项针对接受PEG IFNα治疗非活动性HBsAg携带者的研究表明,实现HBsAg血清学转换的患者(应答者)比未实现血清学转换的患者(无应答者)在基线时拥有更高比例的NK细胞,并且NK细胞的数量及活性随着PEG IFNα的治疗有所增加。
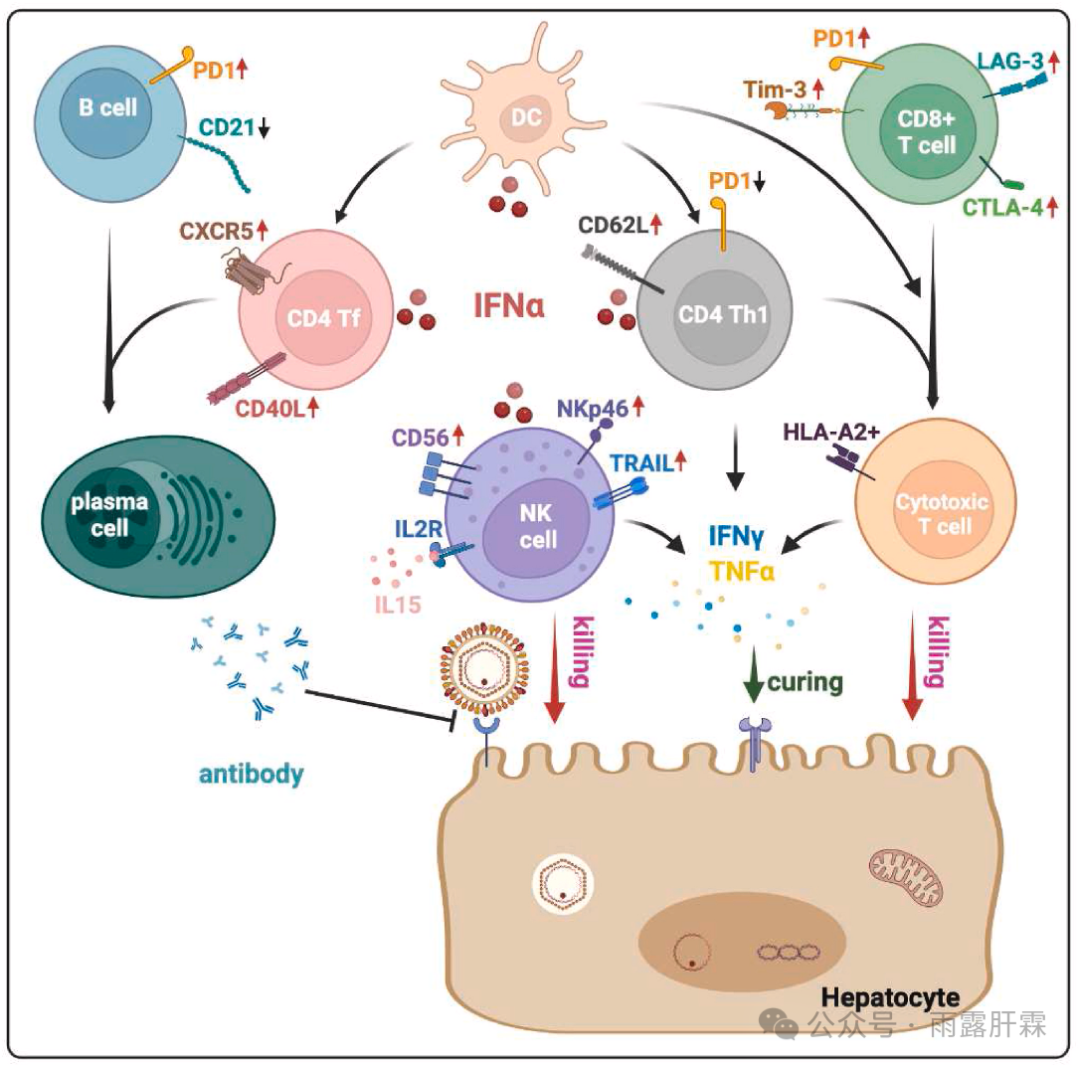
图2 IFNα的免疫调节活性与与慢乙肝的治疗应答相关
3 提高IFNα治疗慢乙肝疗效的潜在方法
3.1 开发具有更强抗病毒和免疫调节活性的IFNα新亚型
IFNα家族包含13个亚型,这些亚型在结构上相似,但在与细胞表面受体IFNAR1和IFNAR2的结合亲和力及其诱导的基因表达和生物学活性上有所不同,不同亚型表现出针对特定病毒的差异化抗病毒活性。研究表明,IFNα14在体外对NK细胞的激活能力最强,因此,开发长效IFNα14及其与其他亚型的组合有望显著提高疗效。
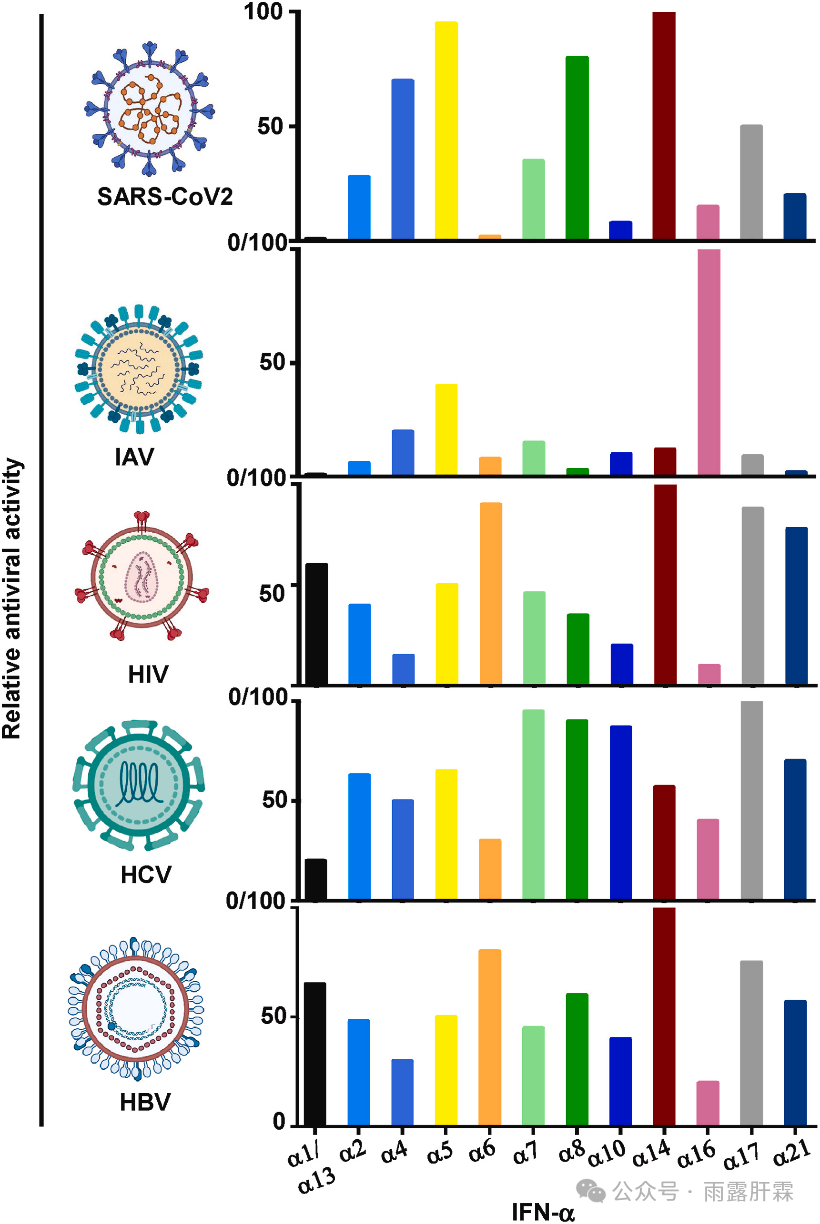
图3 不同亚型的IFNα对HBV、HCV、HIV、甲型流感病毒(IAV)和SARS-CoV-2的不同抗病毒活性
3.2 开发新的长效IFNα制剂
目前临床常用的长效干扰素为PEG IFNα。新型聚合物如POEGMA、PEtOx和聚甘油(LPG)等已被探索用于改善IFNα的生物学活性和药代动力学特性。这些聚合物结合技术以及基因融合技术显示出延长IFNα半衰期和增强抗病毒活性的潜力,有望用于慢乙肝治疗。
3.3 发现和开发小分子I型IFN受体激动剂
IFNα通过激活JAK-STAT信号通路调节众多基因表达,执行其广泛的生物学功能。小分子I型IFN受体激动剂通过与受体特定区域结合,可激活特定的细胞应答,调控较小范围的基因表达,从而具有更专一的抗病毒和免疫调节活性,并减少副作用。小分子激动剂可口服,无需冷链运输,且可避免自然和化学修饰IFNα的药理毒理学问题。随着IFNα和IFNAR结构生物学的进展,小分子IFNAR激动剂有望成为治疗慢性和新发病毒感染的新型抗病毒和免疫调节剂。
3.4 PEG IFNα联合乙肝新药探索
尽管PEG IFNα与NA的联合治疗已在多项研究中证明其有效性,但HBsAg的清除率仍有待进一步提升,以使更多的慢乙肝患者获得临床治愈。PEG IFNα与新型直接抗病毒药物(DAAs)或治疗性疫苗的联合治疗逐渐展示出广阔的应用前景。
①联合HBV衣壳组装调节剂:衣壳组装调节剂(CAMs)通过干扰核心蛋白二聚体的组装,抑制HBV DNA复制。研究表明,CAMs与PEG IFNα联合治疗HBV感染的疗效优于单药治疗,其机制可能是联合用药通过调节CAM诱导的核心蛋白代谢和细胞死亡,从而通过增强抗原交叉呈递,促进HBV感染肝细胞的消除和HBV特异性T细胞的激活。
②联合小干扰RNA(siRNA):靶向肝细胞的siRNA疗法(如VIR-2218)在临床试验中已显示出减少血清HBsAg水平的效果。研究表明,VIR-2218与PEG IFNα的联合疗法能够显著增加慢乙肝临床治愈率,特别是延长治疗时间可显著提升HBsAg清除率和HBsAb的产生。
③联合治疗性疫苗:IFNα作为树突状细胞的强效激活剂,常被用作治疗性疫苗的佐剂。例如,BRII-179疫苗与PEG IFNα联合显著增强了HBV特异性抗体和T细胞应答。
总之,PEG IFNα与新型直接抗病毒药物、治疗性疫苗的联合治疗,通过整合多种抗病毒机制,不仅能够显著提高抗病毒疗效,还能增强宿主免疫应答,为慢乙肝的临床治愈提供了一条新的途径。
肝霖君有话说
本综述系统地总结了IFNα在治疗慢乙肝中的作用机制及其潜在的改进方法,展示了当前研究的前沿进展,有助于启发新的治疗策略开发。越来越多的研究显示PEG IFNα在慢乙肝治疗中发挥的重要作用,基于PEG IFNα的联合治疗方案在各类慢乙肝人群中取得良好疗效,但仍需要进一步提高临床治愈率,以实现更大人群的获益。未来的研究需要进一步探索PEG IFNα与其他治疗手段的协同作用,以及如何优化治疗方案,以助力临床治愈在更广泛的人群中得以实现。
参考文献:
Zhao Q, Liu H, Tang L, et al. Mechanism of interferon alpha therapy for chronic hepatitis B and potential approaches to improve its therapeutic efficacy[J]. Antiviral Research, 2023: 105782.



