【期刊导读】高志良教授团队:PEG-IFNα治疗期间ALT升高有助于慢乙肝患者HBsAg清除的免疫机制探索
时间:2024-07-20 06:02:21 热度:37.1℃ 作者:网络
编者按
中山大学附属第三医院的高志良教授在分析珠峰项目的研究成果时曾多次提到,聚乙二醇干扰素α(PEG-IFNα)治疗12周时ALT升高有利于HBsAg低水平(< 1500 IU/mL)的慢乙肝患者获得HBsAg清除,既往也有相关文献报道,但PEG-IFNα治疗期间ALT升高和HBsAg清除的免疫机制尚不清楚。
近期,高志良教授、林炳亮教授及李晓燕教授团队在Journal of Medical Virology杂志上发表的一项研究,深入探索了相关机制,结果表明在PEG-IFNα治疗期间,以IFN‐γ+ Th1亚群和M1巨噬细胞为代表的Ⅰ型炎症反应与ALT升高和HBsAg清除密切相关,IFN‐γ+ Th1通过诱导M1巨噬细胞极化,激活肝内驻留记忆T细胞(TRM细胞),升高ALT水平,促进HBsAg清除。

研究方法
本研究共纳入82例于2018 - 2020年在中山大学附属第三医院就诊的非肝硬化慢乙肝患者,患者曾接受NAs治疗至少1年,qHBsAg < 1500 IU/mL,获得HBeAg血清学转换,HBV DNA < 20 IU/mL。入组后患者接受NAs(原方案)序贯联合PEG-IFNα治疗< 96周。基线定义为患者接受PEG-IFNα联合NAs治疗开始。在第0周(基线)、12周和24周时收集所有患者的血液样本用于研究分析,每12周随访一次。
患者分为2组:临床治愈组(n = 41):在48周内实现HBsAg清除(HBsAg < 0.05 IU/mL),当患者获得HBsAg清除时,继续接受PEG-IFNα+NAs巩固治疗12 - 24周;未临床治愈组(n = 41):在48周时未获得HBsAg清除。
鉴于PEG‐IFNα治疗期间ALT升高与HBsAg清除相关,本文假设肝内组织驻留记忆T细胞(TRM细胞)可能参与其中,并且以M1巨噬细胞(分泌细胞因子,如白细胞介素[IL]‐12、IL‐18)为代表的Ⅰ型炎症反应可能是TRM激活的关键因素。
研究结果
01 PEG-IFNα联合NAs治疗,临床治愈组在治疗期间的ALT水平显著更高
在82例慢乙肝患者中,临床治愈组基线时的年龄显著更小(P = 0.002),qHBsAg水平显著更低(P < 0.001)。临床治愈组治疗期间的HBsAg水平仍显著低于未临床治愈组(12周: 1.40 vs. 2.71 log10 IU/mL, P12w < 0.001; 24周: -1.27 vs. 2.53 log10 IU/mL, P24w < 0.001)。两组基线时的ALT水平相似,但临床治愈组在治疗期间的ALT水平显著更高(12周: 78 vs. 54 U/L, P12w = 0.002; 24周: 64 vs. 47 U/L, P24w = 0.004)。
02 PEG-IFNα治疗获得HBsAg清除与IFN‐γ+CD4+ T细胞有关
临床治愈组0 - 24周时的IFN‐γ+CD4+ T细胞比例显著高于未临床治愈组,但两组间的肿瘤坏死因子(TNF)‐α+CD4+ T细胞比例相似(图1A),且两组间的TNF‐α+CD8+或IFN‐γ+CD8+ T细胞的比例相似(图1B),提示CD4+ T细胞可能在HBsAg清除中发挥更重要的作用。
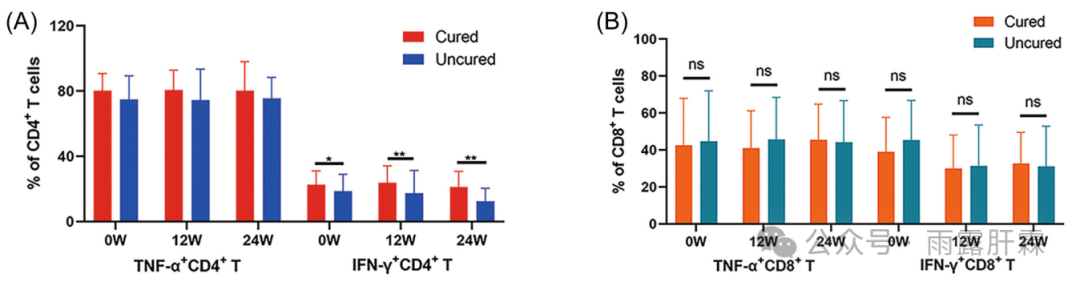
图1 临床治愈组和未临床治愈组IFN‐γ+CD4+ (A)和IFN‐γ+CD8+ (B) T细胞水平的差异
03 IFN-γ+ Th1细胞有利于PEG-IFNα治疗获得HBsAg清除
辅助性T细胞1(Th1细胞)属于 CD4+ T 辅助细胞的一种促炎性细胞亚群,介导Ⅰ型炎症反应。本研究中,临床治愈组0 - 24周时的IFN‐γ+ Th1细胞比例显著高于未临床治愈组(图1F)。临床治愈组中TNF-α+ Th1和IFN-γ+ Th1的细胞比例从0周到24周呈轻度上升趋势(图1G);但未临床治愈组IFN-γ+ Th1细胞的比例呈动态下降趋势,在24周时达到最低,显著低于基线水平(图1H)。临床治愈组的IFN-γ+ Th1细胞比例与治疗期间HBsAg下降和ALT水平呈线性关系(图2A-C)。提示IFN-γ+ Th1细胞与PEG-IFNα治疗后的临床治愈相关。
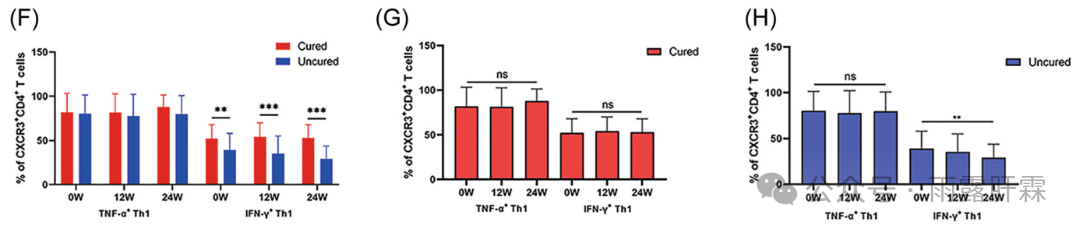
图1 两组间TNF-α+ Th1(F)与IFN-γ+ Th1(H)细胞比例的差异及动态变化
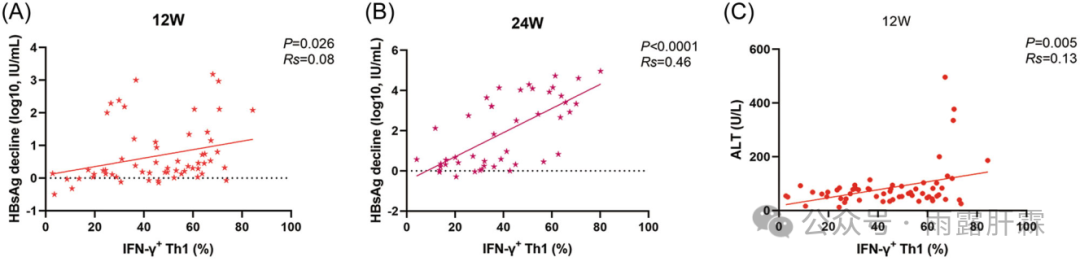
图2 IFN‐γ+ Th1细胞比例与治疗12周(A)和24周(B)的HBsAg下降以及12周时ALT水平(C)的线性关系
04 M1巨噬细胞极化与HBsAg清除相关
以往研究发现,Th1主要通过IFN-γ诱导M0巨噬细胞向M1巨噬细胞极化来发挥其促炎作用。本研究将患者血清与M0巨噬细胞共培养发现,临床治愈组的M1(CD68+CD86+)巨噬细胞的比例显著高于未临床治愈组,但两组间血清诱导的M2(CD68+CD206+)巨噬细胞的比例相似,提示M1巨噬细胞极化在HBsAg清除中发挥重要作用(图3A)。此外,IFNα促进M1细胞极化并轻度抑制M2巨噬细胞极化(图3B)。
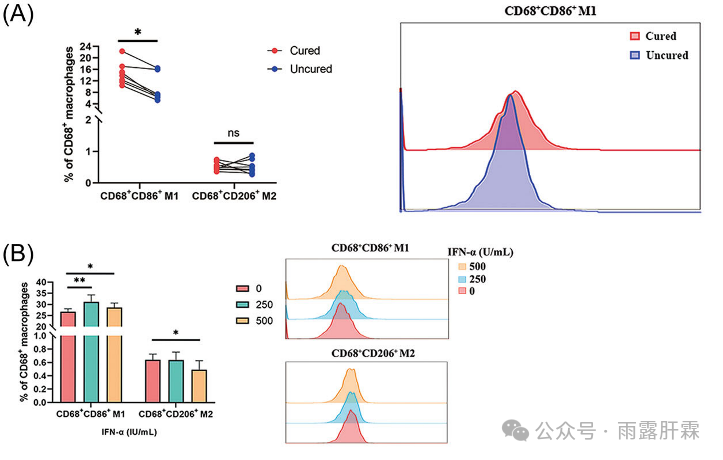
图3 A-B 与未临床治愈组相比,临床治愈组血清中的M1巨噬细胞细胞比例显著更高,而两组的M2巨噬细胞比例相似(A);IFNα促进了M1巨噬细胞细胞的极化,并轻度抑制了M2巨噬细胞的极化(B)
05 M1巨噬细胞通过上调组织驻留记忆T细胞的效应功能促进HBsAg清除
组织驻留记忆T细胞(TRM细胞)在特定组织内持续存在,对相应组织内的病原体监测非常重要,尤其是对于肝脏,通常在T细胞活化后开始表达。本研究将M1和M2巨噬细胞上清液处理过的肝灌注液与HeG2.2.15细胞共培养,结果发现肝内Kupffer细胞的M1极化通过上调ALT水平,促进HBsAg清除(图4F-G)。
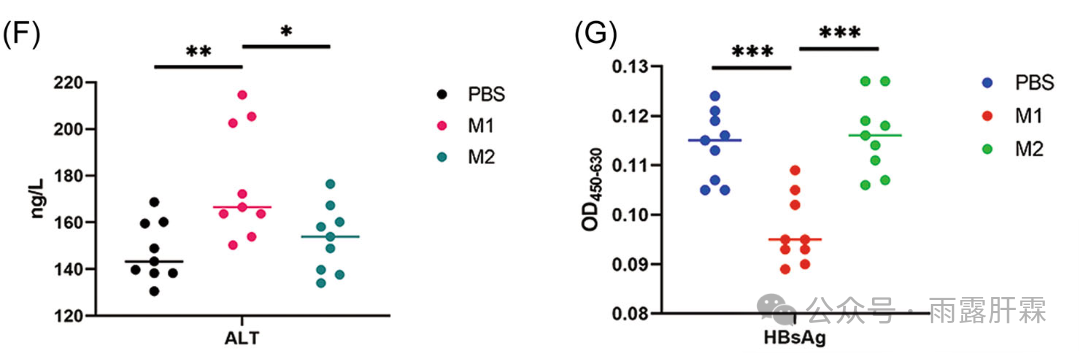
图4 F-G M1和M2巨噬细胞上清液处理的肝灌注液与HeG2.2.15细胞共培养后,细胞中HBsAg(F)和ALT(G)水平的差异
此外,与M2巨噬细胞相比,经M1巨噬细胞上清液处理,增强了肝内TRM细胞的效应功能,其分泌IFN‐γ、TNF‐α、穿孔素和颗粒酶B的能力显著增加(图5F)。表明IFN‐γ+ Th1通过诱导M1巨噬细胞极化激活肝内TRM细胞,促进HBsAg清除。
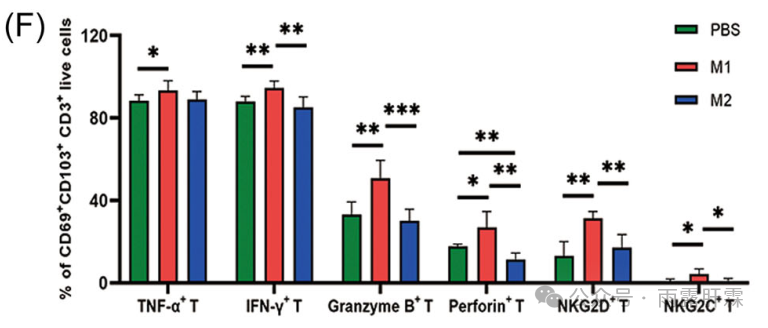
图5F M1和M2巨噬细胞上清液对肝内TRM细胞效应功能的影响
肝霖君有话说
本研究证实,部分HBsAg低水平(< 1500 IU/mL)的NAs经治慢乙肝患者联合PEG-IFNα治疗更易实现临床治愈,其机制主要是通过调节免疫因子实现的,尤其是以Th1细胞和M1巨噬细胞为代表的Ⅰ型炎症反应。
首先IFN-γ+CD4+ T细胞可能有利于接受PEG-IFNα治疗的慢乙肝患者获得HBsAg清除;此外,PEG-IFNα治疗可以上调IFN-γ+ Th1的表达,诱导M1巨噬细胞极化,激活肝内TRM细胞,升高ALT水平,促进HBsAg清除。
值得注意的是,未临床治愈组在治疗过程中的IFN-γ+ Th1细胞比例呈下降趋势,显著低于临床治愈组,或表明未临床治愈组的部分HBV特异性T细胞免疫应答尚未恢复到可以清除病毒的状态,此时使用PEG-IFNα治疗尚不能逆转这种免疫状态,因此选择PEG-IFNα间歇治疗可能更有利于这类患者获得HBsAg清除。
参考文献:
Wu L, Deng H, Feng X, et al. Interferon-gamma(+) Th1 activates intrahepatic resident memory T cells to promote HBsAg loss by inducing M1 macrophage polarization[J]. J Med Virol. 2024, 96(5): e29627.



