Adv Sci:南方医科大学李勇等团队合作揭示了KDM3A作为提高胃癌免疫治疗治疗靶点的作用机理
时间:2024-07-21 12:00:33 热度:37.1℃ 作者:网络
免疫疗法治疗癌症的成功与否受到免疫抑制肿瘤微环境(TME)存在的限制;因此,寻找能够逆转这种免疫抑制性TME并提高免疫治疗效果的新靶点至关重要。
2024年7月19日,南方医科大学李勇、邢帆及南山人民医院侯铁英共同通讯在Advanced Science 在线发表题为“KDM3A Ablation Activates Endogenous Retrovirus Expression to Stimulate Antitumor Immunity in Gastric Cancer”的研究论文,该研究基于公开获取的胃癌患者单细胞和大量RNA测序数据进行富集分析,发现肿瘤内生性干扰素(IFN)在TME调控中发挥核心作用。
结果表明,KDM3A过表达抑制肿瘤内生性IFN反应,抑制KDM3A,通过激活内源性逆转录病毒(ERV)有效促进IFN反应。KDM3A消融通过调节H3K4me2,增强CD8 T细胞的浸润和功能,同时减少调节性T细胞的存在,从而重新配置dsRNA-MAVS-IFN轴,从而在体内重塑TME。此外,抗PD1治疗与抑制KDM3A联合有效抑制肿瘤生长。综上所述,本研究强调KDM3A是通过调节ERV-MAVS-IFN轴调控胃癌TME重塑和增强抗肿瘤免疫的潜在靶点。

在全球所有恶性肿瘤中,胃癌的患病率排名第五,死亡率排名第四。就目前的治疗模式而言,Satoh等人报道曲妥珠单抗加化疗治疗的患者中位总生存期为13.8个月。最近在肿瘤微环境(TME)和免疫治疗方面的进展,如CheckMate-648试验所示,已经证明PD1抑制剂可以提高无进展生存期,并具有可接受的安全性。然而,免疫疗法对某些亚型的疗效有限,如MSS、低PDL1表达或低TMB。肿瘤细胞和免疫细胞之间复杂的相互作用显著影响患者对免疫治疗的应答率。此外,在TME中表现出免疫反应性的患者往往比免疫抑制的患者对免疫治疗的反应更好。因此,比较MSI和非MSI TMEs有助于准确确定逆转非MSI免疫抑制的最佳策略。
表观遗传调节因子已显示出重塑TME和肿瘤与免疫系统之间关系的潜力,这可能最终抑制肿瘤生长并增强对免疫治疗的反应。已有研究表明,表观遗传基因可通过调控内源性逆转录病毒(ERV)激活肿瘤内源性干扰素(IFN)。ERV是在进化过程中保存下来的基因序列,这是由于我们的人类祖先与病毒因子之间长期的相互作用。通过产生双链RNA, ERV模拟外部病毒的分子模式,触发MDA5-MAVS信号通路的激活,随后产生I型IFN,从而提高免疫治疗效果。然而,在胃癌中,ERV调控MAVS-IFN通路并触发肿瘤内源IFN产生的确切机制仍有待阐明。
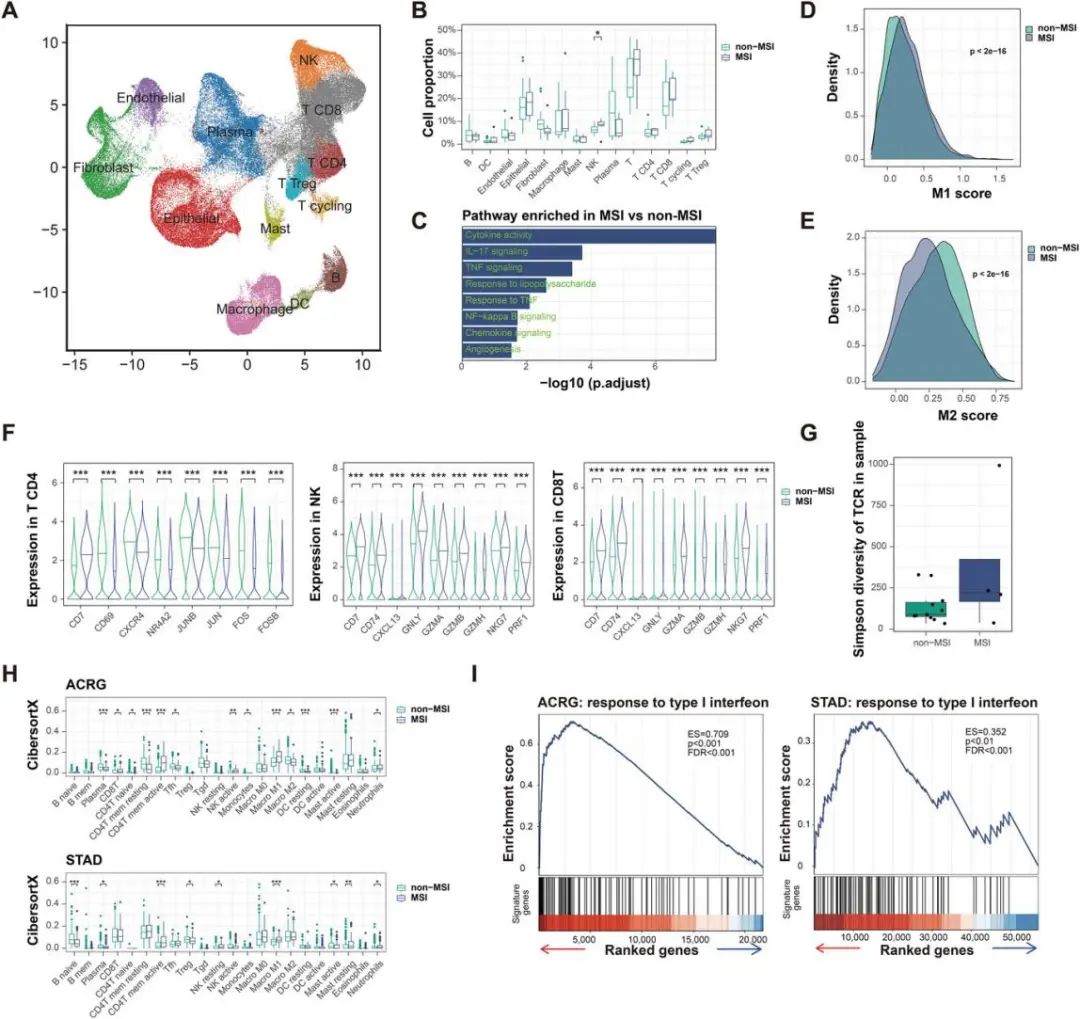
根据单细胞和大量RNA序列分析,肿瘤内源性IFN不足导致非MSI TME(图源自Advanced Science )
KDM3A,也称为Jmjd1a,通过降低组蛋白3赖氨酸9二甲基化(H3K9me2)促进转录激活,在表观遗传修饰中起关键作用。H3K9me2水平升高与较高的肿瘤细胞增殖和侵袭有关。此外,KDM3A调节DCLK1和Wnt/β-catenin信号通路,进而控制肿瘤干性。KDM3A抑制剂IOX1有效下调PD-L1表达,逆转多柔比星诱导的PD-L1高表达,从而增强T细胞依赖性抗肿瘤免疫。在胰腺癌中,KDM3A被确定为通过调节表皮生长因子受体表达的Krueppel样因子5和SMAD家族成员4抑制TME的潜在诱导剂。这些发现表明KDM3A可能作为TME的调节因子和潜在的治疗靶点。然而,其在TME调节机制中的具体作用及其在胃癌中的意义有待进一步研究。
在这项研究中,研究了肿瘤内生性IFN与胃癌非MSI TME之间的相互作用。发现KDM3A的去除激活了ERV的转录,随后触发了MAVS-IFN信号通路。这种免疫非MSI TME的逆转显着提高了免疫治疗效果。总之,本研究强调了KDM3A作为提高胃癌免疫治疗疗效的有希望的治疗靶点的潜力。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202309983


