华南理工边黎明/张琨雨AM:智能活性核壳微凝胶组装体,通过激活力学传导和生化途径加速糖尿病皮肤伤口愈合
时间:2024-07-25 20:00:42 热度:37.1℃ 作者:网络
慢性不愈合皮肤伤口,其特征是在高血糖和缺氧状态下组织收缩力降低和伤口细胞存活受到抑制,这在糖尿病护理中构成了重大挑战。在这里,华南理工大学边黎明/张琨雨介绍了一种先进的自收缩活性核-壳微凝胶组装体,具有强大的组织粘附性(SMART-EXO),以加速糖尿病伤口愈合。SMART-EXO敷料由于丰富的氢键和动态配位键,展现出对受损组织的强大、可逆的粘附性。此外,核-壳微凝胶组件和动态配位键提供了适中的刚性、可定制的自收缩能力以及相互连接的多孔结构。SMART-EXO敷料触发的原位自收缩能力能够激活、可调节的伤口收缩,激活皮肤中的机械转导,并促进最佳的成纤维细胞向肌成纤维细胞的转化、胶原蛋白合成和血管生成。同时,SMART-EXO的触发收缩有助于高效装载和按需释放生物活性外泌体,有助于糖尿病小鼠的再上皮化和伤口微环境调节。RNA测序结果显示,与机械感知和外泌体调节相关的关键信号通路被激活,突出了结合生物力学和生化机制的综合作用。这些发现强调了SMART-EXO作为一种多功能、适应性强的解决方案,应对糖尿病伤口护理中的复杂挑战。该研究以题为“In Situ Triggered Self-Contraction Bioactive Microgel Assembly Accelerates Diabetic Skin Wound Healing by Activating Mechanotransduction and Biochemical Pathway”的论文发表在《Advanced Materials》上。

图1展示了微凝胶的制备过程、结构特征以及自组装形成自收缩微凝胶组装体(SMA)的过程。通过改进的沉淀聚合法制备了NIPAM-co-AAC微凝胶,并通过透射电子显微镜(TEM)图像显示了微凝胶的核-壳结构。动态光散射(DLS)测量显示微凝胶的水动力直径为1.83微米,且随着温度升高,微凝胶尺寸减小,当环境温度达到约37°C的低临界溶液温度(LCST)时,尺寸明显减小。微凝胶通过添加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(EDC)自组装形成SMA,并通过共聚焦激光扫描显微镜(CLSM)图像显示了从单分散微凝胶逐渐聚集形成数十微米尺度的结构,最终形成大尺寸的微凝胶组装体。进一步引入聚丙烯酸(PAA)和Ca2+形成的次级网络,生成具有强组织粘附性的SMA(SMART)。通过傅里叶变换红外光谱仪(FT-IR)和流变学分析,SMART显示出比SMA更高的存储模量(G'),表明其具有更强的机械性能和可调节的机械特性。此外,SMART还表现出优异的剪切变稀和自愈合特性。这些发现表明,SMART具有快速的温度响应和对伤口机械收缩的可编程编辑能力。
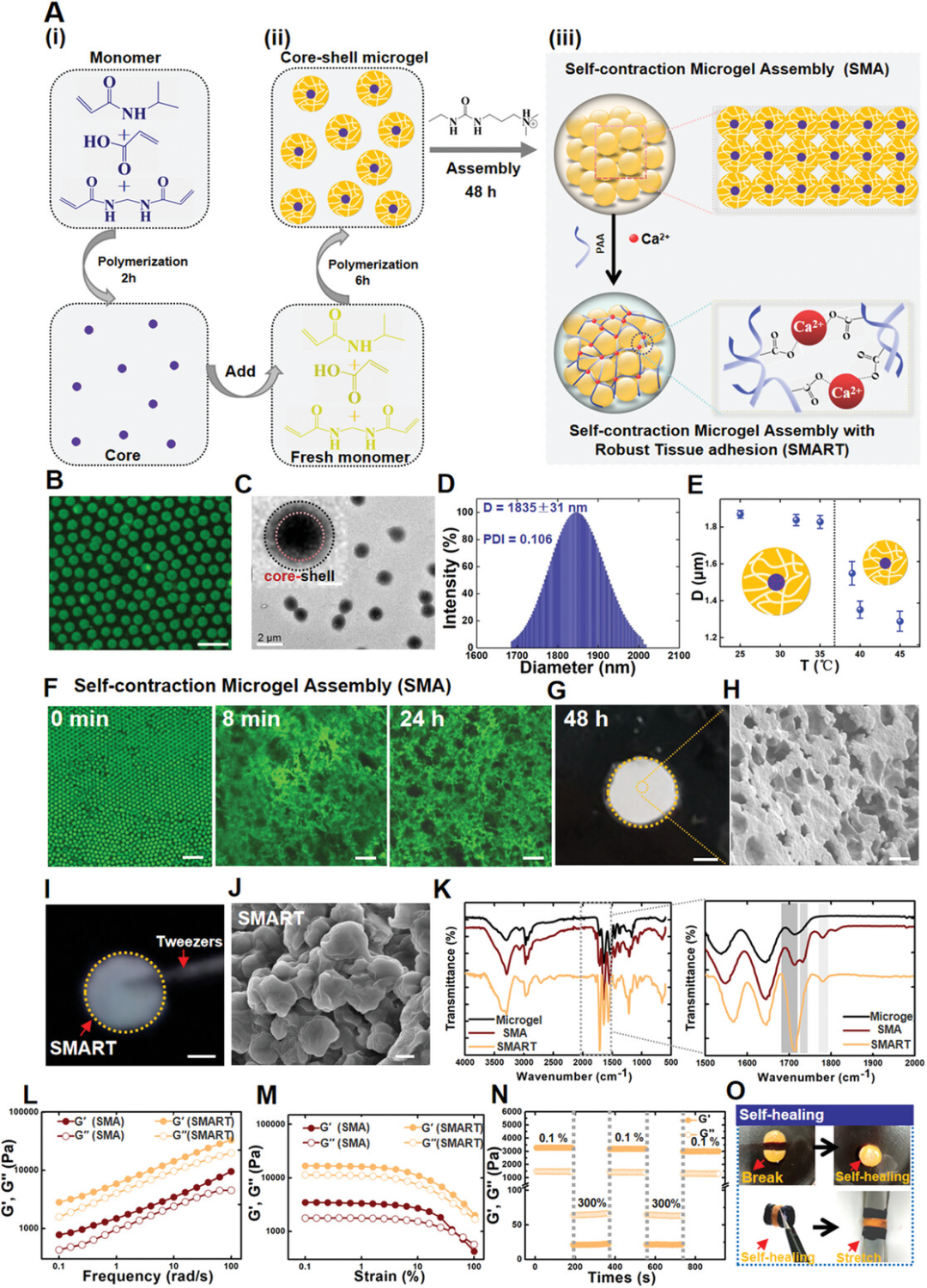
图1. 微凝胶组装导致SMART形成,展现出卓越的机械性能
【温度响应性SMART实现外泌体的即时装载与持续释放】
图2展示了SMART-EXO敷料的自收缩特性及其对外泌体的装载和释放能力。SMART-EXO敷料在接近正常体温(37°C)时会立即发生自收缩,导致其直径显著减小,表现出对湿损伤组织的即时自收缩响应。通过调整交联点(COOH-Ca2+)的密度,可以精细调控自收缩的程度。在低于SMART的低临界溶液温度(LCST)时,SMART-EXO通过与水形成的氢键促进了外泌体的有效装载。当温度超过LCST时,氢键的破坏导致SMART-EXO收缩并释放装载的外泌体。通过共聚焦激光扫描显微镜(CLSM)图像证实了荧光标记的外泌体在SMART-EXO中成功装载并均匀分布,且在37°C下超过90%的外泌体在最初3天内持续释放。此外,SMART-EXO的机械性能与装载外泌体后的SMART-EXO相似,显示出剪切变稀的特性。这些结果表明,SMART-EXO敷料通过其固有的自收缩特性,能够有效装载并实现干细胞衍生外泌体的持续释放。
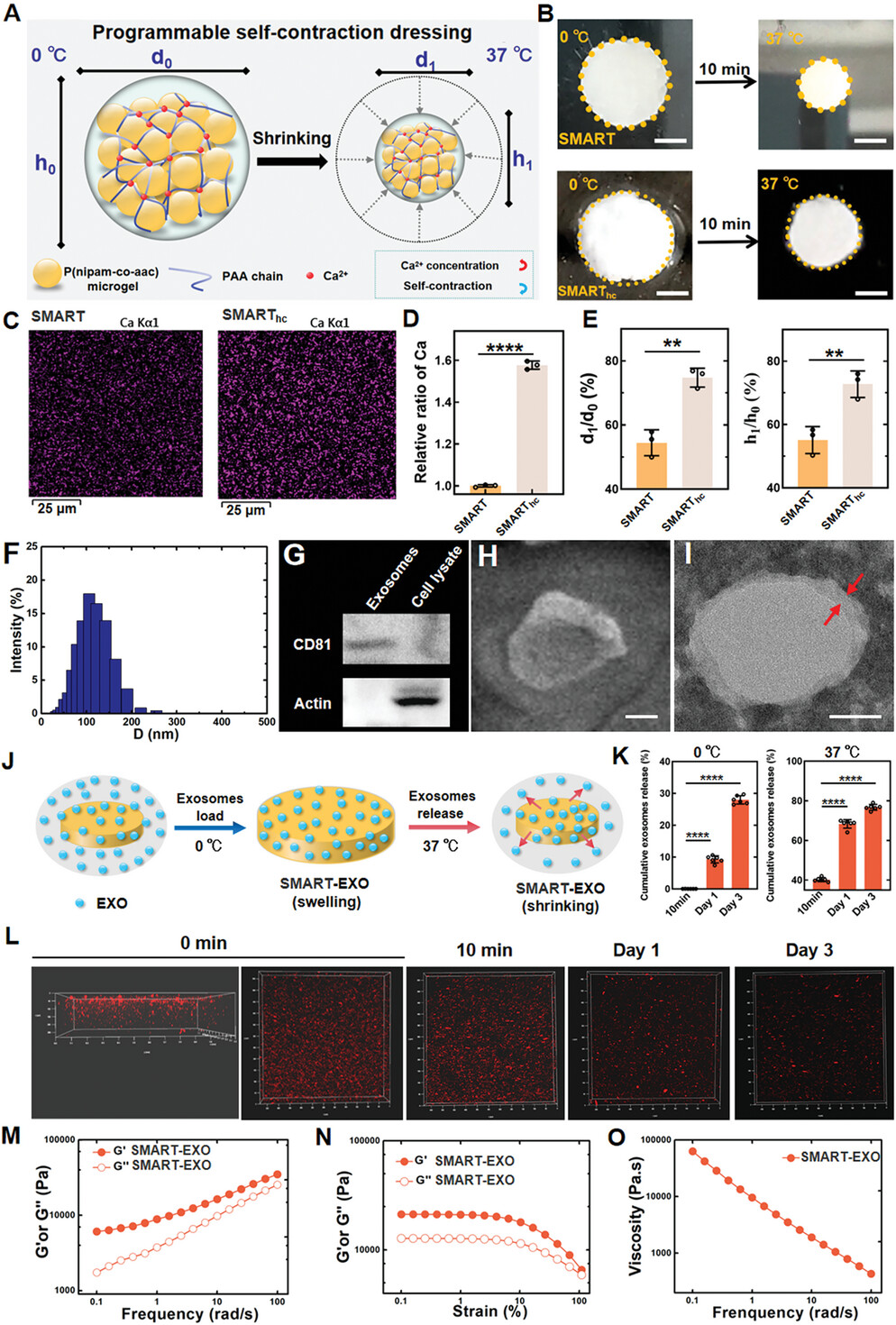
图2. 温度响应性SMART实现外泌体的即时装载与持续释放
【MART-EXO展示优异的粘附性、触发式脱离及编程化自收缩以增强伤口闭合】
图3展示了SMART-EXO敷料的卓越粘附性、可触发的脱离性和可编程的自收缩性,这些特性共同促进了皮肤伤口的闭合。SMART-EXO敷料在接触湿润和受损的组织时,能够迅速且牢固地通过形成氢键与皮肤组织中的胺基结合,实现稳定的粘附。这种敷料在猪皮、鸡皮和受损的猪肠等不同动物组织上均表现出强大的粘附能力,即使在扭曲、弯曲或在PBS中浸泡12小时后仍能保持粘附。特别地,SMART-EXO敷料在接触模拟肠液的损伤猪肠表面时,能够通过原位触发的自收缩有效封闭伤口。此外,SMART-EXO敷料在猪皮上的剪切强度和伤口闭合强度均超过56 kPa和1.5 N,平均界面韧性达到81 J m−2,显示出其在伤口闭合中的强大机械性能。通过喷洒生物相容的碳酸氢钠溶液,可以显著降低界面韧性,从而实现敷料的容易且无创移除。在体外实验中,SMART-EXO敷料在糖尿病小鼠皮肤上的应用能够立即缩小伤口尺寸,减少伤口直径。
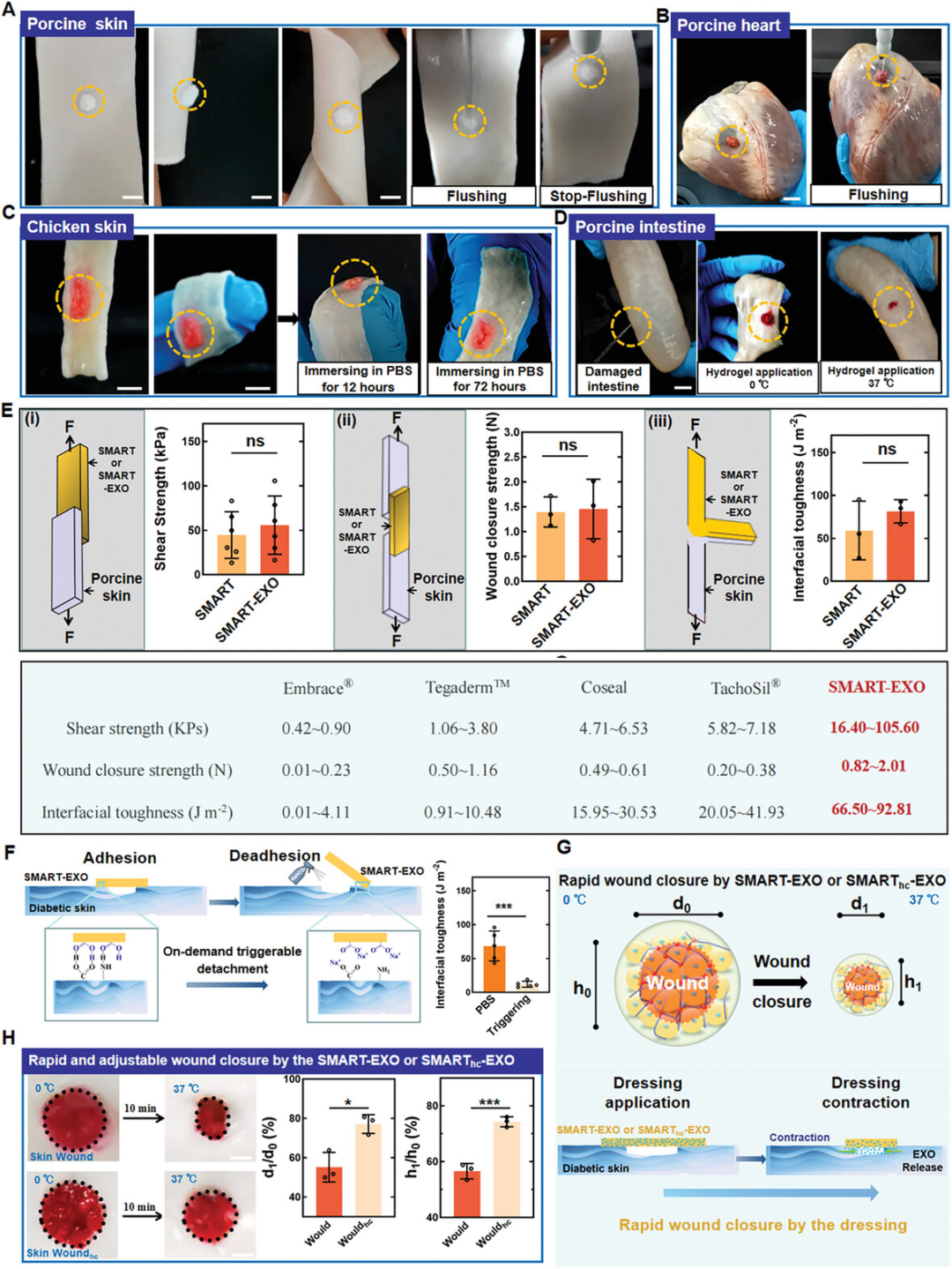
图3. MART-EXO展示优异的粘附性、触发式脱离及编程化自收缩以增强伤口闭合
【SMART-EXO在db/db糖尿病小鼠模型中促进伤口愈合】
图4展示了SMART-EXO敷料在加速糖尿病小鼠伤口愈合方面的显著效果。通过在II型糖尿病小鼠模型上进行全层切除伤口的实验,研究者评估了SMART和SMART-EXO敷料的治疗功效。实验结果显示,SMART-EXO处理的伤口在所有组中显示出最快的闭合率,到第16天时,伤口大小仅为原始大小的8.3%±3.20%。通过苏木精-伊红染色评估,SMART-EXO处理的伤口在第8天时表皮厚度显著高于其他组,表明其在伤口愈合的早期阶段促进了表皮的再生。此外,通过Masson三色染色观察到,SMART-EXO组的胶原蛋白沉积更为有序,显示出成熟胶原束的存在。免疫荧光分析还显示,SMART-EXO组在伤口愈合过程中CD31(血管内皮标记)和α-SMA+(肌成纤维细胞标记)的表达显著高于其他组,表明SMART-EXO通过机械收缩和外泌体释放促进了血管生成和肌成纤维细胞的再生。这些结果表明,SMART-EXO敷料通过结合生物力学和生化信号,显著加速了糖尿病小鼠皮肤的伤口愈合过程。
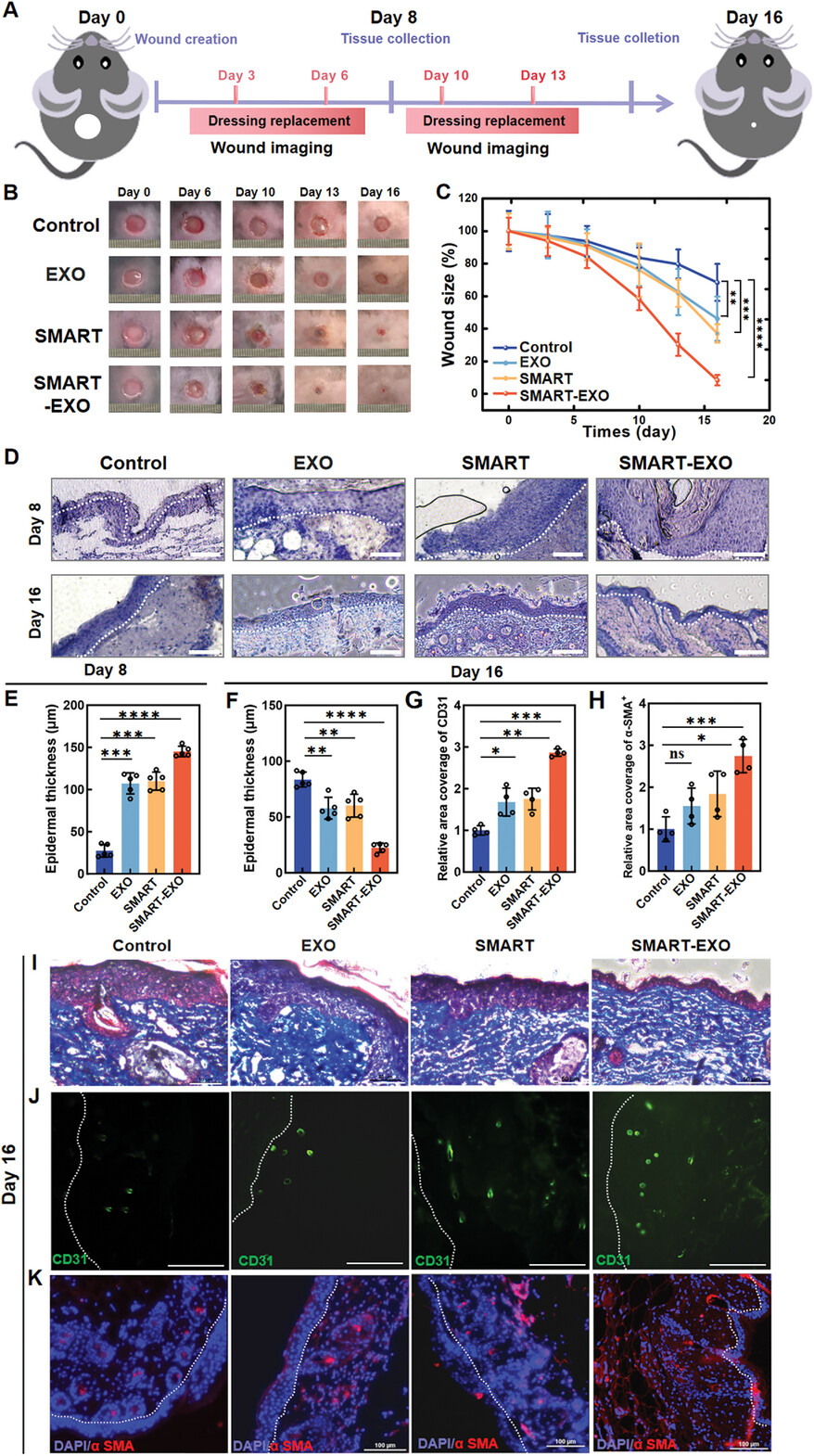
图4. SMART-EXO在db/db糖尿病小鼠模型中促进伤口愈合
【SMART-EXO通过促进细胞迁移、增殖、血管生成和再上皮化加速糖尿病皮肤伤口愈合】
图5探讨了SMART-EXO敷料如何通过促进细胞迁移、增殖、血管生成和再上皮化来加速糖尿病皮肤伤口的愈合。通过西方印迹分析,与SMART组相比,SMART-EXO组在伤口愈合第16天时,观察到p-PI3K、p-RAF、p-AKT和p-Erk1/2等蛋白的显著上调,表明外泌体可能激活了PI3K/AKT和MAPK/Erk信号通路。主成分分析(PCA)和火山图显示了对照组、SMART组和SMART-EXO组之间的转录组差异,SMART-EXO组与SMART组相比,在信号通路反应、细胞增殖、血管生成和炎症调节方面有显著的基因表达差异。基因本体(GO)分析进一步揭示了SMART-EXO组在肌肉收缩的正向调节、肌动蛋白骨架重组、平滑肌组织发展、上皮细胞迁移、血管内皮细胞迁移和血管生成等方面富集的基因,与SMART组相比有显著差异。这些结果共同强调了SMART-EXO敷料通过机械和生化调控促进糖尿病小鼠皮肤伤口愈合的潜力,包括细胞迁移、增殖、血管生成和再上皮化等多个修复过程。
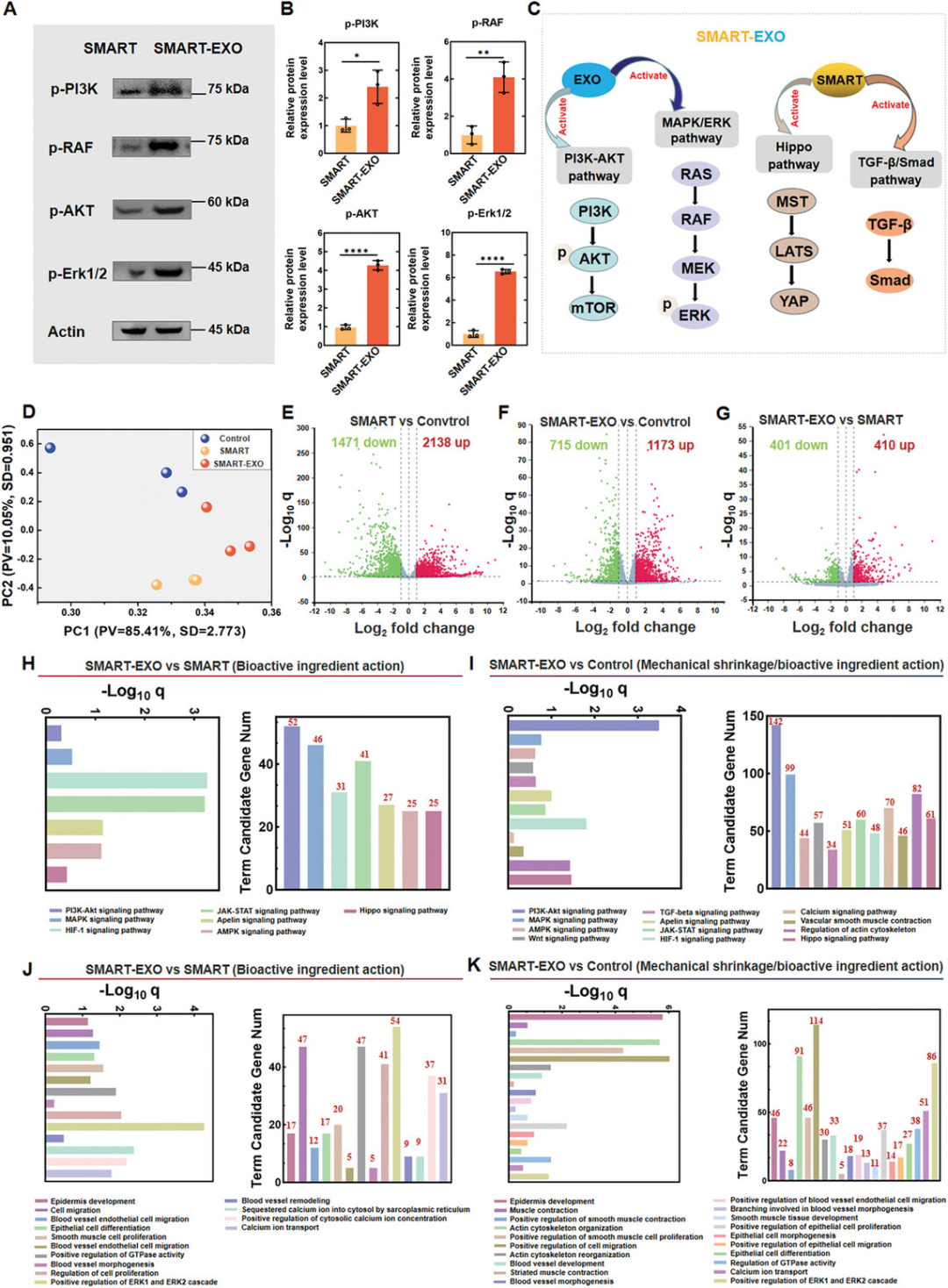
图5. SMART-EXO通过促进细胞迁移、增殖、血管生成和再上皮化加速糖尿病皮肤伤口愈合
【SMART-EXO加速伤口愈合的机制】
图6阐释了SMART-EXO如何通过结合生物力学和生化信号来促进伤口的修复过程。具体来说,SMART-EXO敷料通过提供可控的机械收缩和持续释放的外泌体,激活了皮肤中的力学转导,促进了细胞增殖、血管生成和再上皮化等关键的伤口愈合步骤。这些生物活性外泌体携带的生物分子可能对伤口床的细胞行为和组织重塑产生了积极的影响,从而加速了糖尿病伤口的愈合。此外,SMART-EXO敷料的可编程自收缩特性使其能够根据伤口的具体情况调节收缩力度,以适应不同阶段的伤口愈合需求。通过这种方式,SMART-EXO敷料不仅提供了必要的力学支持,还通过释放的外泌体中的生物活性分子促进了伤口愈合相关的细胞信号通路的激活,从而实现了对复杂糖尿病伤口的有效治疗。
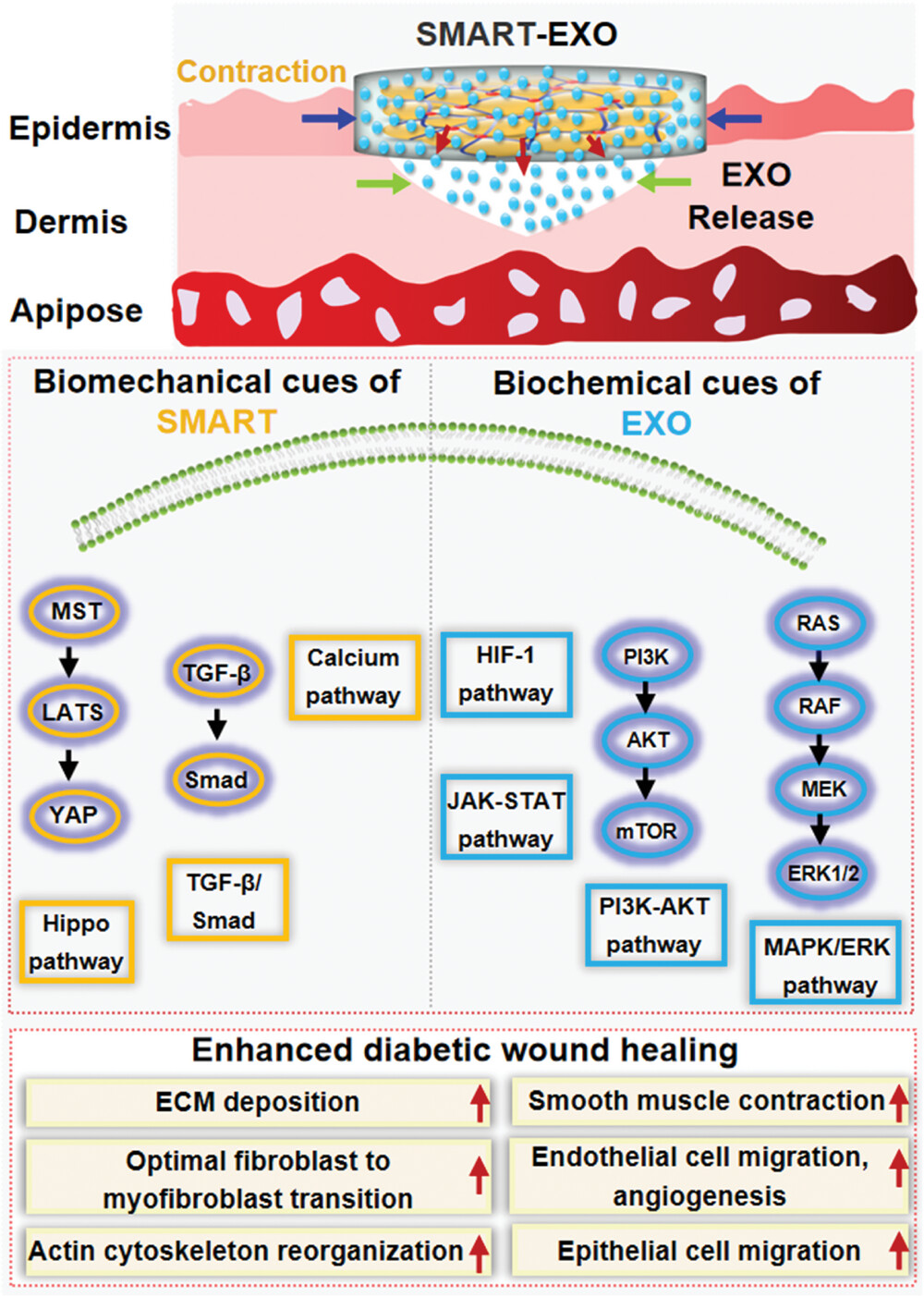
图6. SMART-EXO加速伤口愈合的机制
【小结】
该研究开发了一种多功能的生物活性核-壳微凝胶组装体(SMART-EXO),通过将间充质干细胞衍生的外泌体整合到自收缩的核-壳微凝胶组装体中。SMART-EXO展现出可逆的湿生物粘附性,其粘附性优于现有的多种产品,如医疗敷料、透明敷料、手术密封剂和手术补丁,允许容易且无创伤的移除。体外实验表明,通过可调节的自收缩和持续的外泌体释放,SMART-EXO具有促进伤口愈合的潜力。在II型糖尿病小鼠模型中,SMART-EXO显著加速了伤口闭合,通过激活皮肤中的机械转导并调节与细胞增殖、血管生成和肌肉收缩相关的关键信号通路。该系统在皮肤伤口护理的临床应用中具有巨大潜力,特别是对于慢性糖尿病伤口,并可能扩展到各种受损组织中的紧急止血。
原文链接:
https://doi.org/10.1002/adma.202406434


