Nature子刊:中国药科大学李斯文/顾月清团队开发双特异性骨髓靶向纳米系统CSF@E-Hn,兼具治疗和预防双重作用
时间:2024-07-29 14:00:42 热度:37.1℃ 作者:网络
大多数血液恶性肿瘤是由骨髓(BM)中肿瘤细胞不受控制的克隆增殖引起的,具有较高死亡率与复发率。其中,急性髓细胞性白血病(AML)和多发性骨髓瘤(MM)是两种主要的血液恶性肿瘤类型。尽管现有治疗手段如化疗、免疫疗法与细胞疗法等,在延长患者的总生存期方面显现出前景,但其在充分消除骨髓中恶性细胞、减轻伴随非肿瘤毒性作用以及有效预防疾病复发等方面仍存在挑战。
由于缺乏可靠的体内骨髓靶向技术,针对骨髓中肿瘤细胞的治疗策略十分少见;源自造血干细胞(HSCs)的纳米囊泡(Hn)因含有与母细胞相同的细胞特性,并具有载药双层结构、较小的体积和较低的免疫原性,被认为是理想的骨髓靶向载体。自然杀伤细胞(NK)在BM中成熟并聚集,是具有直接攻击癌细胞能力的潜在抗癌剂,但在实际应用中其捕获和杀伤性往往降低。因此,目前亟需制定一种治疗策略,在实现NK细胞激活的同时追踪肿瘤细胞。
近日,中国药科大学李斯文/顾月清团队在Nature Nanotechnology上发表了题为“A bispecific nanosystem activates endogenous natural killer cells in the bone marrow for haematologic malignancies therapy”的文章。研究团队成功构建了一个称为“CSF@E-Hn”的骨髓靶向纳米系统,该系统基于HSCs来源Hn,在其表面修饰了NK细胞激活配体(aNKG2D)和肿瘤相关抗体(aPD-L1),并在其中包封了集落刺激因子(CSF),可用于治疗血液系统恶性肿瘤。CSF@E-Hn以BM为靶点,通过抓取配体将肿瘤细胞与NK细胞聚集在一起,激活后者以靶向和消除特异性肿瘤细胞;CSF被封装在Hn内可调节BM微环境并抑制肿瘤的扩散和复发。
在罹患AML和MM的小鼠模型中,CSF@E-Hn表现出优异的治疗效果。治疗后BM微环境的综合评估显示,将CSF纳入骨髓靶向纳米系统可促进HSCs分化和记忆T细胞生成,维持骨平衡,并长期预防复发。综上,CSF@E-Hn是一种颇具应用前景的血液恶性肿瘤治疗策略。

文章发表在Nature Nanotechnology
主要研究内容
01 CSF@E-Hn的构造原理与工作特点
CSF@E-Hn制备过程如图1a所示,研究团队首先对C57BL/6J和Balb/c小鼠进行处理,从中提取HSC和NK细胞,其中,HSC细胞表型为C-Kit+CD34-CD38+;随后,利用上述HSC细胞通过连续挤膜的方法制备Hn或CSF@Hn;最后,采用链亲和素方法,最大限度地将NKG2D和PD-L1附着到CSF@Hn上,从而产生CSF@E-Hn。Hn与HSC细胞的蛋白质表达谱具有可比性,尤其是归巢受体的表达。
在磷酸盐缓冲盐水(PBS)和血清中,该纳米系统显示出稳定的粒径分布;在14天的时间内,以及在-80°C低温保存和随后的解冻期间,CSF@E-Hn也表现出卓越的稳定性。
研究团队通过在HT22细胞系和L02细胞系中进行Western Blot与NKG2D/PD-L1表达定量分析,评估其作为NK、C1498细胞特异性捕获靶标的适用性。与阴性对照组相比,CSF@E-Hn在体外捕获NKG2D或PD-L1的同时,对NK、C1498细胞也表现出良好的特异性和亲和力。在混合细胞培养基中,CSF@E-Hn也有效地将NK和C1498细胞聚集。上述结果表明,CSF@E-Hn对C1498和NK细胞具有抓取效应。
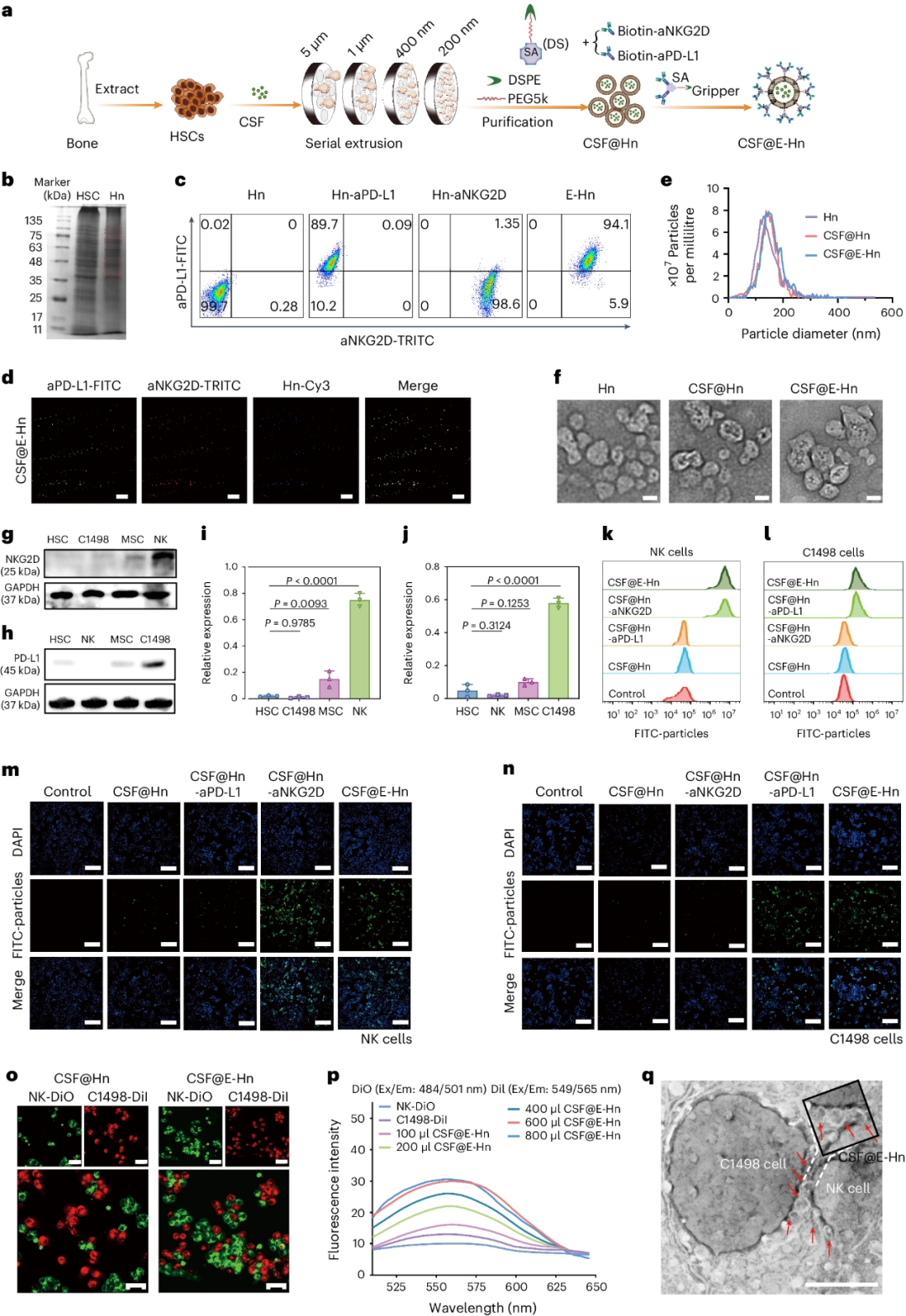
图1.CSF@E-Hn的制备、表型及捕获效果
02 CSF@E-Hn激活NK细胞的细胞毒性作用
研究团队将各种Hn与C1498、NK细胞混合培养(图2)。与其他细胞相比,E-Hn组与CSF@E-Hn组的C1498细胞数量在12 h后显著减少,该趋势得到生物发光成像(BLI)与CCK-8细胞增殖测定实验验证;CSF@E-Hn处理的混合细胞培养基显示,NK细胞的脱颗粒和活化程度显著提高。此外,CSF@E-Hn还显著刺激了NK细胞产生肿瘤坏死因子α(TNF-α)和干扰素γ(IFN-γ)炎症因子。上述结果表明,用CSF@E-Hn激活NK细胞可有效抑制肿瘤细胞增殖,这些被激活的NK细胞不会靶向正常细胞。
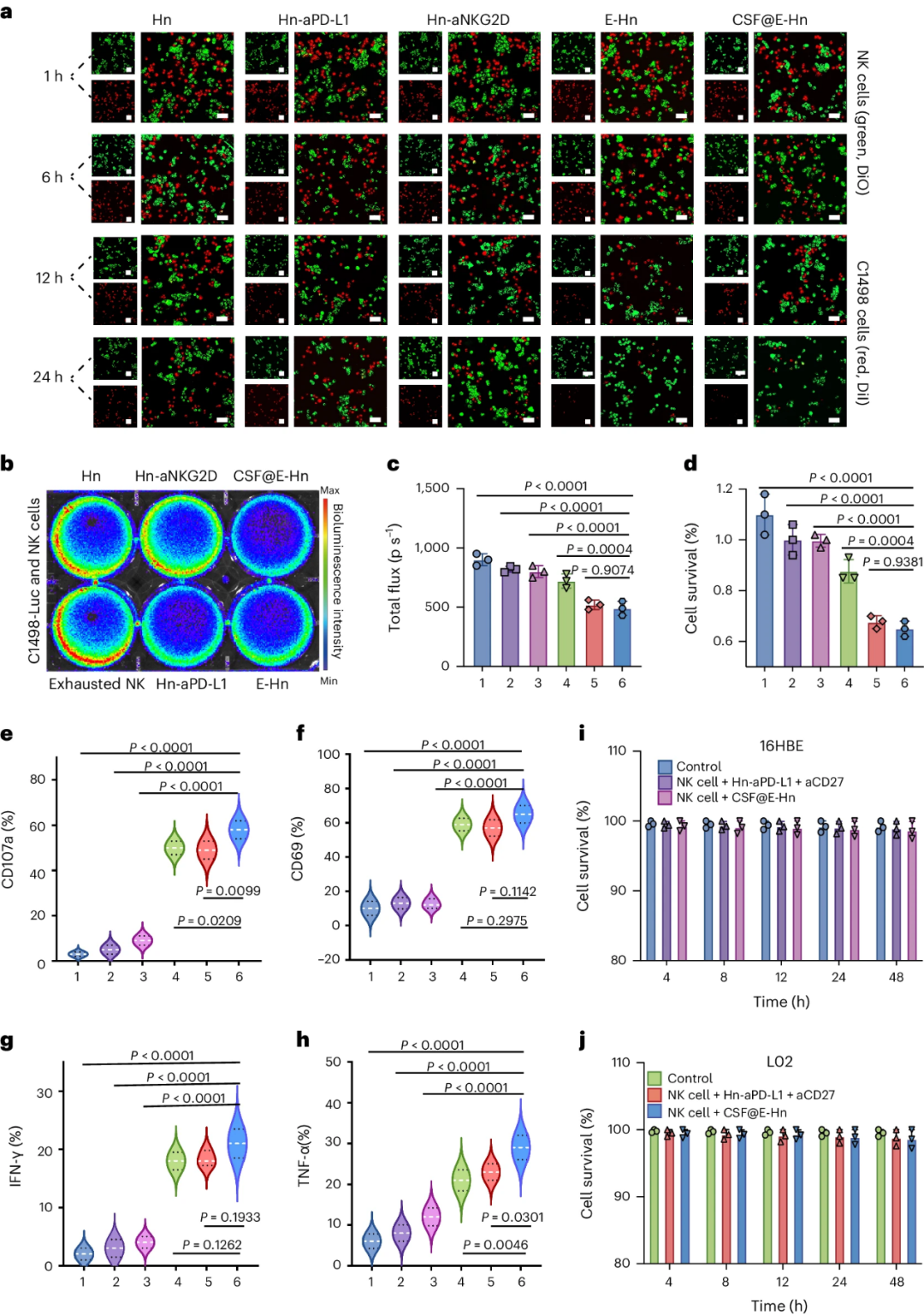
图2.在癌细胞系与正常细胞系上评估CSF@E-Hn对NK细胞的激活能力
为评估CSF@E-Hn纳米系统的BM归巢能力,研究团队对小鼠进行不同注射,荧光强度保持一致(图3)。结果显示,CSF@E-Hn的股骨特异性信号在注射5 h后出现,8 h后达到峰值。解剖骨组织的荧光信号显示,与HSCs相比,Hn和CSF@E-Hn组的荧光强度明显更强。特别地,CSF@E-Hn的血液循环时间更长,其H&E染色未发现任何明显的病理变化。
研究团队还评估了CSF@E-Hn的生物安全性,发现以不同浓度Hn和CSF@E-Hn共同培养的所有受测细胞的存活率均超85%。受试小鼠血常规和生化分析显示,所有测量参数都在正常范围内,表明CSF@E-Hn在体内没有诱发明显毒性。急性毒性试验也证明了该纳米系统的安全性。
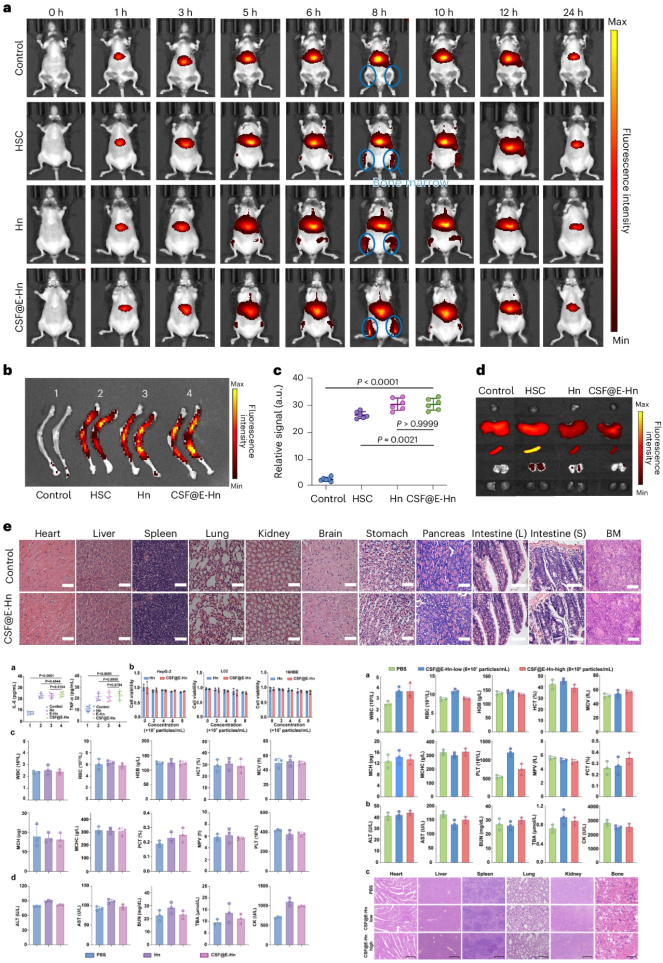
图3.CSF@E-Hn体内生物分布及骨髓靶向性研究
03 CSF@E-Hn的抗AML效用和长期免疫作用
研究团队构建了C1498荷瘤小鼠模型以评估CSF@E-Hn的治疗效果(图4)。结果显示,与其他治疗组相比,经CSF@E-Hn治疗的小鼠表现出更强、更有效的肿瘤细胞清除能力,80天后小鼠的存活率约为87.5%。CSF@E-Hn治疗的小鼠中,外周血、BM和脾脏中的白血病细胞被明显抑制。上述结果证明了CSF@E-Hn在抗AML方面的强大潜力。BM微环境的分析显示,CSF@E-Hn在增加造血细胞、树突状细胞和巨噬细胞,以及调节BM免疫环境方面表现出很强的能力,表明CSF@E-Hn可能对BM功能产生积极影响,并有助于造血功能的恢复。
值得注意的是,在使用E-Hn和CSF@E-Hn治疗后,最初接种的癌细胞在受影响小鼠体内被完全清除,为此,研究团队通过向原发肿瘤被CSF@E-Hn消除的小鼠以及6只新对照组小鼠注射C1498细胞,引入了第二波肿瘤细胞。结果显示,未经治疗的小鼠中白血病细胞生长迅速,而CSF@E-Hn治疗的小鼠则有效控制了白血病细胞生长;在60天观察期内,经CSF@E-Hn治疗的小鼠存活率高达83.3%。
为阐明CSF@E-Hn预防复发的潜在机制,研究团队比较了不同治疗组BM中祖细胞的数量。结果显示,CSF的加入明显增加了祖细胞的数量,这表明CSF@E-Hn具有促进HSCs分化的潜力。与其他组相比,CSF@E-Hn组的CD3+CD8+ T 细胞(CTL)增加了约1.8-2.1倍;次级淋巴组织中CD44+CD62L+中央记忆T细胞(TCM)和骨髓中CD44+CD62L−效应记忆T细胞(TEM)的百分比更高。此外,相较其他组,CSF@E-Hn治疗组的破骨细胞减少,成骨细胞增加。
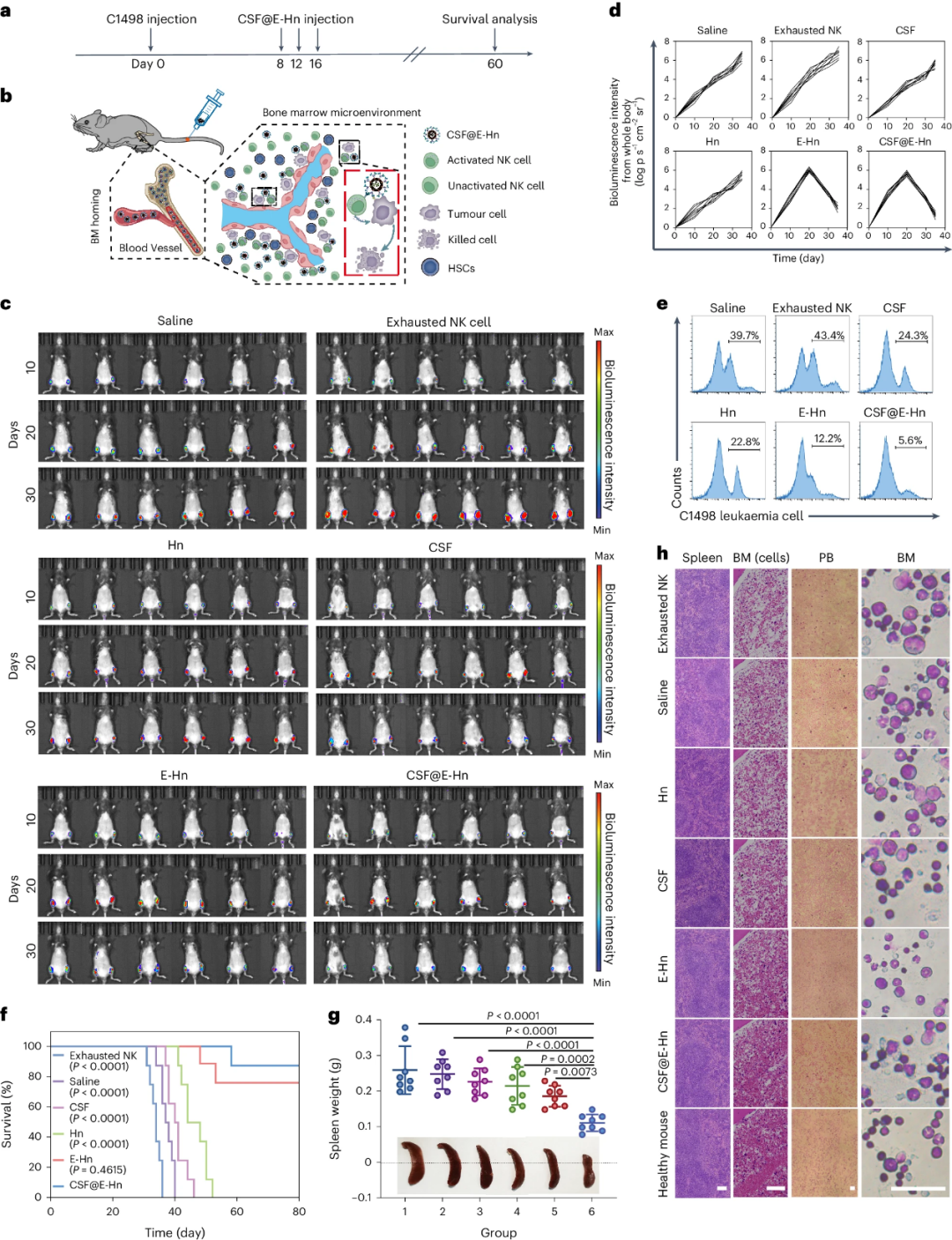
图4.CSF@E-Hn体内抗AML效果
04 CSF@E-Hn的抗MM效用
通过密切监测治疗后的小鼠,研究团队评估了CSF@E-Hn治疗MM的效用(图5)。结果显示,CSF@E-Hn组外周血、BM和脾脏中MM细胞的百分比显著降低,Kappa浓度升幅也最小,表明其能有效抑制骨髓瘤细胞。CSF@E-Hn治疗延长了小鼠的寿命,75%经治疗的小鼠在第60天时仍存活;CSF@E-Hn处理诱导的NK细胞的活化程度也明显增强。
在抗MM试验中,研究团队同样对小鼠进行了二次肿瘤细胞注射。结果显示,CSF@E-Hn治疗的小鼠在第30天时骨髓瘤仍处于低水平,有4只(n=6)存活了60天。CSF@E-Hn治疗小鼠继发性肿瘤中祖细胞、CTL、TCM和TEM细胞的百分比显著增加。此外,骨组织的组织学染色显示,经CSF@E-Hn治疗后成骨细胞急剧增加,破骨细胞急剧下降。综上,CSF@E-Hn在治疗AML和MM的疗效凸显了其在治疗更广泛血液恶性肿瘤方面的巨大潜力。
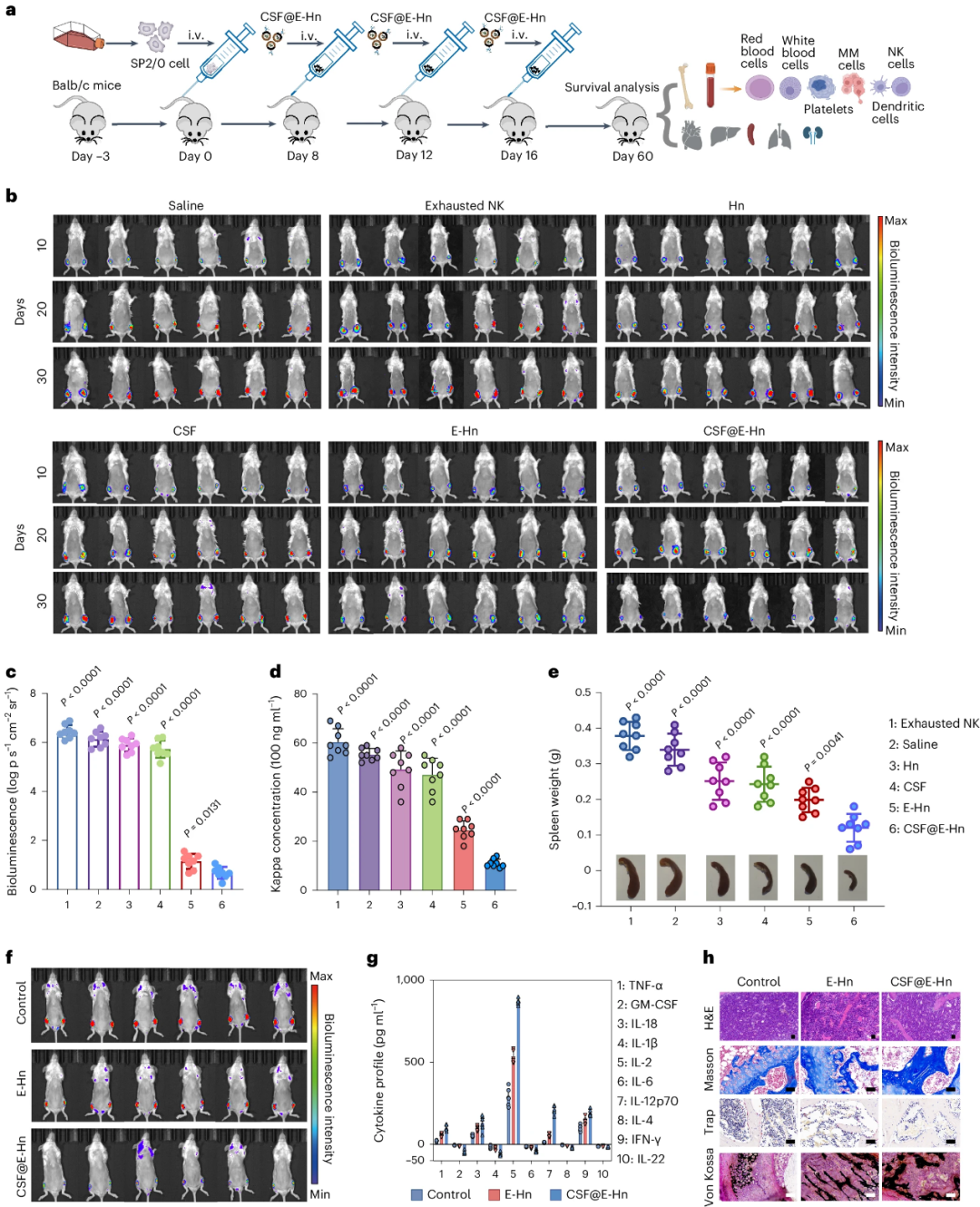
图5.CSF@E-Hn体内抗MM效果
综上所述,研究团队构建了一种双特异性纳米囊泡载药系统,具有CSF包载和双配体(aPD-L1和aNKG2D)修饰,可实现对BM内NK细胞和肿瘤细胞的双特异性捕获,在激活NK细胞的同时阻断肿瘤细胞对NK细胞的抑制作用,从而促使NK细胞快速发挥肿瘤细胞杀伤效应。CSF@E-Hn表现出强大的抗AML与抗MM潜力,还能有效地抑制肿瘤复发,兼具治疗和预防的双重作用,在血液恶性肿瘤预治中具有临床应用前景。
论文原文:
Zhang, Y., Deng, Y., Zhai, Y. et al. A bispecific nanosystem activates endogenous natural killer cells in the bone marrow for haematologic malignancies therapy. Nat. Nanotechnol. (2024). https://doi.org/10.1038/s41565-024-01736-9
https://www.nature.com/articles/s41565-024-01736-9


