唐本忠院士团队ACS Nano:刺激响应性水凝胶增强光热疗法,对抗癌症干细胞诱导的乳腺癌转移
时间:2024-08-01 18:00:29 热度:37.1℃ 作者:网络
癌症干细胞(CSCs)的自我更新和分化特性可导致癌症的化疗耐药性。尽管已经开发了许多针对CSCs的药物,但它们在病灶部位的递送和积聚效率始终比较低下,限制了药物的作用。
在此,香港中文大学唐本忠教授、广西医科大学宁峙彭教授、广州医科大学张天富副教授等人通过将聚集诱导发射(AIE)活性光热剂和硫利达嗪(THZ)包封在一起,开发了一种热响应性水凝胶,证明了由AIE剂触发的可控递送系统可以增强THZ介导的CSC消融。在近红外激光刺激下,AIE试剂的光热效应诱导水凝胶变形,从而释放药物。水凝胶的精确原位肿瘤给药加速了药物在癌症深层病变中的扩散和积聚。因此,THZ可以通过多巴胺受体阻断和氧化应激诱导侵入肿瘤并引发大量CSC凋亡。因此,在患有癌症的小鼠中作者证明了CSC的有效抑制和对肿瘤复发和转移的显著抑制。该研究相信,这种基于水凝胶的智能递送系统代表了一种具有临床潜力的转移性癌症治疗策略。相关工作以“Stimuli-Responsive Hydrogels Potentiating Photothermal Therapy against Cancer Stem Cell–Induced Breast Cancer Metastasis”为题发表在ACS NANO。

【文章要点】
本文设计了一种纳米水凝胶ATH,以负载AIE光热剂和硫硝嗪(THZ),使其在光热效应下具有凝胶到溶液的转变行为。AIE点首先是通过使用纳米沉淀法将名为2TT-oC26B的AIE光热剂与DSPE-PEG偶联而合成的。随后,将AIE点与THZ混合到琼脂糖水凝胶中,以获得智能热响应水凝胶,该水凝胶在37°C下进一步固化形成ATH水凝胶。当温度升高时,ATH可软化成溶液状态。因此基于ATH迷人的近红外光触发相变过程,药物释放动力学也得到了理想的控制(图1)。
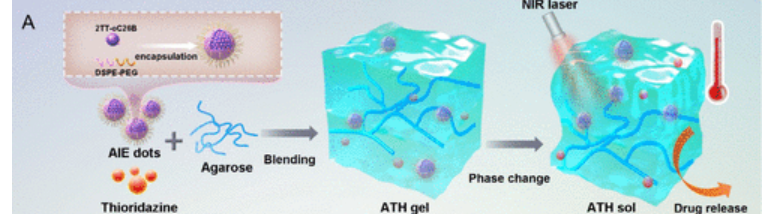
图1 水凝胶的制备过程
在原位肿瘤积聚后,AIE光热剂在近红外激光照射下产生轻微的PTT(约45°C)效应,使热响应性水凝胶溶解,释放AIEgen和THZ以侵入肿瘤的深处。在可控制的药物释放到癌症细胞中后,多巴胺受体(DR)拮抗剂THZ抑制DR表达并诱导氧化应激,导致PTT扩增、CSC有效凋亡和增殖抑制(图2)。因此,乳腺肿瘤的抑制、对癌症转移的有效抵抗和复发都得到了明确的体现。此外,包封的水凝胶复合材料引起的副作用可以忽略不计,这表明该热响应性水凝胶系统在局部递送无法全身给药的药物方面具有巨大的潜力。
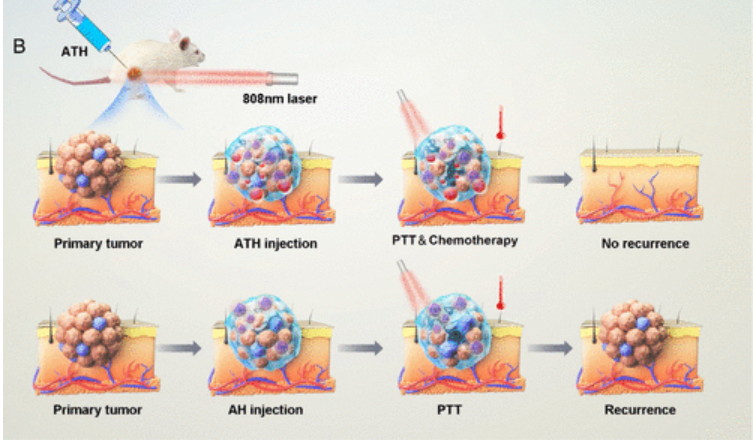
图2 治疗机制
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.4c04067


