李军教授:肿瘤治疗相关的“肝硬化”监测和治疗
时间:2024-08-14 17:00:24 热度:37.1℃ 作者:网络
肿瘤治疗药物在延长患者生存期、提高生活质量方面发挥着至关重要的作用。然而,随着这些高效疗法的广泛应用,其潜在的不良反应也逐渐受到重视,其中药物性肝损伤(Drug-Induced Liver Injury, DILI)是较为常见且严重的并发症之一。近期,南京医科大学第一附属医院/江苏省人民医院李军教授分享“肿瘤治疗相关的‘肝硬化’监测和治疗”,肝癌在线特将精华内容整理成文,以飨读者。
一、肿瘤后的“肝硬化”
Case:结肠癌手术、化疗后发现“肝硬化”
患者女,69岁,因“大便形状改变3个月”于2022年9月肠镜、胃镜检查。肠镜:发现结肠占位、结肠息肉;胃镜:胃多发息肉、慢性胃炎。CT检查降结肠局部增厚、强化;肝囊肿。
2022年10月10日行腹腔镜下左半结肠根治术,病理:中分化腺癌、溃疡型,侵犯肠壁全层,未见血管癌栓和神经侵犯;肠周淋巴结转移(1/4),分期T4aN1M0 IIIB期。
2022年11月18日开始奥沙利铂+卡培他滨化疗共6个疗程,化疗期间肝功能ALT、AST<100,GGT 100-200U/L,给予护肝药物治疗。
2023年10月11日MRI(普美显):肝实质信号不均,肝胆期呈多发结节样改变;肝内胆管未见扩张。肝硬化可能,脾大,FibroTouch CAP 220,LSM 9.7。
2023年11月胃镜见食管下端4条曲张静脉,局部串珠样改变,血管征阳性,齿状线清晰。
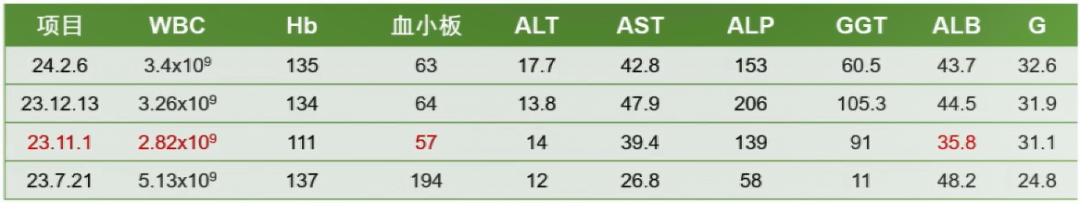
图1-患者生化监测
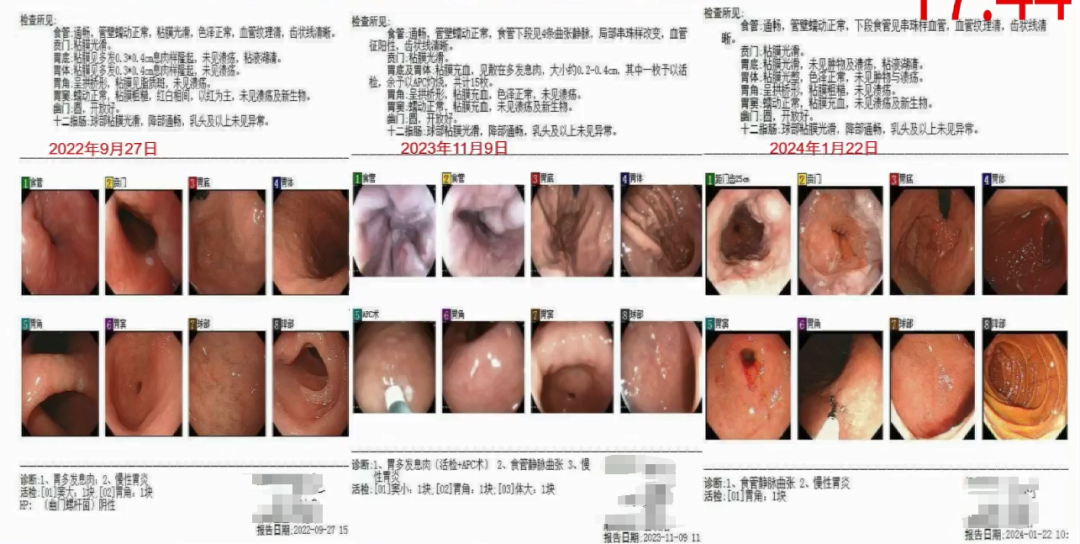
图2-患者胃肠镜检查
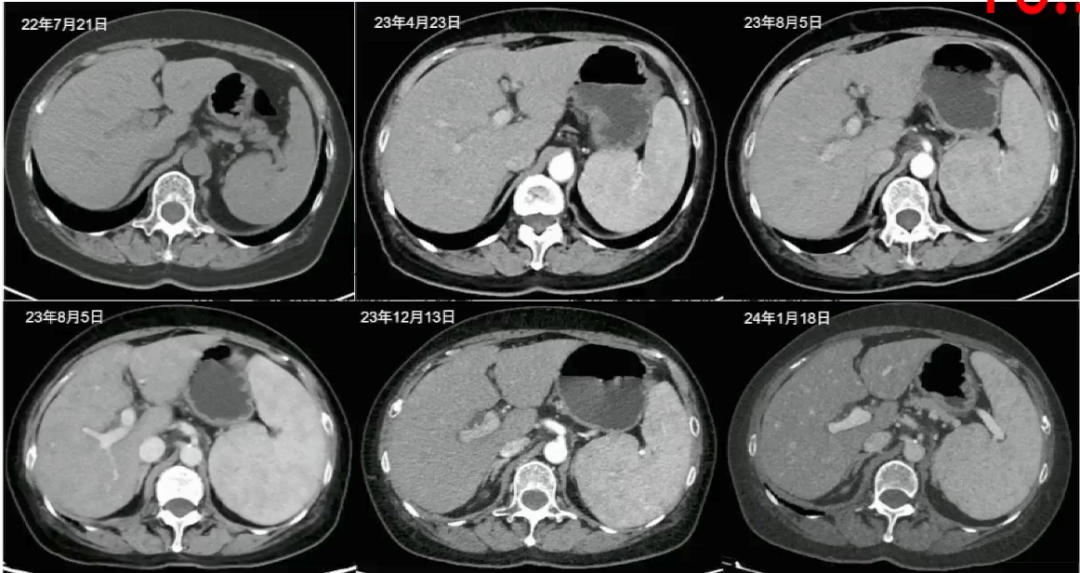
图3-患者影像学表现
二、肿瘤治疗相关的血管病变
该患者无慢性肝病史,现展现出肝脏形态学变化、脾脏肿大、食道静脉曲张等典型门脉高压表现,这些特征通常与“肝硬化”门脉高压相符。然而,这些变化继发于肠道肿瘤治疗之后,且无创纤维化检查FibroTouch LSM值为9.7,提示一定程度的肝纤维化但非确诊肝硬化的标准。因此,该患者是真“肝硬化” or “假性肝硬化”?肝硬化门脉高压 or 非肝硬化门脉高压?是肿瘤所致 or 化疗药物所致?等问题需进一步评估。
什么是“假性肝硬化”?假性肝硬化是一个放射学术语,指的是肝脏在影像学上呈现出类似肝硬化的形态学改变,但并非真正的肝硬化疾病。这一现象最常见于乳腺癌转移的化疗治疗后,或其他恶性肿瘤如胰腺癌、结肠癌、胃癌、肺癌、甲状腺髓样癌、食管癌及非霍奇金淋巴瘤等治疗前后。假性肝硬化大多数病例主要通过影像学检查确定,特别是在治疗后的监测过程中发现。通常其病情进展迅速,预后不佳,生存率低。
假性肝硬化的临床特征复杂,其发病机制主要涉及肿瘤细胞浸润、肿瘤细胞与肝细胞对化疗药物毒性的反应。在影像学上,假性肝硬化常表现为恶性肿瘤的肝转移、伴或不伴肝脏轮廓呈结节样、肝节段性体积减小、尾状叶增大等。CT、超声和MRI等影像学检查表现与肝硬化相同,包括可变的包膜回缩和肝结节、肝段性容积丢失、尾状叶增大以及结节轮廓的特定变化,如融合纤维化。在病理层面,假性肝硬化可以呈现肝窦血管形成血管栓塞、结节样增生,但无桥接纤维化或无假小叶形成等,如伴有肿瘤肝转移则同时呈现弥漫性肿瘤细胞浸润,浸润灶周围纤维化的特点。
门脉高压(Portal Hypertension,PH)可以由多种原因引起,根据解剖部位可分为肝前、肝内(窦前、窦性、窦后)和肝后,其中肝硬化是导致PH最常见的原因。非肝硬化门脉高压(Non-cirrhotic Portal Hypertension)患者无肝硬化,或无肝硬化相关危险因素,肝功能检查正常或轻度异常,影像检查门静脉、肝静脉或下腔静脉通畅,肝活检提示三种典型组织学征象,分别是闭塞性门静脉病、结节性再生增生、不完全性间隔纤维化。
这一特定疾病在不同地区有不同的命名习惯,如印度称之为非肝硬化门静脉纤维化,日本称为特发性门静脉高压,而西方国家定义为肝门静脉硬化症。2011年Schouten等人提出统一使用“特发性非肝硬化门静脉高压(Idiopathic Non-cirrhotic Portal Hypertension,INCPH)”,其中PH是诊断INCPH的必要条件。2019年血管肝病兴趣小组提出一个新定义:门-窦血管病(Portal-sinusoidal Vascular Disease,PSVD),病变涉及门静脉及肝血窦。
PSVD的致病机制复杂多样,涉及自身免疫性疾病(如系统性红斑狼疮、类风湿性关节炎等)、血液病及血栓前疾病(如抗磷脂综合征、多发性骨髓瘤)、感染、毒物或药物暴露(如硫唑嘌呤、博来霉素等)、遗传因素及代谢异常等。在组织学上,闭塞性门静脉病变、结节性再生增生及不完全性间隔纤维化是确诊PSVD的直接证据,出现肝窦扩张、巨窦、窦周纤维化、中央静脉异常、门静脉疝、门静脉周围异常血管、门静脉残余等需进一步怀疑PSVD的可能性。
奥沙利铂是一种化疗药物,治疗过程中主要引起以血管损伤为主的肝脏损伤,79%的患者会发生肝窦阻塞综合征(SOS),是一个比较特异性的表现,由于血管变化形成”蓝肝”。SOS进一步发展会演变为结节性再生性增生(NRH),NRH临床表现像肝硬化,但不是病理性肝硬化,可以引起脾大和脾功能亢进,导致血小板、白细胞的降低。
三、全程监测和管理肿瘤治疗
药物性肝损伤特殊临床表型少见,但临床医生在排除了其他常见病因后,应考虑到药物因素的可能性。
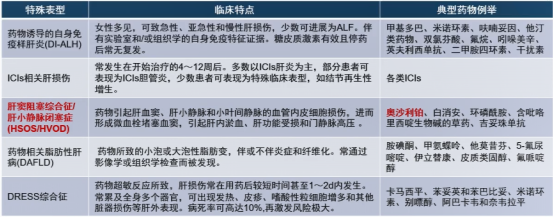
图4-常见的DILI特殊表型和相关药物
肝窦阻塞综合征(HSOS)/肝小静脉闭塞症(HVOD)可由多种因素引发,包括服用含吡咯里西啶类生物碱(PA)的植物如土三七,以及骨髓造血干细胞移植后大剂量化疗药物预处理、实体瘤化学治疗、器官移植术后应用免疫抑制剂等。
针对这一病症,中国指南提出了不同的治疗策略:吡咯里西啶类诱导的PA-HSOS,可采用“南京标准”诊断及抗凝-TIPS阶梯治疗策略(2,B)。大剂量化学治疗药物预处理、实体瘤化学治疗、器官移植术后应用免疫抑制剂等导致的HSOS,可参照Baltimore或改良Seattle标准诊断,有条件时可选择去纤肽治疗(4,C)。
对于伴有肝硬化门静脉高压等并发症的患者,需依据指南给予药物治疗(如卡维地洛、普萘洛尔等);可通过内镜下套扎或介入手术栓塞曲张的食管胃底静脉来预防消化道出血;对已发生消化道出血的患者,则可采用经颈静脉肝内门体分流术(TIPS)等进行治疗。
在肿瘤患者的全病程中,肝脏功能受损是一个常见的并发症,其发生原因多样,既包括肿瘤本身的进展或转移对肝脏的直接影响,也源于肿瘤治疗过程中使用的药物对肝脏造成的损害。这些药物性肝损害机制复杂,临床表现类型多样,受药物种类、剂量、疗程以及患者遗传因素的共同影响,可能在肿瘤治疗过程中随时发生,甚至延续至治疗结束后。此外,化疗药物不仅可能改变肝肿瘤的外观,也可能影响肝实质,降低肝脏CT检测转移灶的准确性。同时,化疗还可能引发一些少见的并发症,如假性肝硬化、门静脉血栓形成(PSVD)和硬化性胆管炎等。
临床上,特殊类型的肿瘤治疗药物性肝损伤易漏诊或误诊,如奥沙利铂相关的蓝肝综合征,其发生与治疗剂量、疗程相关,脾脏肿大和血小板降低与肝脏受损严重程度相关。因此,肿瘤治疗中肝脏功能需要全方位的监测,包括常规的血液生化、血常规等常规、血液中肿瘤标志物;对于不明原因的PH或肝功能异常、TE-LSM<10kPa的患者,应该怀疑PSVD的可能性;影像学的监测包括肿瘤原发灶、可能的转移灶、治疗药物继发的肝脏变化;必要时,还需内镜、病理等特殊检查。


