【协和医学杂志】机器人胰十二指肠切除术:手术步骤及技术要领
时间:2024-08-17 22:04:16 热度:37.1℃ 作者:网络
过去40年间,胰腺癌的5年生存率提高了4倍,这得益于靶向、免疫及新辅助治疗等多种治疗方法的进步,但外科手术仍然是最重要的治疗手段[1-2]。其中,以胰十二指肠切除术最具代表,其也是公认的腹部外科手术中难度最高的术式之一,被誉为外科手术的“珠穆朗玛峰”[3]。
21世纪是微创外科和加速术后康复的医疗时代,胰十二指肠切除术因术中难度和风险不可预控,从传统开腹方式到腔镜手术,再到外科机器人手术系统,初期的推广应用均相对滞后。因此,需要开发更为规范和标准的手术流程以及更精炼和易操作的切除、重建技术,以推动机器人胰十二指肠切除术(RPD)在学科中的应用。
2003年,Melvin等[4]首次报道了机器人胰腺切除术,为全球RPD 的发展奠定了良好开端。此后,国内外机器人胰腺切除术迅速发展。多项大型回顾性研究证实,RPD在经验丰富的外科医生中安全可行[5-9],机器人手术技术正以更精准的操作、更小的创伤、更快的患者术后康复等优势迅速应用于胰腺外科领域,而大量多中心高质量研究亦证实了RPD的稳定性和高效性。由于弥补了腹腔镜二维成像、刚性器械、角度受限和易造成术者双手疲劳震颤等限制性短板,相较于腹腔镜胰十二指肠切除术及传统开腹术式,RPD在手术时间、器官重建、中转开腹率、患者住院时间等方面存在优势[10-17]。
因消化道重建的复杂性和机器人手术技术的高要求,RPD目前仅在少数高度专业化的中心开展和实施[5-7,12],因此迫切需要建立安全、易行的RPD手术规范以缩短胰腺外科医生的学习曲线。本文将结合中国人民解放军总医院第一医学中心团队经验和笔者自身体会,介绍RPD的手术步骤,并对其中关键技术要领进行详细阐释,以期推动机器人手术系统在胰腺外科的标准化、规范化应用。
1 手术步骤
由笔者团队牵头,多国家、多地区微创专家共同制定的《国际机器人胰腺手术指南(2023)》[18],明确了RPD的适应证,即胰头和壶腹周围区域的良性和恶性肿瘤,以及需要胰十二指肠切除术的胰头边缘可切除肿瘤。2020年,Giulianotti等[19]将芝加哥伊利诺伊大学开展的RPD手术总结为17个步骤,有利于该手术的标准化,在这一方法的指导下,结合本中心丰富的RPD手术经验,笔者进一步将RPD概括为18个步骤。
1.1 Trocar分布
取仰卧分腿位,气腹穿刺针制造气腹后,5孔法布置Trocar(图1)[20]。
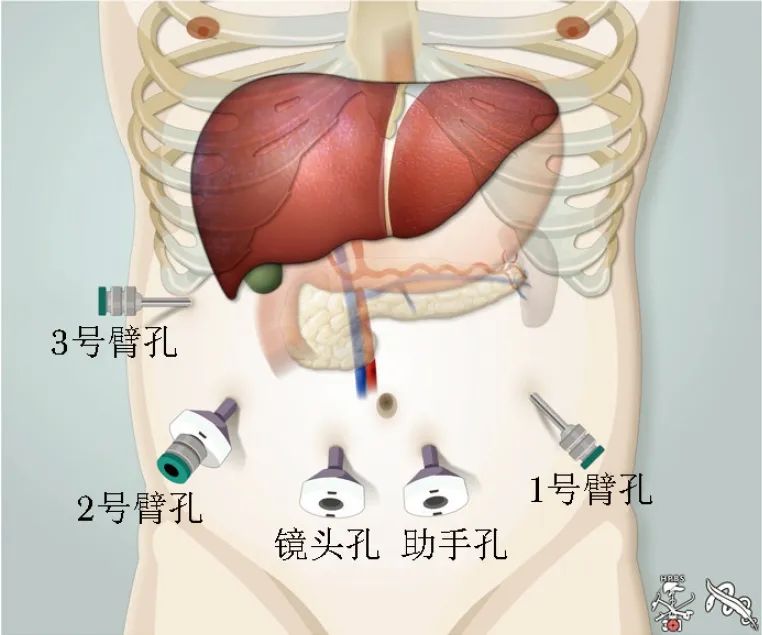
图1 Trocar位置分布[20]
置镜孔于脐右下方,助手孔于脐左下方,1号机械臂置于左锁骨中线脐水平,2号机械臂与1号臂中线对称(使用 Trocar in Trocar方式),3号机械臂位于右侧肋缘下腋前线附近。建议术中根据需要通过提起腹壁稍微改变1号臂的位置,此法对改善操作角度非常有效。例如,行肝门淋巴结清扫时可将1号臂向头侧抬起,解剖钩突时可调整至右侧和尾侧,胃空肠吻合术时可调整至左外侧。
1.2 切除
步骤(1)分离胃结肠韧带:
3号臂用Cadiere镊将胃向上夹起,使胃结肠韧带处于适当的张力下并用超声刀将其切开,进入小网膜囊探查胰腺前壁和胃后壁。
步骤(2)识别肠系膜上静脉(SMV):
打开胰腺下缘边界,识别SMV腹侧部分。分离右上结肠静脉,胃网膜右静脉和胃结肠干,随后沿着胰头和横结肠肠系膜间隙分离至十二指肠侧壁。
步骤(3)游离结肠肝曲:
沿着Toldt筋膜向右游离结肠肝曲,充分暴露十二指肠降段。
步骤(4)扩大 Kocher 手法:
3号臂用Cadiere钳将十二指肠向左上侧牵拉,以游离十二指肠水平部和胰头背部。应用Kocher手法显露下腔静脉、左肾静脉、肠系膜上动脉(SMA) 和腹腔干。扩大Kocher手法可准确评估肿瘤可及性,有助于Treitz韧带、钩突分离和腹膜后淋巴结清扫(主动脉旁区域LN No.16)。
步骤(5)空肠第一段的游离与横断:
将Treitz韧带和十二指肠空肠曲分离后,通过SMV的后部将空肠第一段牵拉至主动脉-肠系膜轴的右侧,并用切割吻合器横断。用超声刀在靠近空肠处离断空肠系膜,以避免肠系膜血管出血。
步骤(6)钩突分离:
从近端到远端剥离SMA,放松钩突背侧。剥离胰十二指肠下血管,然后立即从尾端向头端离断钩突,以实现SMA和SMV右壁的完美暴露。以Hem-o-lok夹紧SMA和SMV大分支并离断。对位于钩状或侵犯肠系膜上血管的肿瘤,笔者通常在SMV和/或SMA周围放置彩带进行“悬挂”操作。建议助手将SMA向左轻轻牵拉,这种优化显露有助于肠系膜上血管的骨骼化。
步骤(7)分离远端胃:
游离、结扎、分离胃大弯、胃小弯的血管后,使用腔镜切割吻合器横断远端胃。建议在横断前,切钉应关闭足够长的时间以充分压迫胃壁以预防残胃出血。
步骤(8)探查肝门:
解剖肝门,识别肝总动脉、胃十二指肠动脉、门静脉和胆总管位置。骨骼化胃右动脉,结扎并在根部截断。打开胰腺上三角(胃十二指肠动脉、肝总动脉和胰腺上缘)以识别门静脉前壁。
步骤(9)横断胰颈:
使用超声刀横断胰颈。横断前需暴露胰颈上下边缘, 但无需建立门静脉/胰隧道。横断胰腺实质时,需识别主胰管并使用冷剪刀切割。对于伴有扩张的主胰管,可使用电凝钩或超声刀。在胰腺残端的上缘和下缘边界,需备4-0 Prolene缝线止血。若肿瘤距离胰腺横切缘小于1 cm,且怀疑有胰腺横切缘浸润,建议切缘送冰冻切片病理检测。此外,如纤维化严重致肿瘤边缘不清,术者可综合分析后选择是否术中送冰冻切片病理检测。
步骤(10)横断胃十二指肠动脉:
Hem-o-lok夹紧胃十二指肠动脉后横断,并采用4-0不可吸收缝线结扎,以加强血管残端。
步骤(11)游离胆囊和横断胆总管:
游离、结扎、分离胆囊动脉后,使用电钩将胆囊游离至胆囊管,但不截断。随后分离胆总管,用Hem-o-lok夹紧胆囊管远端。直径大于1 cm的胆总管,通常使用电钩分离,小于1 cm则建议使用冷剪。若怀疑胆道横断缘受到侵犯,建议切缘送冰冻切片病理检查。
步骤(12)淋巴结清扫:
通常使用“悬吊法”在肝总动脉和门静脉周围放置血管阻断带。随后将肝十二指肠韧带淋巴结沿肝总动脉和门静脉平面分成左右两部分(左侧为12b、12c,右侧为12a、8a、8p),中间由12p连接。清扫左侧淋巴结,并与12p淋巴结一同牵拉至门静脉右后侧,进行整块切除。肝十二指肠韧带周围软组织全部分离并骨骼化。在该步骤中,笔者通常对胰腺癌患者在RPD期间行扩大淋巴结切除术。在扩大切除期间,胰周区(LN No.13,17)、SMA(LN No.14)和主动脉旁区(LN No.16)周围的淋巴结被切除。
步骤(13)标本放置:
切除步骤完成后,标本放入取出袋中但不取出,以避免肿瘤扩散。
1.3 重建
步骤(14)“301”式胰肠吻合:
在主胰管内置入支撑管,然后用5-0 Vicryl线固定。4-0 Prolene线 8字缝合胰腺断端,再固定胰腺断端上端于空肠肠壁上。电凝钩在空肠壁开孔,将胰管支撑管置入空肠。4-0 Prolene线行胰腺断端全层对空肠浆肌层自上而下的连续缝合,根据胰腺大小,需缝合4~6次。内支架直接置入肠内,无需导管与空肠黏膜吻合。另外,对于较大的导管,导管-黏膜吻合术可采用4-0 PDSⅡ间断缝合。最后,将连续缝合线的两端收紧并打结,使胰腺残端紧贴空肠浆膜,以消除任何残留的死腔,保证胰腺残端完全被空肠覆盖(图2)[21]。
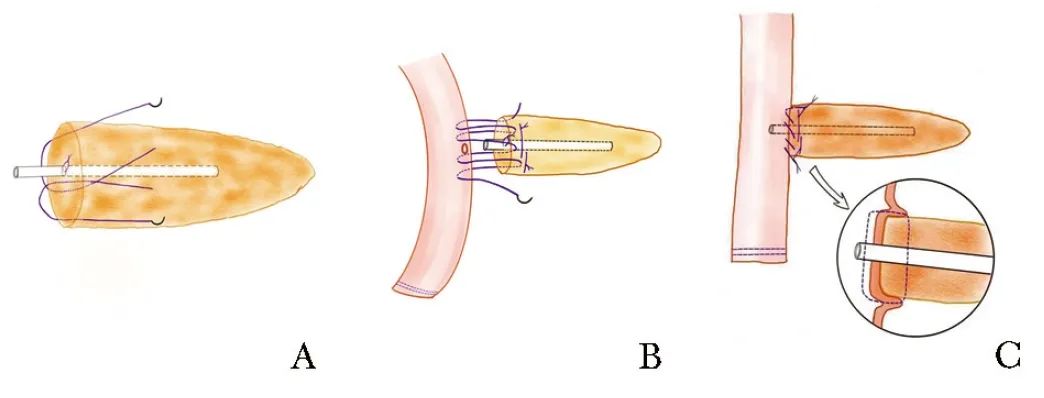
图2 “301”式胰肠吻合示意图[21]
A.8字或U型缝合胰腺断端全层;B.胰腺断端全层对空肠浆肌层,单层连续缝合;C.收紧缝线打结
步骤(15)胆管空肠吻合术:
胆管空肠吻合为单层吻合,一层前,一层后。直径小于1 cm的胆管,每层采用5-0 PDSⅡ间断缝合。直径超过1 cm的胆管,每层采用4-0 PDSⅡ连续缝合。连续缝合时,助手需轻轻收紧缝线,防止胆漏。由于胆肠吻合口左侧已有胰肠吻合口,其是消化道重建后的左侧起始空肠袢的固定点,故胆肠吻合时建议从右向左缝合,从而减少吻合口张力。
步骤(16)“L孔”入路胃空肠吻合术:
“L孔”法指从左横结肠系膜上形成通道,其位于中结肠动脉左侧的无血管区域。使用超声刀或电钩打开结肠系膜区域,进行结肠后胃空肠吻合。胃空肠吻合在胃后壁和空肠近端之间建立,距胆管空肠吻合口约40~50 cm,建议用4-0缝线缝合。胃空肠吻合完成后,不应关闭L孔,且L孔开口应足够大以防止腹内疝的发生。
步骤(17)放置引流管:
所有吻合完成后,通常放置2根引流管,一根位于Winslow孔,另一根位于胰空肠吻合口下缘,分别引流胆肠、胰肠吻合口附近的液体。通畅引流是处理术后胰瘘的有效途径。建议术后第1、3、5天检查引流液淀粉酶,若检测结果为阴性,则将引流管去除。
步骤(18)取出标本:
标本通过耻骨上的Pfannenstiel切口或扩大助手孔纵切口取出。
2 技术要领
与传统开腹胰腺手术相比,机器人手术有以下特点:高清放大的成像视野,自下向上(足侧向头侧)的仰视视角,狭窄密闭空间内的离台间接操作,术者和助手主次分明,力度反馈缺乏等。这些特点决定了不能直接套用传统开腹手术的方法进行微创手术,而应对手术操作逻辑和技术方法作出改变[22]。RPD目前术式较多,复杂操作会削减初学者的学习信心,需要规范化和更易掌握的技术以达到手术目的。笔者团队对术式升级改进,并进行了临床安全验证,提出了环血管切除技术、“301”式胰肠吻合、LR孔胃肠/胆肠吻合等技术要领,下面将逐一进行阐释。
2.1 环血管切除技术
传统的胰十二指肠切除术先离断胰腺颈部,再行胰腺钩突切除[23],但一些进展期胰腺癌往往伴有肠系膜血管侵犯而导致其无法切除。为提前判断手术的可切除性,更好地控制术中出血,达到R0切除,学者们提出了“动脉优先”“钩突先行”的手术入路[24-26]。但由于胰头部解剖关系复杂,这些入路只能在较大的胰腺外科平台完成,若RPD使用上述入路则需要更长时间的学习曲线。
为提高胰十二指肠切除术的安全性,笔者提出“环血管切除技术”,该技术可预防对目标血管和变异血管的损伤。机器人手术系统因离台操作,缺乏触感反馈,若术中出现大出血,只能依靠缝合止血,故具有预控出血理念的环血管切除技术非常适用于RPD。
环血管切除技术遵循了“定、寻、校、优”的“四标手术”原则[27],是以显露血管为主线和“以防代控”的预控理念控制术中出血的手术方法[28-29]。即在RPD过程中,以肠系膜上动静脉、肝动脉、门静脉为轴线,纵行逐步打开血管鞘和周围结缔组织,再进一步完成环血管的胰腺组织切除。
除外环血管切除技术在复杂手术中的重要意义(如优化手术流程、预先判断可切除性、保护重要血管、提高R0切除率等),RPD结合该技术优势还体现在机器人机械臂稳定性和视野三维放大等方面,更有利于环血管切除技术的精准实施;同样,环血管切除技术的简易性,使机器人手术的实施更为安全、高效[30]。值得注意的是,机器人环血管切除技术需建立在对血管解剖及其变异充分理解的基础上,同时需掌握精细的机器人手术操作技巧,如有条件可行术前三维重建,对血管走形和切除范围进行提前规划,以减少术中意外的发生。
2.2 “301”式胰肠吻合
胰腺断端重建是胰十二指肠切除术中难度最高的消化道重建方法,也是决定手术效果的关键因素。多年来,外科医生基于技术进步、器械革新、缝线选择等不断尝试新的吻合术式,总体而言,主要分为以下三类:
1 胰管封闭:
该术式因并未减少胰瘘等并发症,反而增加胰腺内分泌功能不全的发生风险而逐渐退出历史舞台[31]。
2 胰胃吻合:
该术式与胰肠吻合之间存在争议,纳入10项随机对照试验的最新系统评价亦无法评估二者之间的优劣[32]。但就目前而言,胰肠吻合使用度远超胰胃吻合[33]。
3 胰肠吻合:
该术式被多数学者认为是“标准化”的吻合方式。按吻合解剖对位又分套入式、胰管空肠导管对黏膜、胰管空肠侧侧吻合和Blumgart等多种胰肠吻合方式[34-36]。
笔者结合既往术式基础、文献报道和本中心大量经验,先后创立了“3重式”、“1+2式”和“1+1式”胰肠吻合方式,并进一步优化吻合方案,倡导低张力低应力重建[30],推出单针全层胰肠吻合,即“301”式胰肠吻合[21]。该术式中,主胰管置管固定后,胰腺断面缝合3针加固,胰腺与空肠紧密贴合保持零间隙,再行1针单层连续的胰肠吻合[21,37]。由于宽针距的连续缝合缓解了缝线切割应力,且较多层、间断缝合省时易操作,成为目前RPD的最佳胰肠吻合术式。
笔者团队评估了“301”式胰肠吻合在RPD中的安全性,结果表明无论胰管大小和质地如何,该吻合方式均不增加胰瘘等并发症的发生风险[38]。为增加结果的可信度,笔者团队进一步开展了RPD期间“301”式胰肠吻合与改良Blumgart胰肠吻合的前瞻性随机对照试验,结果同样证实“301”式胰肠吻合耗时更短,且B/C级胰瘘更少[39]。
上述证据强有力地支持了RPD下“301”式胰肠吻合的优势。既往过于严密的胰肠吻合易造成吻合口血供不足,过高的吻合口张力也会导致胰腺组织水肿,严重的缝线切割损伤易导致胰液从针孔渗出形成胰瘘,此外,多层、过密的缝合增加了机器人手术难度,导致手术时间延长,术后并发症发生率相比传统术式并未降低。“301”式胰肠吻合不仅最大程度与RPD相契合,与腹腔镜及开腹胰十二指肠切除术同样适配,该术式简单易行、安全可靠,可显著缩短年轻胰腺外科医生的学习曲线。
2.3 经LR孔胃肠/胆肠重建
L孔和R孔是横结肠系膜在结肠中动脉左右两侧的薄弱区域 (图3)[30],因区域内无血管而被选作打孔位置。
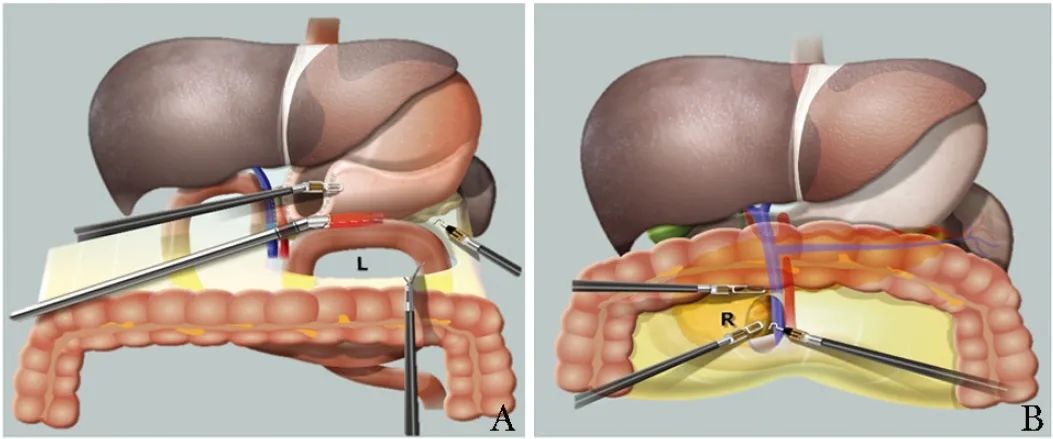
图3 L孔、R孔示意图[30]
A.L孔胃肠吻合;B.R孔钩突分离、胆肠吻合
L孔和R孔可缩短近端空肠与肝门胆管及胃之间的距离,降低胃肠和胆肠吻合张力,减少因显露不清而反复牵拉、翻转肠管的次数,防止发生医源性肠道损伤。笔者团队研究发现,在机器人辅助下经 L 孔能够便捷地找到近端空肠,使结肠后的胃肠吻合简便易行,同时可减少对横结肠的物理干扰频次,明显缩短了重建时间,并降低术后胃排空障碍的发生率[40]。位于右侧的R孔不仅可为提拉式胆肠吻合的视野暴露提供便利,还有利于钩突的显露分离。
3 小结与展望
RPD手术时间长、技术要求高、学习曲线长、术后并发症多,阻碍了其在临床的广泛应用。本文总结了RPD的手术步骤,并对其中3个关键技术革新(环血管切除技术、“301”式胰肠吻合和经LR孔胃肠/胆肠重建)进行阐述,使初学者能够更安全地开展RPD,缩短学习曲线。笔者建议,RPD的学习应在经验丰富的外科医生监督下,从术前评估挑战性较小的病例着手,在达到安全熟练程度后,再逐步增加复杂程度。此外,目前尚缺乏吻合方式选择与消化道重建效果相关性的研究数据,但毫无疑问,吻合质量将决定手术成败,因此术者应选择自己最擅长、最简便易行的吻合方式。
机器人系统配备有高分辨率的三维成像和微创操作手臂,可为术者提供更好的手术视野和操作角度,使外科医生能够高效完成更为复杂的技术操作,如淋巴结清扫、器官重建等。相信随着智能医学的发展及相关技术的推广普及,机器人手术系统将在包括胰十二指肠切除术等复杂手术中占据主导地位。
参考文献
[1]Siegel R L, Miller K D, Wagle N S, et al. Cancer statistics, 2023[J]. CA Cancer J Clin, 2023, 73(1): 17-48.
[2]Park W, Chawla A, O'Reilly E M. Pancreatic cancer: a review[J]. JAMA, 2021, 326(9): 851-862.
[3]刘荣, 赵国栋. LR式机器人胰十二指肠切除术手术方法建立和技术优化[J]. 中华腔镜外科杂志(电子版), 2016, 9(4): 193-195.
[4]Melvin W S, Needleman B J, Krause K R, et al. Robotic rep of pancreatic neuroendocrine tumor[J]. J Laparoendosc Adv Surg Tech A, 2003, 13(1): 33-36.
[5]Zureikat A H, Beane J D, Zenati M S, et al. 500 Minimally invasive robotic pancreatoduodenectomies: one decade of optimizing performance[J]. Ann Surg, 2021, 273(5): 966-972.
[6]Shi Y S, Wang W S, Qiu W H, et al. Learning curve from 450 cases of robot-assisted pancreaticoduocectomy in a high-volume pancreatic center: optimization of operative proce-dure and a retrospective study[J]. Ann Surg, 2021, 274(6): e1277-e1283.
[7]Zeh H J, Zureikat A H, Secrest A, et al. Outcomes after robot-assisted pancreaticoduodenectomy for periampullary lesions[J]. Ann Surg Oncol, 2012, 19(3): 864-870.
[8]Zhang T, Zhao Z M, Gao Y X, et al. The learning curve for a surgeon in robot-assisted laparoscopic pancreaticoduodenectomy: a retrospective study in a high-volume pancreatic center[J]. Surg Endosc, 2019, 33(9): 2927-2933.
[9]Boone B A, Zenati M, Hogg M E, et al. Assessment of quality outcomes for robotic pancreaticoduodenectomy: identification of the learning curve[J]. JAMA Surg, 2015, 150(5): 416-422.
[10]Liu R, Zhang T, Zhao Z M, et al. The surgical outcomes of robot-assisted laparoscopic pancreaticoduodenectomy versus laparoscopic pancreaticoduodenectomy for periampullary neoplasms: a comparative study of a single center[J]. Surg Endosc, 2017, 31(6): 2380-2386.
[11]Liu Q, Zhao Z M, Zhang X P, et al. Perioperative and oncological outcomes of robotic versus open pancreaticoduodenectomy in low-risk surgical candidates: a multicenter propensity score-matched study[J]. Ann Surg, 2023, 277(4): e864-e871.
[12]Zhang X P, Xu S, Zhao Z M, et al. Outcomes of robotic versus laparoscopic pancreatoduodenectomy following learning curves of surgeons: a multicenter study on 2255 patients[J/OL]. Ann Surg,2023,Dec 11. doi: 10.1097/sla.0000000000006167.
[13]Zhang X P, Xu S, Zhao Z M, et al. Robotic pancreaticoduodenectomy for pancreatic ductal adenocarcinoma: analysis of surgical outcomes and long-term prognosis in a high-volume center[J]. Hepatobiliary Pancreat Dis Int, 2023, 22(2): 140-146.
[14]Wang W, Liu Q, Zhao Z M, et al. Comparison of robotic and open pancreaticoduodenectomy for primary nonampullary duodenal adenocarcinoma: a retrospective cohort study[J]. Langenbecks Arch Surg, 2022, 407(1): 167-173.
[15]Xu S, Zhang X P, Zhao G D, et al. Robotic versus open pancreaticoduodenectomy for distal cholangiocarcinoma: a multicenter propensity score-matched study[J]. Surg Endosc, 2022, 36(11): 8237-8248.
[16]Liu Q, Jiang N, Tian E Y, et al. Short-term outcomes of robotic versus open pancreaticoduodenectomy in elderly patients: a multicenter retrospective cohort study[J]. Int J Surg, 2022, 104: 106819.
[17]Liu Q, Li M Y, Gao Y X, et al. Effect of robotic versus open pancreaticoduodenectomy on postoperative length of hospital stay and complications for pancreatic head or periampullary tumours: a multicentre, open-label randomised controlled trial[J]. Lancet Gastroenterol Hepatol, 2024, 9(5): 428-437.
[18]Liu R, Abu Hilal M, Besselink M G, et al. International consensus guidelines on robotic pancreatic surgery in 2023[J]. Hepatobiliary Surg Nutr, 2024, 13(1): 89-104.
[19]Giulianotti P C, Mangano A, Bustos R E, et al. Educational step-by-step surgical video about operative technique in robotic pancreaticoduodenectomy(RPD) at University of Illinois at Chicago(UIC): 17 steps standardized technique-lessons learned since the first worldwide RPD performed in the year 2001[J]. Surg Endosc, 2020, 34(6): 2758-2762.
[20]赵国栋, 刘荣. 机器人肝胆胰手术Trocar布置方法的教学与实践[J]. 中华腔镜外科杂志(电子版), 2018, 11(3): 166-171.
[21]刘荣, 赵之明, 姜楠. 胰肠吻合的历史发展及 “301” 式胰肠吻合的变迁[J]. 中华腔镜外科杂志(电子版), 2020, 13(1): 1-4.
[22]刘荣, 王子政. 微创胰腺手术的技术难题与对策[J]. 腹腔镜外科杂志, 2019, 24(3): 169-171.
[23]Yeo C J, Cameron J L, Sohn T A, et al. Pancreaticoduodenectomy with or without extended retroperitoneal lymphadenectomy for periampullary adenocarcinoma: comparison of morbidity and mortality and short-term outcome[J]. Ann Surg, 1999, 229(5): 613.
[24]Hackert T, Werner J, Weitz J, et al. Uncinate process first--a novel approach for pancreatic head rep[J]. Langenbecks Arch Surg, 2010, 395(8): 1161-1164.
[25]Pessaux P, Rosso E, Panaro F, et al. Preliminary experience with the hanging maneuver for pancreaticoduodenectomy[J]. Eur J Surg Oncol, 2009, 35(9): 1006-1010.
[26]Kawai M, Hirano S, Yamaue H. Artery-first approach for pancreaticoduodenectomy[J]. J Hepatobiliary Pancreat Sci, 2018, 25(6): 319-320.
[27]刘荣, 刘渠. 肝胆胰外科应努力达到 “四标”[J]. 中华医学杂志, 2022, 102(18): 1323-1325.
[28]刘荣, 尹注增. 环血管技术在胰腺微创手术中的应用[J]. 中华普通外科杂志, 2023, 38(7): 537-539.
[29]刘荣, 刘渠, 赵国栋, 等. 环血管技术在胰十二指肠切除术中的应用[J]. 解放军医学院学报, 2022, 43(11): 1109-1112.
[30]刘荣, 刘渠. 机器人肝胆胰手术的切除与重建[J]. 协和医学杂志, 2023, 14(6): 1125-1130.
[31]Tran K, Van Eijck C, Di Carlo V, et al. Occlusion of the pancreatic duct versus pancreaticojejunostomy: a prospective randomized trial[J]. Ann Surg, 2002, 236(4): 422-428.
[32]Cheng Y, Briarava M, Lai M L, et al. Pancreaticojejunostomy versus pancreaticogastrostomy reconstruction for the prevention of postoperative pancreatic fistula following pancreaticoduodenectomy[J]. Cochrane Database Syst Rev, 2017, 9(9): CD012257.
[33]卫强, 叶茜薇, 徐骁, 等. 胰十二指肠切除后胰腺残端与消化道吻合方式研究进展[J]. 中华普通外科杂志, 2018, 33(6): 527-530.
[34]Kakita A, Yoshida M, Takahashi T. History of pancreaticojejunostomy in pancreaticoduodenectomy: development of a more reliable anastomosis technique[J]. J Hepatobiliary Pancreat Surg, 2001, 8(3): 230-237.
[35]VARCO R L. A method of implanting the pancreatic duct into the jejunum in the Whipple operation for carcinoma of the pancreas; case report[J]. Surgery, 1945, 18: 569-573.
[36]Halloran C M, Platt K, Gerard A, et al. PANasta trial; Cattell Warren versus Blumgart techniques of panreatico-jejunostomy following pancreato-duodenectomy: study protocol for a randomized controlled trial[J]. Trials, 2016, 17: 30.
[37]刘荣, 刘渠, 赵之明, 等. 单针全层胰肠吻合(301式) 在胰十二指肠切除术中的应用[J]. 腹腔镜外科杂志, 2018, 23(11): 854-857.
[38]Liu Q, Zhao Z M, Gao Y X, et al. Novel single-layer continuous suture of pancreaticojejunostomy for robotic pancreaticoduodenectomy[J]. J Hepatobiliary Pancreat Sci, 2020, 27(2): 56-63.
[39]Liu Q, Zhao Z M, Gao Y X, et al. Novel technique for single-layer pancreatojejunostomy is not inferior to modified blumgart anastomosis in robotic pancreatoduodenectomy: results of a randomized controlled trial[J]. Ann Surg Oncol, 2021, 28(4): 2346-2355.
[40]Wang C Y, Huang T S, Zhang K D, et al. Retrocolic versus antecolic gastrointestinal reconstruction in robotic pancreaticoduodenectomy[J]. J Hepatobiliary Pancreat Sci, 2019, 26(11): 517-523.


